2021届高考化学一轮复习水的电离和溶液的酸碱性作业(1)
考点规范练23 水的电离和溶液的酸碱性
(时间:45分钟 满分:100分)
考点规范练第46页
一、选择题(本题共10小题,每小题5分,共50分。每小题只有一个选项符合题目要求)
1.下面是一段关于酸碱中和滴定实验操作的叙述:①取一锥形瓶,用待测NaOH溶液润洗两次 ②在锥形瓶中加入25 mL待测NaOH溶液 ③加入几滴石蕊溶液作指示剂 ④取一支酸式滴定管,洗涤干净 ⑤直接往酸式滴定管中注入标准酸溶液,进行滴定 ⑥左手旋转滴定管的玻璃活塞,右手不停摇动锥形瓶 ⑦两眼注视着滴定管内盐酸液面下降,直至滴定终点。文中所述操作有错误的序号为( )。
A.④⑥⑦ B.①⑤⑥ C.③⑤⑦ D.①③⑤⑦
答案:D
解析:锥形瓶不用待测液润洗,①错;③石蕊变色不明显,不易观察颜色,在酸碱中和滴定时不用石蕊溶液作指示剂,③错;滴定管使用前要润洗,⑤错;滴定过程中眼睛观察锥形瓶中溶液颜色变化,⑦错。
2.某温度下,向c(H+)=1×10-6 mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2 mol·L-1。下列对该溶液的叙述不正确的是( )。
A.该温度高于25 ℃
B.由水电离出来的H+的浓度为1×10-10 mol·L-1
C.加入NaHSO4晶体抑制水的电离
D.取该溶液加水稀释100倍,溶液中的c(OH-)减小
答案:D
解析:该温度下蒸馏水中c(H+)=1×10-6 mol·L-1,大于25 ℃时纯水中c(H+),故温度高于25 ℃,A项正确;此温度下KW=1×10-12,故该NaHSO4溶液中c(OH-)=1×10-121×10-2 mol·L-1=1×10-10 mol·L-1,由水电离出的c(H+)与溶液中的c(OH-)相等,B项正确;加入NaHSO4后,NaHSO4电离出的H+抑制了水的电离,C项正确;加水稀释时,c(H+)减小,而KW不变,故c(OH-)增大,D项错误。
3.常温下,下列溶液一定呈碱性的是( )。
A.能与金属铝反应放出氢气的溶液
B.c(H+)c(OH-)=10-6的溶液
C.pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合
D.0.01 mol·L-1的氨水与0.01 mol·L-1的HCl溶液等体积混合
答案:B
解析:能与金属铝反应放出氢气的溶液可能呈酸性,也可能呈强碱性,A项错误;c(H+)c(OH-)=10-6<1,则c(H+)
7
答案:C
解析:室温下,将pH=11的氢氧化钠溶液加水稀释100倍,溶液中氢氧根离子浓度由1×10-3 mol·L-1变为1×10-5 mol·L-1,故c(H+)=1×10-9 mol·L-1,A项错误;氢氧化钠和氢氧化钡都是强电解质,所以两种溶液等体积混合时,氢氧根离子浓度等于二者氢氧根离子浓度之和的一半,即混合溶液中氢氧根离子浓度=12(10-5+10-1) mol·L-1≈0.05 mol·L-1,所以氢离子浓度为2×10-13 mol·L-1,则溶液的pH=-lg(2×10-13)= 12.7,B项错误;氯化氢和硫酸都是强电解质,两种溶液等体积混合时,c(H+)等于二者氢离子浓度之和的
一半,即混合溶液的氢离子浓度约等于0.05 mol·L-1,则混合溶液的pH=1.3,C项正确;pH=13的氢氧化钡溶液和pH=1的盐酸等体积混合,氢离子和氢氧根离子恰好反应完全,溶液呈中性,D项错误。
5.25 ℃时,下列叙述正确的是( )。
A.将pH=3的醋酸溶液和pH=11的NaOH溶液等体积混合后,pH>7
B.NH4HSO4溶液中滴加NaOH溶液至pH=7,则c(Na+)=2c(SO42-)
C.0.1 mol·L-1 CH3COOH溶液与0.1 mol·L-1 CH3COONa溶液等体积混合后pH<7,
则c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
D.KNO3溶液和CH3COONH4溶液pH均为7,两溶液中水的电离程度相同
答案:C
解析:由于醋酸为弱酸,pH=3的醋酸溶液和pH=11的NaOH溶液等体积混合后,醋酸过量,故混合后溶液显酸性,pH<7,A项错误;NH4HSO4溶液中滴加NaOH溶液至pH=7时,根据电荷守恒有c(Na+)+c(NH4+)=2c(SO42-),故B项错误;等浓度的CH3COOH溶液和CH3COONa溶液等体积混合后,溶液显酸性,结合电荷守恒有c(CH3COO-)>c(Na+)>c(CH3COOH)> c(H+)>c(OH-),故C项正确;KNO3为强酸强碱盐,对水的电离无影响,CH3COONH4为弱酸弱碱盐,对水的电离起促进作用,故D项错误。
6.常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是( )。
A.某溶液中由水电离出的c(OH-)=1×10-a mol·L-1,若a>7时,则该溶液的pH一定为14-a
B.将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:c(OH-)+c(A-)=c(H+)+c(Na+)
C.等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D.常温下NaHSO3溶液的pH<7,溶液中c(SO32-)7时说明水的电离受到抑制,溶液可能是酸或碱的溶液,则该溶液的pH可能为14-a或a,A项错误;将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1的NaOH溶液等体积混合后得到等浓度的HA和NaA的混合溶液,根据电荷守恒有:c(OH-) +c(A-)=c(H+)+c(Na+),B项正确;等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合,根据物料守恒有:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],C项错误;常温下NaHSO3溶液的pH<7,说明HSO3-的电离程度大于水解程度,溶液中c(SO32-)>c(H2SO3),D项错误。
7.下列说法中,正确的是( )。
A.一定温度下,向纯水中加入少量盐酸,c(H+)增大,KW将增大
B.25 ℃时,将pH=9的烧碱溶液稀释1 000倍所得到的溶液,pH=6
C.25 ℃时,水的离子积常数KW为1×10-14
D.100 ℃时,用pH试纸测得纯水的pH=6,此时纯水呈酸性
答案:C
解析:KW只与温度有关,与氢离子的浓度无关,A项错误;烧碱溶液不可能稀释为酸性,其pH只能无限接近于7,B项错误;25 ℃时,水的离子积常数KW为1×10-14,C项正确;在100 ℃时,用pH试纸测得的纯水的pH=6,则100 ℃时水的离子积为1×10-12,此时水的电离被促进,氢离子浓度和氢氧根离子浓度都为10-6 mol·L-1,故纯水呈中性,D项错误。
8.常温时,用0.100 0 mol·L-1 NaOH溶液滴定25.00 mL 0.100 0 mol·L-1某一元酸HX溶液,滴定过程中pH变化曲线如图所示。下列说法正确的是( )。
A.HX为强酸
B.在A点,c(HX)>c(X-)>c(Na+)>c(H+)>c(OH-)
C.在B点,两者恰好完全反应
D.在C点,c(X-)+c(HX)=0.1 mol·L-1
答案:B
解析:根据图像可知,0.100 0 mol·L-1 HX溶液的2c(X-)>c(Na+)>c(H+)>c(OH-),B项正确;在B点,pH=7,加入的NaOH溶液体积小于25.00 mL,没有恰好完全反应,C项错误;在C点,溶液的总体积为50 mL,由物料守恒可知:c(X-)+c(HX)=0.100 0mol·L-1×0.025 L0.05 L=0.05 mol·L-1,D项错误。
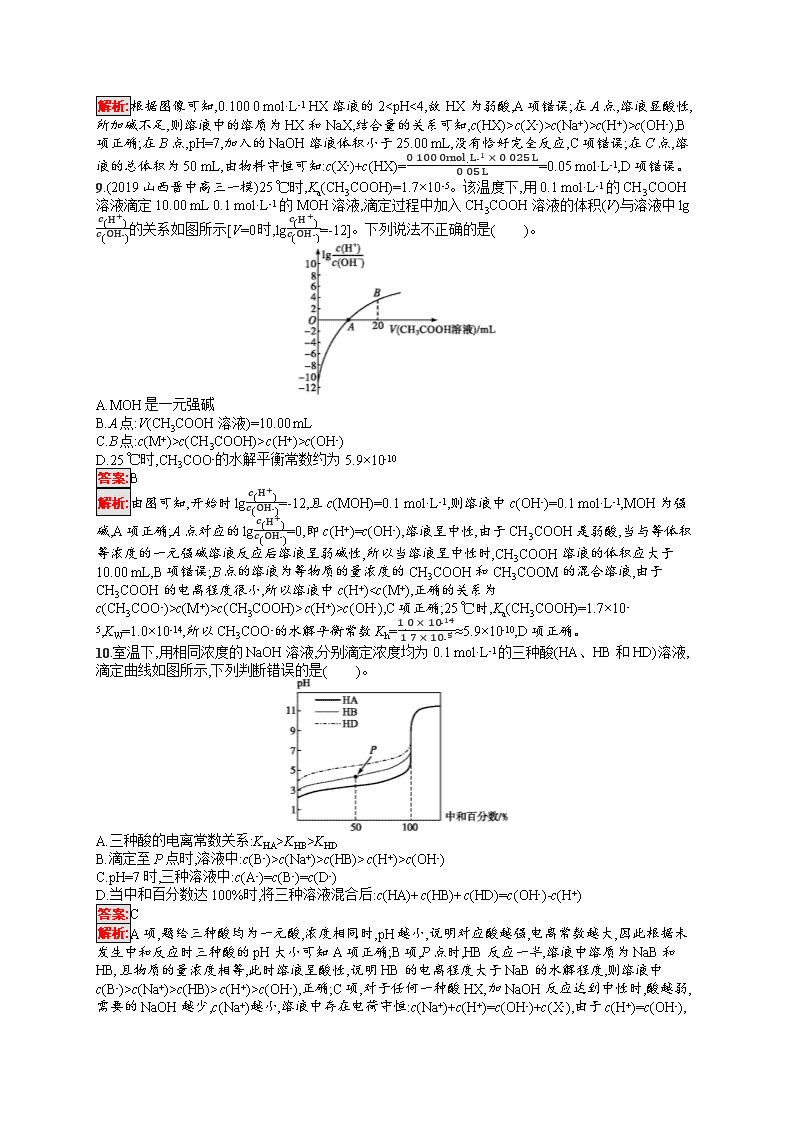
9.(2019山西晋中高三一模)25 ℃时,Ka(CH3COOH)=1.7×10-5。该温度下,用0.1 mol·L-1的CH3COOH溶液滴定10.00 mL 0.1 mol·L-1的MOH溶液,滴定过程中加入CH3COOH溶液的体积(V)与溶液中lgc(H+)c(OH-)的关系如图所示[V=0时,lgc(H+)c(OH-)=-12]。下列说法不正确的是( )。
A.MOH是一元强碱
B.A点:V(CH3COOH溶液)=10.00 mL
C.B点:c(M+)>c(CH3COOH)>c(H+)>c(OH-)
D.25 ℃时,CH3COO-的水解平衡常数约为5.9×10-10
答案:B
解析:由图可知,开始时lgc(H+)c(OH-)=-12,且c(MOH)=0.1 mol·L-1,则溶液中c(OH-)=0.1 mol·L-1,MOH为强碱,A项正确;A点对应的lgc(H+)c(OH-)=0,即c(H+)=c(OH-),溶液呈中性,由于CH3COOH是弱酸,当与等体积等浓度的一元强碱溶液反应后溶液呈弱碱性,所以当溶液呈中性时,CH3COOH溶液的体积应大于10.00 mL,B项错误;B点的溶液为等物质的量浓度的CH3COOH和CH3COOM的混合溶液,由于CH3COOH的电离程度很小,所以溶液中c(H+)c(M+)>c(CH3COOH)>c(H+)>c(OH-),C项正确;25 ℃时,Ka(CH3COOH)=1.7×10-5,KW=1.0×10-14,所以CH3COO-的水解平衡常数Kh=1.0×10-141.7×10-5≈5.9×10-10,D项正确。
10.室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是( )。
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
答案:C
解析:A项,题给三种酸均为一元酸,浓度相同时,pH越小,说明对应酸越强,电离常数越大,因此根据未发生中和反应时三种酸的pH大小可知A项正确;B项,P点时,HB反应一半,溶液中溶质为NaB和
HB,且物质的量浓度相等,此时溶液呈酸性,说明HB的电离程度大于NaB的水解程度,则溶液中c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),正确;C项,对于任何一种酸HX,加NaOH反应达到中性时,酸越弱,需要的NaOH越少,c(Na+)越小,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(X-),由于c(H+)=c(OH-),则c(Na+)=c(X-),由于酸性HA>HB>HD,故达中性时三种溶液中c(A-)>c(B-)>c(D-),错误;D项,完全中和并混合后,溶液中溶质有NaA、NaB、NaD,水电离的H+部分与A-、B-、D-结合生成HA、HB、HD,所以根据质子守恒有c(H+)+c(HA)+c(HB)+c(HD)=c(OH-),正确。
二、非选择题(本题共4个小题,共50分)
11.(14分)(1)将0.15 mol·L-1稀硫酸V1 mL与0.1 mol·L-1 NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2= (溶液体积变化忽略不计)。
(2)室温下,某水溶液中存在的离子有Na+、A-、H+、OH-,根据题意,回答下列问题:
①若溶液pH>7,则c(Na+) c(A-),理由是 。
②若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是
(填字母)。
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
答案:(1)1∶1 (2)①> 根据电荷守恒,c(H+)+c(Na+)=c(OH-)+c(A-),由于c(OH-)>c(H+),故c(Na+)>c(A-) ②AD
解析:(1)根据混合后所得溶液的pH为1,可得0.15mol·L-1×2×V1mL-0.1mol·L-1×V2mL(V1+V2) mL=0.1 mol·L-1,解得V1∶V2=1∶1;(2)①根据电荷守恒,c(H+)+c(Na+)=c(OH-)+c(A-),若溶液pH>7,则c(OH-)>c(H+),故c(Na+)>c(A-);②若反应后溶液呈中性,则HA是强酸,c(H+)+c(OH-)=2×10-7 mol·L-1,A项正确;若HA是强酸,得到溶液显中性,pH=7,若HA是弱酸,则HA部分电离,同体积反应后溶液显酸性,pH<7,B项错误;若反应后溶液呈酸性,如果HA是弱酸,可能因为反应后HA过量使溶液显酸性,V1不一定大于V2,C项错误;若反应后溶液呈碱性,如果HA是强酸,说明NaOH过量,V1一定小于V2,若HA是弱酸,HA不完全电离,未电离部分也消耗NaOH,侧面说明V1一定小于V2,D项正确。
12.(8分)连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为 价。
(2)常温下,用0.01 mol·L-1的NaOH溶液滴定10 mL 0.01 mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
①写出H2N2O2在水溶液中的电离方程式: 。
②B点时溶液中c(H2N2O2) (填“>”“<”或“=”,下同)c(N2O22-)。
③A点时溶液中c(Na+) c(HN2O2-)+c(N2O22-)。
答案:(1)+1
(2)①H2N2O2H++HN2O2-,HN2O2-H++N2O22- ②> ③>
解析:(1)H2N2O2分子中,H的化合价为+1价,O的化合价为-2价,根据化合物中元素化合价代数和为0,得氮元素的化合价为+1价。
(2)①从图像可知0.01 mol·L-1的H2N2O2溶液pH=4.3,故H2N2O2是二元弱酸,以第一步电离为主,故在水溶液中的电离方程式:H2N2O2H++HN2O2-、HN2O2-H++N2O22-;②B点时溶液中溶质是NaHN2O2,其溶液pH>7,说明HN2O2-以水解为主,故溶液中c(H2N2O2)>c(N2O22-);③a点时溶液中c(Na+)+c(H+)=c(HN2O2-)+2c(N2O22-)+c(OH-),pH=7,则c(H+)=c(OH-),得c(Na+)=c(HN2O2-)+2c(N2O22-),c(Na+)>c(HN2O2-)+c(N2O22-)。
13.(14分)已知水在25 ℃和t ℃时,其电离平衡曲线如图所示。
(1)25 ℃时水的电离平衡曲线应为 (填“A”或“B”),请说明理由 , 25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 。
(2)t ℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是 。
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1 (填“大于”“小于”“等于”或“无法确定”,下同)α2,若将两者等体积混合,则混合溶液的pH (填“>7”“<7”或“无法确定”),判断的理由是 。
(4)在曲线B所对应的温度下,将0.02 mol·L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH= 。
答案:(1)A 水电离需要吸热,温度越高,KW越大 10∶1
(2)a+b=14
(3)小于 无法确定 若BOH是弱碱,无法确定酸碱的物质的量的相对多少
(4)10
解析:(1)25 ℃时,pH=9的NaOH溶液中c(OH-)=1×10-5 mol·L-1,pH=4的H2SO4溶液中c(H+)=1×10-4 mol·L-1,当两者恰好反应完时,1×10-5 mol·L-1 V(碱)=1×10-4 mol·L-1 V(酸),V(碱)∶V(酸)=10∶1。(2)t ℃时,KW=1×10-12,pH=a的强酸溶液中,c(H+)=1×10-a mol·L-1,pH=b的强碱溶液中,c(OH-)=1×10b-12 mol·L-1,100V×10-a=1V×10b-12,2-a=b-12,a+b=14。(3)由于盐酸中c(H+)>BOH溶液中c(OH-),结合水的电离方程式知盐酸对水电离程度的抑制能力较强,故α1小于α2。若BOH是强碱,等体积混合时酸过量,此时溶液的pH<7,若BOH是弱碱,则无法确定碱与酸的物质的量的相对多少,故无法确定反应后溶液的pH。(4)等体积混合时,溶液中Ba2+反应完毕,但此时OH-消耗掉一半,故混合溶液中c(OH-)=0.01 mol·L-1,c(H+)=1×10-10 mol·L-1,故pH=10。
14.(14分)乙二酸(化学式为HOOC—COOH,可简写为H2C2O4)俗称草酸,在100 ℃时开始升华,157 ℃时开始分解。
(1)探究草酸的酸性。
①已知:25 ℃ H2C2O4的电离平衡常数为K1=5.4×10-2,K2=5.4×10-5;H2CO3的电离平衡常数为K1=4.4×10-7,K2=4.7×10-11。
下列离子方程式正确的是 。
A.H2C2O4+CO32-HCO3-+HC2O4-
B.HC2O4-+CO32-HCO3-+C2O42-
C.H2C2O4+CO32-C2O42-+H2O+CO2↑
D.2C2O42-+CO2+H2O2HC2O4-+CO32-
②向1 L 0.02 mol·L-1 H2C2O4溶液中滴加1 L 0.01 mol·L-1 NaOH溶液。混合溶液中c(H+)>c(OH-),下列说法中正确的是 。
A.c(H2C2O4)>c(HC2O4-)
B.c(Na+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-)
C.c(OH-)=c(H+)+2c(H2C2O4)-c(HC2O4-)
D.c(H2C2O4)+c(C2O42-)+c(HC2O4-)=0.02 mol·L-1
(2)用酸性KMnO4溶液滴定Na2C2O4溶液求算Na2C2O4的纯度。
实验步骤:准确称取1 g Na2C2O4固体,配成100 mL溶液,取出20.00 mL于锥形瓶中。再向瓶中加入足量稀硫酸,用0.016 mol·L-1高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00 mL。
①高锰酸钾溶液应装在 (填“酸式”或“碱式”)滴定管中。
②滴定至终点时的实验现象是 。
③下列操作可能使测量结果偏高的是 。
A.盛装Na2C2O4溶液的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视
D.锥形瓶中残留少量水
④计算Na2C2O4的纯度为 。
答案:(1)①BC ②B
(2)①酸式 ②当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色(紫红色),且半分钟内不褪色 ③B ④67%
解析:(1)①根据电离常数知酸性强弱顺序是H2C2O4>HC2O4->H2CO3>HCO3-,根据强酸制取弱酸知:H2C2O4和CO32-反应生成C2O42-和CO2,HC2O4-和CO32-反应生成HCO3-和C2O42-,B、C正确。②向1 L 0.02 mol·L-1 H2C2O4溶液中滴加1 L 0.01 mol·L-1 NaOH溶液,发生反应H2C2O4+NaOHNaHC2O4+H2O,则反应后的溶液是等浓度的H2C2O4和NaHC2O4的混合溶液,混合溶液中c(H+)>c(OH-),说明H2C2O4的电离程度大于HC2O4-的水解程度,则c(H2C2O4)
查看更多