2021届高考化学一轮复习过关训练:化学反应速率和化学平衡
2021届高考一轮复习化学
化学反应速率和化学平衡
一、选择题
1.I-可以作为水溶液中的 SO2歧化反应的催化剂,可能的催化过程如下:
ⅰ.SO2+4I-+4H+===S↓+2I2+2H2O
ⅱ.I2+2H2O+SO2===SO2-4 +4H++2I-
为探究ⅰ、ⅱ反应速率与 SO2歧化反应速率的关系,实验如下:分别将 18 mL SO2饱和溶
液加入到 2 mL下列试剂中,密闭放置,观察现象。(已知:I2易溶解在 KI溶液中)
序号 Ⅰ Ⅱ Ⅲ Ⅳ
试剂
组成
0.4 mol·L-1KI
a mol·L-1KI、
0.2 mol·L-1H2SO4
0.2 mol·L-1
H2SO4
0.2 mol·L-1KI、
0.000 2 molI2
实验
现象
溶液变黄,一段时
间后出现浑浊
溶液变黄,出现浑
浊较Ⅰ快
无明显现象
溶液由棕褐色很快
褪色,变成黄色,
出现浑浊较Ⅰ快
下列说法不正确的是 ( )
A.水溶液中 SO2歧化反应的化学方程式为 3SO2+2H2O===2H2SO4+S↓
B.Ⅱ是Ⅰ的对比实验,则 a=0.4
C.比较Ⅰ、Ⅱ、Ⅲ,可得出的结论是:I-是 SO2歧化反应的催化剂,H+
单独存在时不具
有催化作用,但 H+
可以加快 SO2歧化反应的速率
D.实验表明,SO2歧化反应的速率Ⅳ>Ⅰ,原因是反应ⅰ比反应ⅱ快;Ⅳ中由反应ⅱ产生
的 H+
使反应ⅰ加快
2.将 4 mol A气体和 2 mol B气体在 2 L的恒容密闭容器中混合,并在一定条件下发生如
下反应:2A(g)+B(g)⇌2C(g)。若经 2 s后测得 C的浓度为 0.6 mol·L-1,现有下列几种说
法:
①用物质 A表示的反应的平均速率为 0.3 mol·L-1·s-1
②用物质 B表示的反应的平均速率为 0.6 mol·L-1·s-1
③2 s时物质 A的转化率为 70%
④2 s时物质 B的浓度为 0.7 mol·L-1
其中正确的是( )
A.①③ B.①④
C.②③ D.③④
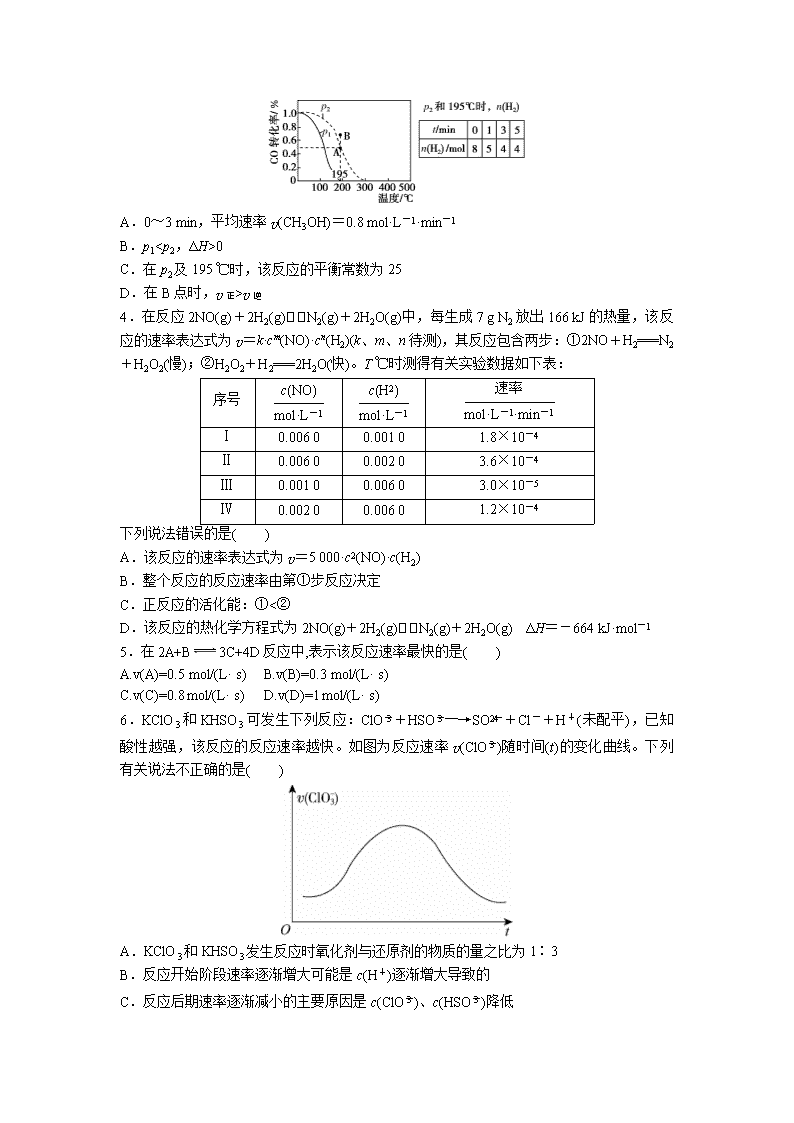
3.在 20 L 的密闭容器中按物质的量之比 1∶2 充入 CO 和 H2,发生: CO(g)+
2H2(g)⇌CH3OH(g) ΔH。测得 CO的转化率随温度的变化及不同压强下 CO的变化、p2和
195℃时 n(H2)随时间的变化结果如图表所示。下列说法正确的是( )
A.0~3 min,平均速率 v(CH3OH)=0.8 mol·L-1·min-1
B.p1
0
C.在 p2及 195℃时,该反应的平衡常数为 25
D.在 B点时,v 正>v 逆
4.在反应 2NO(g)+2H2(g) N2(g)+2H2O(g)中,每生成 7 g N2放出 166 kJ的热量,该反
应的速率表达式为 v=k·cm(NO)·cn(H2)(k、m、n待测),其反应包含两步:①2NO+H2===N2
+H2O2(慢);②H2O2+H2===2H2O(快)。T℃时测得有关实验数据如下表:
序号
cNO
mol·L-1
cH2
mol·L-1
速率
mol·L-1·min-1
Ⅰ 0.006 0 0.001 0 1.8×10-4
Ⅱ 0.006 0 0.002 0 3.6×10-4
Ⅲ 0.001 0 0.006 0 3.0×10-5
Ⅳ 0.002 0 0.006 0 1.2×10-4
下列说法错误的是( )
A.该反应的速率表达式为 v=5 000·c2(NO)·c(H2)
B.整个反应的反应速率由第①步反应决定
C.正反应的活化能:①<②
D.该反应的热化学方程式为 2NO(g)+2H2(g) N2(g)+2H2O(g) ΔH=-664 kJ·mol-1
5.在 2A+B 3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol/(L· s) B.v(B)=0.3 mol/(L· s)
C.v(C)=0.8 mol/(L· s) D.v(D)=1 mol/(L· s)
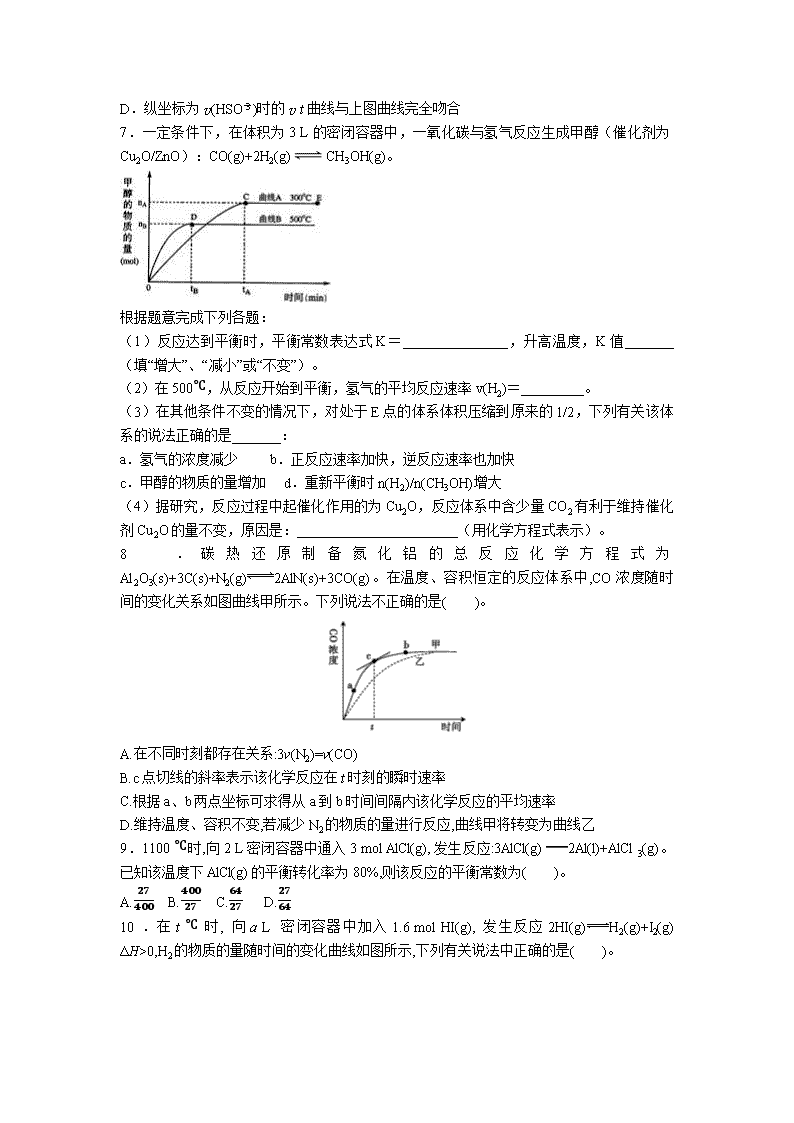
6.KClO3和 KHSO3可发生下列反应:ClO-
3+HSO-
3―→SO2-4 +Cl-+H+(未配平),已知酸
性越强,该反应的反应速率越快。如图为反应速率 v(ClO-
3 )随时间(t)的变化曲线。下列有关
说法不正确的是( )
A.KClO3和 KHSO3发生反应时氧化剂与还原剂的物质的量之比为 1∶3
B.反应开始阶段速率逐渐增大可能是 c(H+)逐渐增大导致的
C.反应后期速率逐渐减小的主要原因是 c(ClO-
3 )、c(HSO-
3 )降低
D.纵坐标为 v(HSO-
3 )时的 vt曲线与上图曲线完全吻合
7.一定条件下,在体积为 3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为
Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)。
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式 K=_______________,升高温度,K值_______
(填“增大”、“减小”或“不变”)。
(2)在 500℃,从反应开始到平衡,氢气的平均反应速率 v(H2)=_________。
(3)在其他条件不变的情况下,对处于 E点的体系体积压缩到原来的 1/2,下列有关该体
系的说法正确的是_______:
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时 n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为 Cu2O,反应体系中含少量 CO2有利于维持催化
剂 Cu2O的量不变,原因是:_______________________(用化学方程式表示)。
8 . 碳 热 还 原 制 备 氮 化 铝 的 总 反 应 化 学 方 程 式 为
Al2O3(s)+3C(s)+N2(g) 2AlN(s)+3CO(g)。在温度、容积恒定的反应体系中,CO浓度随时
间的变化关系如图曲线甲所示。下列说法不正确...的是( )。
A.在不同时刻都存在关系:3v(N2)=v(CO)
B.c点切线的斜率表示该化学反应在 t时刻的瞬时速率
C.根据 a、b两点坐标可求得从 a到 b时间间隔内该化学反应的平均速率
D.维持温度、容积不变,若减少 N2的物质的量进行反应,曲线甲将转变为曲线乙
9.1100 ℃时,向 2 L密闭容器中通入 3 mol AlCl(g),发生反应:3AlCl(g) 2Al(l)+AlCl3(g)。
已知该温度下 AlCl(g)的平衡转化率为 80%,则该反应的平衡常数为( )。
A.
�.
�tt
B.
�tt
�.
C.
��
�.
D.
�.
��
10.在 t ℃时 ,向 a L 密闭容器中加入 1.6 mol HI(g),发生反应 2HI(g) H2(g)+I2(g)
ΔH>0,H2的物质的量随时间的变化曲线如图所示,下列有关说法中正确的是( )。
A.平衡时,I2蒸气的体积分数为 25%
B.若在 1.5 min时降低温度,则反应将向左进行
C.平衡后若升高温度,v 正增大,v 逆减小
D.平衡后向容器中加入一定量的 H2后,平衡向左移动,H2的体积分数减小
11.一定温度下,反应 N2O4(g) 2NO2(g)的焓变为ΔH。现将 1 mol N2O4充入一恒压密闭容
器中,下列示意图正确且能说明反应达到平衡状态的是( )。
A.①② B.②④ C.③④ D.①④
12.下列说法中不正确...的是( )。
A.活化分子间的碰撞不一定能发生化学反应
B.增大反应物浓度,可增大单位体积内活化分子数,从而使有效碰撞次数增多
C.有气体参加的化学反应,若增大压强(缩小反应容器的体积),可增大活化分子的百分数,从而
使反应速率增大
D.催化剂能增大活化分子百分数,从而增大化学反应速率
二、非选择题
13.氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。研究氧化亚氮分解对环境
保护有重要意义。
(1)污水生物脱氮过程中,在异养微生物催化下,硝酸铵可分解为 N2O和另一种产物,该反应的
化学方程式为 。
(2)已知反应 2N2O(g) 2N2(g)+O2(g)的ΔH=163 kJ·mol1,1 mol N2(g)、1 mol O2(g)分子中化
学键断裂时分别需要吸收 945 kJ、498 kJ的能量,则 1 mol N2O(g)分子中化学键断裂时需要
吸收的能量为 kJ。
(3)在一定温度下的恒容容器中,反应 2N2O(g) 2N2(g)+O2(g)的部分实验数据如下 :
反应时间/min 0 10 20 30 40 50 60 70 80 90 100
c(N2O)/mol·L1 0.100 0.090 0.080 0.070 0.060 0.050 0.040 0.030 0.020 0.010 0.010
①在 0~20 min时段,反应速率 v(N2O)为 mol·L1·min1。
②若 N2O起始浓度 c0为 0.150 mol·L1,则反应至 30 min时 N2O的转化率α= 。比较
不同起始浓度时 N2O的分解速率:v(c0=0.150 mol·L1) v(c0=0.100 mol·L1)(填“>”“=”
或“<”)。
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度
N2O消耗一半时所需的相应时间),则 T1 T2(填“>”“=”或“<”)。当温度为 T1、起始压
强为 p0,反应至 t1 min时,体系压强 p= (用 p0表示)。
(4)碘蒸气存在能大幅度提高 N2O的分解速率,反应历程为:
第一步 I2(g) 2I(g)(快反应)
第二步 I(g)+N2O(g) N2(g)+IO(g)(慢反应)
第三步 IO(g)+N2O(g) N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时 N2O分解速率方程为 v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的
是 (填标号)。
A.N2O分解反应中,k(含碘)>k(无碘)
B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大
D.I2浓度与 N2O分解速率无关
14.含氮化合物的种类非常丰富,请回答下列问题:
(1)已知:2NO2(g) N2O4(g) ΔH1=55.3 kJ·mol1
N2O5(g) 2NO2(g)+
�
�
O2(g) ΔH2=+53.1 kJ·mol1
则 2N2O5(g) 2N2O4(g)+O2(g) ΔH= 。
(2)T1 温度时在容积为 2 L 的恒容密闭容器中充入 4 mol NO 和 2 mol O2 发生反
应:2NO(g)+O2(g) 2NO2(g) ΔH<0,4 min时达到平衡,此时 O2转化率为 80%。
①0~4 min内该反应的平均反应速率 v(NO2)= ;
②T1温度时该反应的化学平衡常数 K= ;
③若不改变外界条件,向平衡后的容器中再通入 1 mol NO2(g),重新达到平衡后,NO2(g)在体系
中的百分含量 (填“变大”“变小”或“不变”)。
(3)工业合成氨的反应原理为:N2(g)+3H2(g) 2NH3(g) ΔH<0。对于该反应,既可以提高平
衡体系中 NH3的百分含量,又能加快反应速率的措施是 (填序号)。
a.升高温度
b.将平衡体系中的氨气分离出来
c.增大体系压强
d.加入合适的催化剂
(4)如图所示,T1温度时,NO和 O2的投料比与平衡时 NO2的体积分数的关系(不考虑 NO2与
N2O4之间的相互转化)。
横坐标代表 NO和 O2的投料比,纵坐标代表平衡时 NO2体积分数,计算最高点(2,0.85)时 NO
的平衡体积分数为 。
参考答案
一、选择题
1.D
解析:D [根据题中催化过程,可得水溶液中 SO2 歧化反应的化学方程式为 3SO2+
2H2O===2H2SO4+S↓,A 项正确;Ⅱ是Ⅰ的对比实验,采用控制变量法,Ⅱ比Ⅰ多加了
0.2 mol·L-1H2SO4,Ⅰ与Ⅱ中 KI 浓度应相等,则 a=0.4,B项正确;对比Ⅰ与Ⅱ,加入 H+
可以加快 SO2歧化反应的速率,对比Ⅱ与Ⅲ,H+
单独存在时不能催化 SO2的歧化反应,I-
是 SO2歧化反应的催化剂,C项正确;Ⅳ中“溶液由棕褐色很快褪色,变成黄色,出现浑浊
较Ⅰ快”,说明 SO2歧化反应速率Ⅳ>Ⅰ,对比Ⅳ和Ⅰ,Ⅳ中加入的 KI 的浓度小且加入了
I2,反应ⅰ消耗 H+
和 I-,反应ⅱ消耗 I2,由此说明反应ⅱ比反应ⅰ快,反应ⅱ产生的 H+
使
反应ⅰ加快,D项错误。]
2.B
解析:B [用物质 C表示的反应的平均速率为 0.3 mol·L-1·s-1,根据反应速率之比等于化
学计量数之比,用物质 A表示的反应的平均速率为 0.3 mol·L-1·s-1,①正确;用物质 B表
示的反应的平均速率为 0.15 mol·L-1·s-1,②错误;2 s时生成的 C为 1.2 mol,反应的 A为
1.2 mol,则物质 A的转化率为
1.2 mol
4 mol
×100%=30%,③错误;2 s时物质 B的浓度为(2-
0.6)mol/2 L=0.7 mol·L-1,④正确。]
3.C
4.C
解析:C 解析:本题考查化学反应速率的表达式及相关计算。将实验Ⅰ、Ⅱ数据代入速
率表达式可得 1.8×10-4=k·0.006 0m·0.001 0n,3.6×10-4=k·0.006 0m·0.002 0n,综合两式可
得 n=1;将实验Ⅲ、Ⅳ数据代入速率表达式可得 3.0×10-5=k·0.001 0m·0.006 0n,1.2×10-4
=k·0.002 0m·0.006 0n,综合两式可得 m=2,则速率表达式为 v=k·c2(NO)·c(H2),将实验Ⅰ
数据代入可得 1.8×10-4=k·0.006 02×0.001 0,则有 k=5 000,故该反应速率表达式为 v=
5 000·c2(NO)·c(H2),A正确。第①步反应是慢反应,正反应的活化能较大;第②步反应是
快反应,正反应的活化能较小,故整个反应速率由第①步反应决定,且正反应的活化能:
①>②,则 B 正确,C 错误。生成 7 g N2(即 0.25 mol)放出 166 kJ 的热量,则生成 1 mol
N2(g)放出的热量为 664 kJ,据此写出该反应的热化学方程式,D正确。
5.B
6.D
解析: D
解析 配平后的离子方程式为 ClO-
3+3HSO-
3 ===3SO2-4 +Cl-+3H+
,A正确;题干信息提
示“酸性越强,该反应的反应速率越快”,B正确;随着反应物浓度的逐渐降低,反应速
率也逐渐降低,C正确;v(ClO-
3 )∶v(HSO-
3 )=1∶3,D错误。
7.C
解析:(1)K=c(CH3OH)/[c(CO)·c2(H2)] 减小
(2)2nB/3tB mol·(L·min)-1
(3)bc
(4)Cu2O+CO 2Cu+CO2
【解析】(1)反应达到平衡时,平衡常数表达式 K=c(CH3OH)/[c(CO)·c2(H2)]。从图像
可知,温度高时平衡体系中甲醇含量减少,可以推出 CO(g)+2H2(g) CH3OH(g)反应放
热,因此温度升高后,K值减小。(2)从图像可以看出在 500℃tB时刻达到平衡,此时甲
醇物质的量为 nB,反应消耗氢气物质的量为 2nB,可求出氢气的平均反应速率为
2nB/3tBmol·(L·min)-1。(3)在其他条件不变的情况下,对处于 E点的体系体积压缩到原来
的 1/2,加压时,反应物和生产物浓度均增大,正、逆反应速率都加快,由勒夏特列原理可
知,加压时平衡右移。a.氢气的浓度增大,a错误;b.正反应速率加快,逆反应速率也
加快,b 正确;c.平衡向右移动,甲醇的物质的量增加,c 正确;d.重新平衡时
n(H2)/n(CH3OH)减小,d错误。有关该体系的说法正确的是 bc:(4)据研究,反应过程中
起催化作用的为 Cu2O,反应体系中含少量 CO2有利于维持催化剂 Cu2O的量不变,一氧化
碳与氧化亚铜反应生成铜和二氧化碳,根据平衡移动原理可知,少量二氧化碳的存在可以
抑制该化学平衡向正向移动,用化学方程式表示为:Cu2O+CO 2Cu+CO2。
8.D
解析:D
【解析】维持温度、容积不变,若减少 N2的物质的量进行反应,平衡逆向移动,达到的新平衡
状态与原平衡状态不同,D项错误。
9.B
解析:B
【解析】根据三段式:
3AlCl(g) 2Al(l)+AlCl3(g)
开始(mol·L1) 1.5 0
转化(mol·L1) 1.2 0.4
平衡(mol·L1) 0.3 0.4
则该反应的平衡常数 K=
�(�RoR�)
��(�RoR)
=
t.�
t.��
=
�tt
�.
。
10.A
解析:A
【解析】该反应的反应前后气体体积不变,由图可知,平衡时 n(H2)=0.4 mol,则有 n(I2)=0.4 mol,
故 I2蒸气的体积分数为
t.�RoR
�.�RoR
×100%=25%,A项正确;1.5 min时反应未达到平衡状态,降低温
度,反应速率减慢,但反应仍向右进行,直至平衡,B项错误;平衡后若升高温度,v 正、v 逆均增大,
但 v 正增大的程度大于 v 逆,平衡向右移动,C项错误;平衡后加入 H2,平衡向左移动,根据勒夏特
列原理可知,达到新平衡后,c(H2)仍比原来大,则新平衡后 H2的体积分数增大,D项错误。
11.D
解析:D
【解析】因反应容器保持恒压,所以容器容积在反应达平衡前随反应进行而不断变化,结合ρ气
=
�
�
可知,气体密度不再变化,说明容器容积不再变化,即气体的物质的量不再变化,反应达到平
衡状态,①符合题意;无论是否平衡,反应的ΔH都不变,②不符合题意;反应开始时,加入 1 mol
N2O4,随着反应的进行,N2O4的浓度逐渐减小,故 v 正(N2O4)逐渐减小,直至达到平衡,③不符合
题意;N2O4的转化率不再变化,说明 N2O4的浓度不再变化,反应达到平衡状态,④符合题意。
12.C
解析:C
【解析】活化分子采取合适的碰撞取向才能发生化学反应,A项正确;反应物浓度增大,可增
大单位体积内活化分子数,有效碰撞次数增多,B项正确;有气体参加的化学反应,增大压强(缩
小反应容器的体积),可增大单位体积内活化分子数,活化分子百分数不变,C项不正确;催化剂
能降低反应的活化能,增大活化分子百分数,从而增大化学反应速率,D项正确。
二、非选择题
13.(1)NH4NO3 N2O↑+2H2O (2)1 112.5
(3)①1.0×103 ②20.0% = ③> 1.25p0 (4)AC
14. (每空 2分)(1)4.4 kJ·mol1
(2)①0.4 mol·L1·min1 ②80 ③变大 (3)c (4)10%