广西钦州市第一中学2019-2020学年高二5月月考理科综合化学试题
7.化学与生活、人类生产、社会可持续发展密切相关,下列有关说法不正确的是( )
A.可回收的易拉罐中含金属铝,可通过电解熔融氯化铝制取
B.侯氏制碱法工艺流程中利用了物质溶解度的差异
C.废旧电池中含有镍、镉等重金属,不能用填埋法处理
D.电热水器用镁棒防止金属内胆腐蚀,原理是牺牲阳极的阴极保护法
8.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.l mol/L Na2CO3溶液中,阴离子总数小于NA
B.常温下,10 mL pH=1的醋酸溶液中含有的氢离子数大于0.001NA
C.电解精炼铜时,若阳极质量减少64 g,则转移到阴极的电子数不一定等于2NA
D.相同体积、相同物质的量浓度的CH3COONa溶液和NaCl溶液所含离子数目相同
9.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.水电离的c(H+)=1×10-13mol·L-1的溶液:K+、Mg2+、SO42-、F-
B.滴入酚酞变红色的溶液:K+、Ca2+、HCO3-、CO32-
C.滴入甲基橙变黄色的溶液:NH4+、Fe3+、ClO-、SO42-
D. 0.1 mol·L-1 FeSO4溶液:Na+、K+、Cl-、NO3-
10.下列根据实验操作、现象得出相应结论一定正确的是
选项
实验操作、现象
实验结论
A
用pH计测定同浓度NaF溶液和CH3COONa溶液:
pH(NaF)<pH(CH3COONa)
酸性:HF>CH3COOH
B
向2mL 0.5mol/L FeCl3溶液中滴加2mL 1mol/L KSCN溶液,振荡后静置,观察到溶液变成红色,加入1mL 2mol/L KCl溶液后溶液红色变浅
c(KCl)增大使该反应
FeCl3+3KSCNFe(SCN)3+3KCl
的化学平衡逆向移动
C
向盛有2ml0.1mol·L-1AgNO3的试管中滴加5滴0.1mol·L-1NaCl溶液,出现白色沉淀;再往试管中滴加5滴0.1mol·L-1KI溶液,出现黄色沉淀
KSP(AgCl)>KSP(AgI)
D
将10mL 2mol/L FeCl3的溶液与1 mL 1mol/L KI溶液混合充分反应后滴加
KI与FeCl3反应有可逆性
KSCN,溶液颜色变红
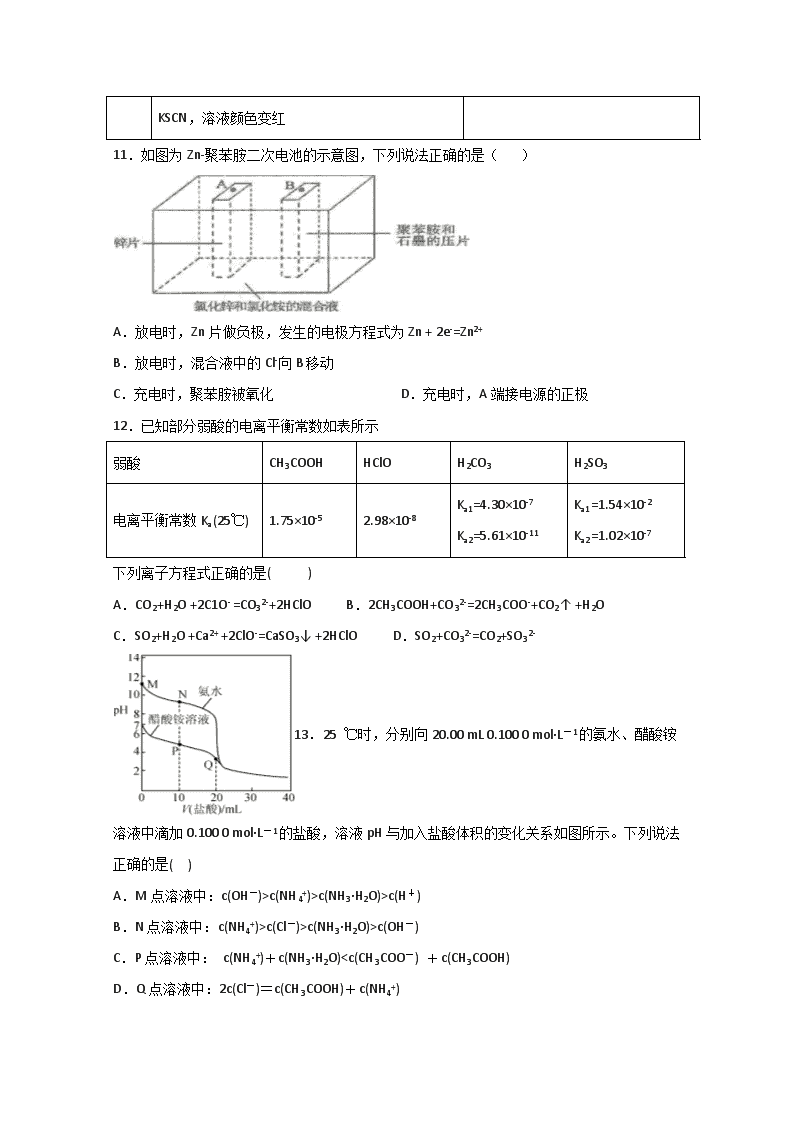
11.如图为Zn-聚苯胺二次电池的示意图,下列说法正确的是( )
A.放电时,Zn片做负极,发生的电极方程式为Zn + 2e-=Zn2+
B.放电时,混合液中的Cl-向B移动
C.充电时,聚苯胺被氧化 D.充电时,A端接电源的正极
12.已知部分弱酸的电离平衡常数如表所示
弱酸
CH3COOH
HClO
H2CO3
H2SO3
电离平衡常数Ka(25℃)
1.75×10-5
2.98×10-8
Ka1=4.30×10-7
Ka2=5.61×10-11
Ka1=1.54×10-2
Ka2=1.02×10-7
下列离子方程式正确的是( )
A.CO2+H2O +2C1O- =CO32-+2HClO B.2CH3COOH+CO32-=2CH3COO-+CO2↑ +H2O
C.SO2+H2O +Ca2+ +2ClO-=CaSO3↓ +2HClO D.SO2+CO32-=CO2+SO32-
13.25 ℃时,分别向20.00 mL 0.100 0 mol·L-1的氨水、醋酸铵溶液中滴加0.100 0 mol·L-1的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是( )
A.M点溶液中:c(OH-)>c(NH4+)>c(NH3·H2O)>c(H+)
B.N点溶液中:c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)
C.P点溶液中: c(NH4+)+c(NH3·H2O)
c(OH-)>c(NH4+)> c(H+),A项错误;
B. N点溶液的溶质为NH3·H2O与NH4Cl,根据图像可知溶液显碱性,c(OH-) > c(H+),根据电荷守恒式c(NH4+)+ c(H+)= c(Cl-)+ c(OH-)可知,c(NH4+)>c(Cl-),则离子浓度大小为:c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-),B项正确;
C. P点溶液中加入10mLHCl溶液,反应后溶质为等浓度的醋酸铵、氯化铵和醋酸,根据物料守恒可知: c(NH4+)+c(NH3·H2O)=c(CH3COO-) + c(CH3COOH),C项错误;
D. Q点溶液中盐酸与醋酸铵按物质的量之比为1:1反应,溶液溶质为等浓度的醋酸和氯化铵,根据物料守恒可知,2c(Cl-)=c(CH3COOH)+c(NH4+)+ c(CH3COO−)+c(NH3⋅H2O),D项错误;答案选B。
26.2NH3(g) +CO2(g)=CO(NH2)2(s)+ H2O (l) △H=-75kJ/mol < 0.02 mol ·L-1·min-1 3.6 B 2NH3 - 6e- = N2 + 6H+ c(Na+)>c(N3﹣)>c(OH-)>c(H+) (0.5b-a)
【解析】【分析】
(1)结合盖斯定律计算①+②−③得到CO2和NH3合成尿素(副产物是液态水)的热化学方程式;
(2)①先拐先平温度高,升高温度甲烷物质的量增大,说明升温平衡逆向移动;
②温度T1时,0~10min内NO2的平均反应速率v=,平衡常数K=
;
③提高反应速率同时提高NO2的转化率,增大反应速率同时平衡正向进行,结合化学平衡移动原理和反应特征分析判断;
(3)正极上是二氧化氮得到电子发生还原反应,负极上是氨气失电子发生氧化反应,结合电极反应分析判断;
(4)NaN3溶液中N3−水解,溶液呈碱性,结合溶液中电荷守恒分析溶液中离子浓度大小顺序;结合反应2HN3+Ba(OH)2=Ba(N3)2+2H2O的定量关系计算剩余HN3物质的量得到溶液中HN3浓度。
【详解】(1)①2NH3(g)+CO2(g)=NH2CO2NH4 (s) △H=-151.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+120.5 kJ·mol-1
③H2O(l)=H2O(g) △H=+44 kJ·mol-1
结合盖斯定律计算①+②−③得到CO2和NH3合成尿素(副产物是液态水)的热化学方程式:2NH3(g) +CO2(g)=CO(NH2)2(s)+ H2O (l) △H=-75kJ/mol,
故答案为:2NH3(g) +CO2(g)=CO(NH2)2(s)+ H2O (l) △H=-75kJ/mol;
(2)CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) △H,
①结合图像分析,先拐先平温度高,即T2>T1,温度越高甲烷物质的量越大,证明升温平衡逆向进行,正反应为为放热反应,△H<0,故答案为:<;
②温度T1时,0~10min内,甲烷物质的量减小0.4mol−0.3mol=0.1mol,反应的二氧化氮物质的量为0.2mol, NO2的平均反应速率v(NO2)= =0.02 mol ·L-1·min-1,
结合三段式计算平衡浓度得到平衡常数,平衡状态下甲烷物质的量0.1mol,
K==3.6;
③CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g),反应为气体体积增大的放热反应,
A、改用高效催化剂增大反应速率不改变化学平衡,转化率不变,故A不符合题意;
B、增加CH4的浓度,反应速率增大,提高NO2的转化率,故B符合题意;
C、缩小容器的体积,增大压强反应速率增大,平衡逆向进行,反应物转化率减小,故C不符合题意;
D、反应为放热反应,升高温度平衡逆向进行,反应速率增大,转化率减小,故D不符合题意;
(3)6NO2+8NH3=7N2+12H2O,正极上是二氧化氮得到电子发生还原反应,电极反应为:2NO2+8e−+4H2O=N2+8OH−,负极上是氨气失电子发生氧化反应,电极反应为:2NH3 - 6e- = N2 + 6H+;
(4)NaN3溶液中N3−水解,溶液呈碱性,故溶液中离子浓度c(Na+)>c(N3﹣)>c(OH-)>c(H+);常温下,将amol⋅L−1的HN3与bmol⋅L−1的Ba(OH)2溶液等体积混合,充分反应后,溶液中存在电荷守恒,c(H+)+2c(Ba2+)=c(N3−)+c(OH−),当2c(Ba2+)=c(N3−),c(H+)=c(OH−),则该混合物溶液呈中性,2HN3+Ba(OH)2=Ba(N3)2+2H2O,溶液呈中性,溶液中c(HN3)=mol/L =(0.5b-a)mol/L。
27. 三颈烧瓶 生成FeSO4溶液,且用产生的H2排尽装置内的空气
Fe2++2HCO3-=FeCO3↓+CO2↑+H2O 取最后一次洗涤液,加入稀盐酸酸化,再滴入BaCl2溶液,若无白色沉淀,则洗涤干净 乳酸根离子中的羟基也能被高锰酸钾氧化,导致消耗高锰酸钾溶液用量偏多 蓝色褪去且半分钟不恢复 91.4%
【解析】【分析】
I.亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与稀硫酸反应制备硫酸亚铁,利用反应生成的氢气排尽装置中的空气,B制备硫酸亚铁,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中。C装置中硫酸亚铁和NH4HCO3发生反应产生FeCO3沉淀。
Ⅱ.Fe2+有较强还原性,易被空气中氧气氧化,获取乳酸亚铁晶体过程中应减小空气中氧气的干扰;①乳酸和亚铁离子都可被酸性高锰酸钾氧化;
②I2的淀粉溶液显蓝色,滴加硫代硫酸钠溶液后蓝色会变浅,最终褪色;根据已知反应可得关系式2Fe3+~~I2~~2S2O32-,根据滴定时参加反应的硫代硫酸钠的物质的量计算出Fe2+的物质的量,再计算样品纯度。
【详解】I.亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与稀硫酸反应制备硫酸亚铁,利用反应生成的氢气排尽装置中的空气,装置B制备硫酸亚铁,C装置中硫酸亚铁和NH4HCO3发生反应:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中。
(1)由仪器图形可知C为三颈烧瓶;打开kl、k2,加入适量稀硫酸,可使生成的氢气排出装置C内的空气,防止二价铁被氧化;
(2)待装置内空气排出后,再关闭k2,反应产生的氢气使装置内的气体压强增大,可将B中生成的硫酸亚铁溶液排到装置C中,发生反应生成碳酸亚铁,同时生成二氧化碳,反应的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(3)FeCO3是从含有SO42-的溶液中过滤出来的,检验沉淀是否洗涤干净,可通过检验是否含有SO42-判断。方法是:取最后一次水洗液于试管中,加入过量稀盐酸酸化,滴加一定量的BaCl2溶液,若无白色浑浊出现,则表明洗涤液中不存在SO42-,即可判断FeCO3沉淀洗涤干净;
Ⅱ.(4)①乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,Fe2+也可以被氧化,因此二者反应都消耗KMnO4溶液,导致消耗高锰酸钾的增大,使计算所得乳酸亚铁的质量偏大,产品中乳酸亚铁的质量分数会大于100%;
②I2遇淀粉溶液显蓝色,滴加硫代硫酸钠溶液后蓝色会变浅,说明I2与Na2S2O3发生了氧化还原反应,当蓝色刚好褪去且半分钟不恢复,即可判断为滴定终点;23.80 mL0.1000mol/L硫代硫酸钠溶液中硫代硫酸钠的物质的量为n(Na2S2O3)=0.02380L×0.100mol/L=2.38×10-3mol,根据关系式2Fe2+~2Fe3+~I2~2S2O32-,可知样品中CH3CH(OH)COO]2Fe•3H2O的物质的量为n(Fe2+)=n(S2O32-)=2.38×10-3mol×=9.52×10-3mol,则样品的纯度为×100%=91.4%。
28.充分搅拌,将辉铜矿粉碎,加热等(说法合理即可) SiO2、S、MnO2 3.7~5.6( 或3.7≤pH<5.6)
3H2O + 2 Fe3++3 CuO = 2Fe(OH)3 + 3Cu2+ 5
(或 Fe3++ 3H2O Fe(OH)3 + 3H+ CuO+ 2H+ = Cu2++ H2O )
Mn2++HCO3-+NH3=MnCO3↓+NH4+ 0.02 2100
【解析】【分析】
辉铜矿主要成分为Cu2S,含少量Fe2O3、SiO2等杂质,加入稀硫酸和二氧化锰浸取,过滤得到滤渣为MnO2、SiO2、单质S,滤液中含有Fe3+、Mn2+、Cu2+,调节溶液pH除去铁离子,加入碳酸氢铵溶液沉淀锰过滤得到滤液赶出氨气循环使用,得到碱式碳酸铜;据此分析解答本题。
【详解】(1)酸浸时,通过充分搅拌,将辉铜矿粉碎,加热等都可以提高浸取率;
(2)“浸取”时:在硫酸酸性条件下MnO2氧化Cu2S得到硫沉淀、CuSO4和MnSO4,其反应的化学方程式为:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O;
(3)“除铁”主要是除去溶液中Fe3+,根据题干表格可知,若要使Fe3+完全沉淀而不沉淀Cu2+
,溶液的pH范围为:3.7~5.6或3.7≤pH<5.6;
若溶液
(4)“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,反应的离子方程式为:Mn2++HCO3-+NH3=MnCO3↓+NH4+;
(5)
35. 1s22s22p63s23p63d74s2或[Ar]3d74s2 3 NH4+ Ti
查看更多