- 2021-07-08 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版化学反应与能量(图像题大全)作业
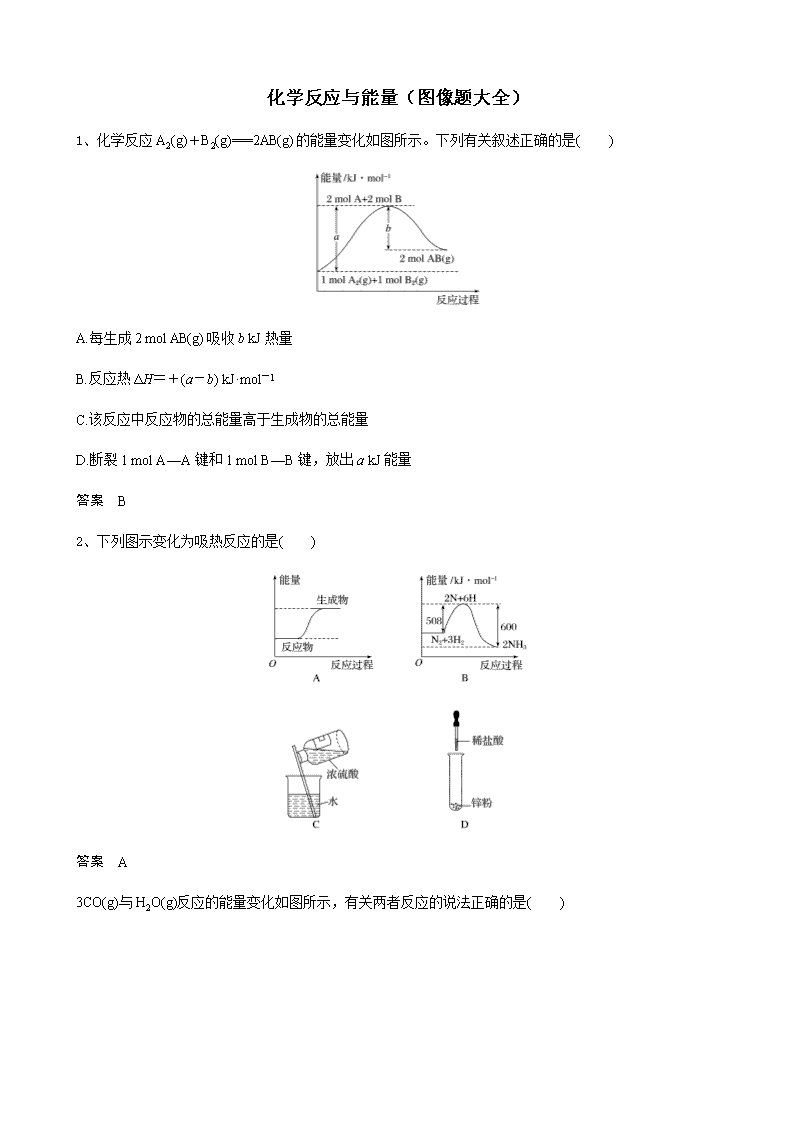
化学反应与能量(图像题大全) 1、化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是( ) A.每生成2 mol AB(g)吸收b kJ热量 B.反应热ΔH=+(a-b) kJ·mol-1 C.该反应中反应物的总能量高于生成物的总能量 D.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量 答案 B 2、下列图示变化为吸热反应的是( ) 答案 A 3CO(g)与H2O(g)反应的能量变化如图所示,有关两者反应的说法正确的是( ) A.该反应为吸热反应 B.1 mol CO(g)和1 mol H2O(g)具有的总能量大于1 mol CO2(g)和1 mol H2(g)具有的总能量 C.该反应不需要加热就能进行 D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ热量 答案 B 4下列图像分别表示有关反应的反应过程与能量变化的关系。 据此判断下列说法中正确的是( ) A.石墨转变为金刚石是吸热反应 B.白磷比红磷稳定 C.S(g)+O2(g)===SO2(g) ΔH1 S(s)+O2(g)===SO2(g) ΔH2,则ΔH1>ΔH2 D.CO(g)+H2O(g)===CO2(g)+H2(g) ΔH>0 答案 A 5.下列关于反应过程中能量变化的说法正确的是( ) A.在一定条件下,某可逆反应的ΔH=+100 kJ·mol-1,则该反应的正反应活化能比逆反应活化能大100 kJ·mol-1 B.图中A、B曲线可分别表示反应CH2===CH2(g)+H2(g)―→CH3CH3(g)未使用催化剂和使用催化剂时反应过程中的能量变化 C.同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同 D.图示的能量变化可判断出该化学反应是放热反应 答案 A 6、.Na2CO3(aq)与盐酸反应过程中的能量变化示意图如下,下列选项正确的是( ) A.H2CO3(aq)===CO2(g)+H2O(l)为放热反应 B.CO(aq)+ H+(aq)===HCO(aq) ΔH=a kJ·mol-1 C.HCO(aq)+H+(aq)===CO2(g)+H2O(l) ΔH=(c-b) kJ·mol-1 D.CO(aq)+2H+(aq)===CO2(g)+H2O(l) ΔH=(a+b-c) kJ·mol-1 答案 C 7、下列各图表示相应反应的能量变化,其中正确的是( ) 答案 B 8、通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热。 化学键 Si—O Si—Cl H—H H—Cl Si—Si Si—C 键能/kJ·mol-1 460 360 436 431 176 347 工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)Si(s)+4HCl(g),该反应的反应热ΔH为( ) A.+236 kJ·mol-1 B.-236 kJ·mol-1 C.+412 kJ·mol-1 D.-412 kJ·mol-1 答案:A 9反应 A+B―→C(ΔH<0)分两步进行:①A+B―→X(ΔH >0),②X―→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( ) 答案 D 10物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是( ) A.A―→F ΔH=-ΔH6 B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1 C.C―→F |ΔH|=|ΔH1+ΔH2+ΔH6| D.|ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6| 答案 B 11.肼(H2N—NH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O==O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是( ) A.194 B.391 C.516 D.658 答案 B 12.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,向100 mL 1 mol·L-1的NaOH溶液中加入0.5 mol·L-1的某种酸P溶液,测得加入酸的体积与反应放出的热量关系如图所示(不考虑热量损失),下列对应关系可能正确的是( ) 选项 A B C D P 草酸(HOOC—COOH) H2SO3 HNO3 HCl Q1 4.88 5.73 6.24 6.73 a 100 100 200 200 答案 A 13某化学反应的能量变化如图所示,下列有关叙述正确的是( ) A.该反应为放热反应 B.E2 kJ·mol-1可表示形成新的化学键所释放的能量 C.该反应的反应热ΔH=(E1-E2) kJ·mol-1 D.加入催化剂,可同时降低E1、E2 答案 D 14N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用、、分别表示N2、H2、NH3,下列说法正确的是( ) A.使用催化剂,合成氨反应放出的热量减少 B.在该过程中,N2、H2断键形成N原子和H原子 C.在固体催化剂表面合成氨的过程中能量状态最低的是③ D.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量 答案 B 15.如图所示,某反应在不同条件下的反应历程分别为a、b。 (1)据图可判断出反应物的总键能 (填“>”“<”或“=”,下同)生成物的总键能,则该反应的反应热ΔH 0。 (2)其中b历程对应的反应采用的条件为 (填字母)。 A.升高温度 B.增大反应物的浓度 C.增大压强 D.使用催化剂 答案 (1)< < (2)D 16.根据图示回答问题: (1)化学反应N2+3H2===2NH3的能量变化如图1所示,该反应的热化学方程式是 (填字母)。 A.N2(g)+3H2(g)===2NH3(l) ΔH=2(a-b-c) kJ·mol-1 B.N2(g)+3H2(g)===2NH3(g) ΔH=2(b-a) kJ·mol-1 C.N2(g)+H2(g)===NH3(l) ΔH=(b+c-a) kJ·mol-1 D.N2(g)+H2(g)===NH3(g) ΔH=(a+b) kJ·mol-1 (2)图2是N2和H2反应生成2 mol NH3过程中能量变化的示意图,请计算每生成1 mol NH3放出的热量为 。 (3)2SO2(g)+O2(g)===2SO3(g)反应过程的能量变化如图3所示。 已知1 mol SO2(g)被氧化为 1 mol SO3(g)的ΔH=-99 kJ·mol-1。 ①图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。 ②图中ΔH= kJ·mol-1 17. 根据下图所示,写出反应的热化学方程式并回答问题。 (1)反应过程Ⅰ的热化学方程式为 (2)反应过程Ⅱ的热化学方程式为 (3)Q与Q1的关系:Q (填“>”“<”或“=”)Q1。 答案 (1)H2(g)+Cl2(g)===2HCl(g) ΔH=-Q kJ·mol-1 (2)2HCl(g)===H2(g)+Cl2(g) ΔH=+Q1 kJ·mol-1 (3)= 15.断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能。下表列出了一些化学键的键能E: 化学键 H—H Cl—Cl O==O C—Cl C—H O—H H—Cl E/kJ·mol-1 436 247 x 330 413 463 431 请回答下列问题: (1)如图表示某反应的能量变化关系,则此反应为________(填“吸热”或“放热”)反应,其中ΔH=________(用含有a、b的关系式表示)。 (2)若图示中表示反应H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则b=________ kJ·mol-1,x=________。 (3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃利用空气中的氧气跟氯化氢反应制氯气。反应的化学方程式为_______________________________________ ________________________________________________________________________。 若忽略温度和压强对反应热的影响,根据上题中的有关数据,计算当反应中有1 mol电子转移时,反应的热量变化为________。 答案 (1)放热 (a-b) kJ·mol-1 (2)926 496.4 (3)O2+4HCl2Cl2+2H2O 放出热量31.4 kJ 18(1)汽车发动机工作时会引发N2和O2反应,生成NOx等污染大气,其中生成NO的能量变化如图1所示,则图1中三种分子最稳定的是 ,图1中对应反应的热化学方程式为 。 (2)在图2的坐标系中绘制出N2(g)、O2(g)反应生成NO(g)的能量变化曲线。 答案 (1)N2 N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1 (2)如图所示 19(1)随着化石能源的减少,新能源的开发利用日益迫切。Bunsen热化学循环制氢工艺由下列三个反应组成: SO2(g)+I2(g)+2H2O(g)===2HI(g)+H2SO4(l)ΔH=a kJ·mol-1 2H2SO4(l)===2H2O(g)+2SO2(g)+O2(g)ΔH=b kJ·mol-1 2HI(g)===H2(g)+I2(g) ΔH=c kJ·mol-1 则:2H2O(g)===2H2(g)+O2(g) ΔH=____________ kJ·mol-1。 (2)据粗略统计,我国没有经过处理便排放的焦炉煤气已超过250亿立方米,这不仅是能源的浪费,也对环境造成极大污染。为解决这一问题,我国在2004年起已利用焦炉煤气制取甲醇及二甲醚。 已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g)??CH3OH(g) ΔH。下表所列为常见化学键的键能数据: 化学键 C—C C—H H—H C—O C≡O H—O 348 414 436 326.8 1 032 464 则该反应的ΔH=________ kJ·mol-1。 (3)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。 已知:2SO2(g)+O2(g)??2SO3(g)ΔH=-196.6 kJ·mol-1 ①写出能表示硫的燃烧热的热化学方程式:_______________________________________ ②ΔH2=________ kJ·mol-1。 答案 (1)2a+b+2c (2)-128.8 (3)①S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1 ②-78.64 20参考下列图表和有关要求回答问题: (1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:__________________ (2)下表是部分化学键的键能数据: 化学键 P—P P—O O==O P==O 键能/kJ·mol-1 a b c x 已知1 mol白磷(P4)完全燃烧放热为d kJ,白磷及其完全燃烧的生成物结构如上图Ⅱ所示,则上表中x=____________________kJ·mol-1(用含有a、b、c、d的代数式表示)。 答案 (1)减小 不变 NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ·mol-1 (2)(6a+5c+d-12b)查看更多