- 2021-07-08 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习物质的分离、提纯和检验作业
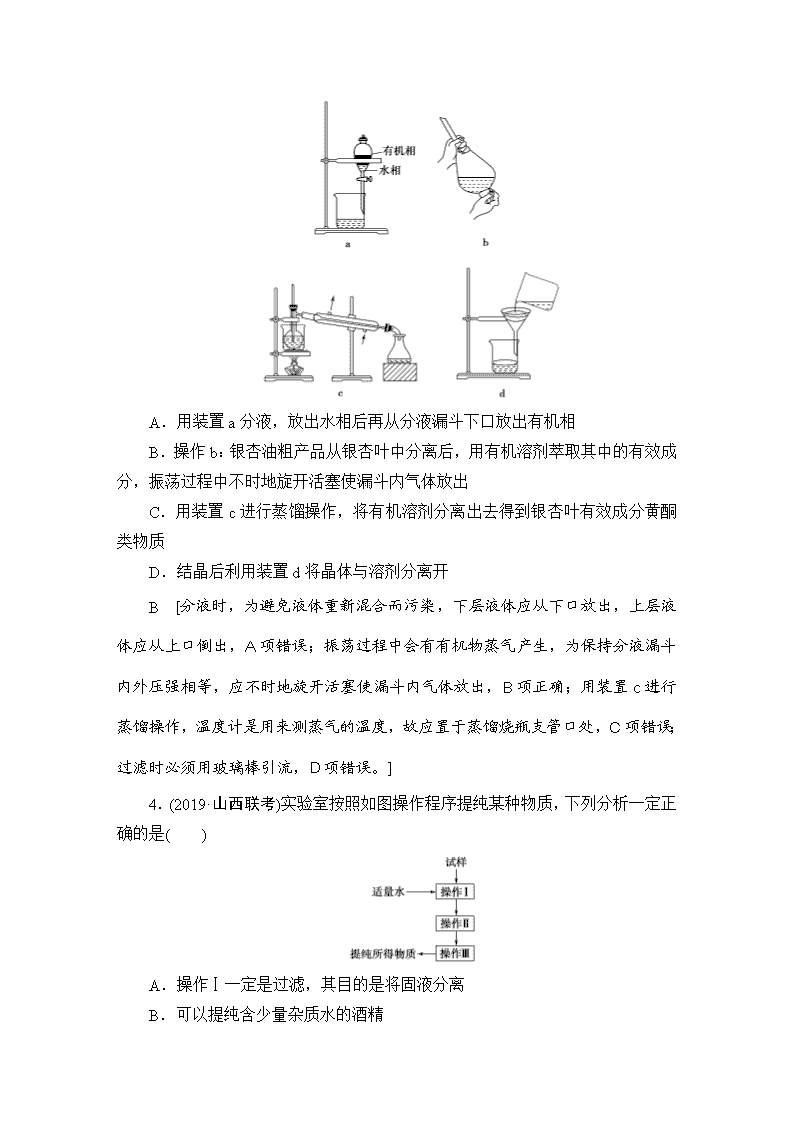
物质的分离、提纯和检验 (建议用时:35分钟) 1.东晋葛洪《肘后备急方》中“青蒿一握,以水二升渍,绞取汁,尽服之”。下列操作与“渍”和“绞”原理相近的是 ( ) A.煮沸、研碎 B.浸泡、过滤 C.萃取、剪断 D.蒸馏、捣碎 [答案] B 2.下列各物质含少量杂质,除去这些杂质应选用的试剂或操作方法正确的是 ( ) 序号 物质 杂质 除杂应选用的试剂或操作方法 ① KNO3溶液 KOH 加入FeCl3溶液,并过滤 ② FeSO4溶液 CuSO4 加入过量铁粉,并过滤 ③ H2 CO2 通过盛NaOH溶液的洗气瓶, 再通过盛有浓硫酸的洗气瓶 ④ NaNO3固体 CaCO3 溶解、过滤、蒸发 A.①②③④ B.①③④ C.②③④ D.①②③ C [①加入FeCl3溶液,生成KCl,引入新杂质,应加入硝酸除杂,错误;②铁可置换出铜,可除去杂质,正确;③CO2与NaOH溶液反应,可除去杂质,干燥后得到纯净的H2,正确;④CaCO3不溶于水,可用过滤的方法除去,正确。] 3.(2019·华中师大附中模拟)银杏叶具有敛肺平喘、活血化瘀、止痛的作用,是一种珍贵的中药材。对银杏叶活性成分黄酮类物质的提取常用的方法有溶剂提取法、蒸馏法、升华法、结晶法、超声波提取法等。下列关于分离提纯实验的仪器和操作正确的是( ) A.用装置a分液,放出水相后再从分液漏斗下口放出有机相 B.操作b:银杏油粗产品从银杏叶中分离后,用有机溶剂萃取其中的有效成分,振荡过程中不时地旋开活塞使漏斗内气体放出 C.用装置c进行蒸馏操作,将有机溶剂分离出去得到银杏叶有效成分黄酮类物质 D.结晶后利用装置d将晶体与溶剂分离开 B [分液时,为避免液体重新混合而污染,下层液体应从下口放出,上层液体应从上口倒出,A项错误;振荡过程中会有有机物蒸气产生,为保持分液漏斗内外压强相等,应不时地旋开活塞使漏斗内气体放出,B项正确;用装置c进行蒸馏操作,温度计是用来测蒸气的温度,故应置于蒸馏烧瓶支管口处,C项错误;过滤时必须用玻璃棒引流,D项错误。] 4.(2019·山西联考)实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( ) A.操作Ⅰ一定是过滤,其目的是将固液分离 B.可以提纯含少量杂质水的酒精 C.可以提纯含少量氯化钠杂质的硝酸钾 D.不能提纯含少量碳酸钙杂质的氯化钠 C [操作Ⅰ是溶解,将固体溶于水,A项错误;B项是除去杂质水,而操作Ⅰ中加入了水,B项错误;提纯含少量氯化钠杂质的硝酸钾,操作Ⅰ为溶解,二者溶解度受温度影响不同,采取冷却结晶法分离出硝酸钾,则操作Ⅱ为蒸发农缩、冷却结晶,操作Ⅲ是过滤、洗涤,C项正确;操作Ⅰ为溶解,碳酸钙不溶于水,操作Ⅱ为过滤,得到氯化钠溶液,操作Ⅲ为蒸发结晶,得到氯化钠固体,D项错误。] 5.(2019·试题调研)关于实验室制备、分离乙酸乙酯的装置,下列说法正确的是( ) A.图甲用于制备并收集乙酸乙酯 B.图乙用于分离乙酸乙酯 C.图丙用于蒸馏纯化乙酸乙酯 D.图丁可从分液漏斗下端放出乙酸乙酯 A [分离乙酸乙酯,不用过滤,B错;蒸馏时,温度计水银球不插入溶液中,C错;乙酸乙酯应从上端倒出,D错。] 6.(2019·甘肃联考)下列实验操作、现象与结论都正确的是( ) 选项 操作 现象 结论 A 将含杂质的乙烯通入溴水中 溶液褪色 乙烯中含SO2 B 向乙醇中滴加酸性高锰酸钾溶液 溶液褪色 乙醇表现氧化性 C 向淀粉水解液中加入银氨溶液,加热 无现象 淀粉一定没有水解 D 向乙酸乙酯粗品中加入少量碳酸氢钠溶液 产生气泡 乙酸乙酯粗品中含有乙酸 D [A项,乙烯也可使溴水褪色,错误;B项,乙醇使酸性高锰酸钾溶液褪色,表现还原性,错误;C项,可能是淀粉水解液中含有作催化剂的酸,破坏了银氨溶液,错误;D项,加入碳酸氢钠溶液产生气泡,说明乙酸乙酯粗品中含有乙酸,正确。] 7.(2019·武汉模拟)某氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法中正确的是( ) A.起始滤液的pH=7 B.试剂Ⅰ为Ba(NO3)2溶液 C.步骤②中加入试剂Ⅱ的目的是除去Ba2+ D.图示的步骤中必须要经过两次过滤操作 C [结合流程图可知,实验过程中先将样品溶于水,过滤后,向滤液中加入试剂Ⅰ(BaCl2溶液),使SO、CO分别生成BaSO4、BaCO3沉淀,过滤后再向滤液中加入试剂Ⅱ(K2CO3溶液),以除去引入的Ba2+,过滤掉生成的BaCO3沉淀后再向滤液中加入试剂Ⅲ(盐酸),以除去引入的CO,最后加热蒸干Q可得纯净的KCl晶体。起始时滤液中含有K2CO3,由于CO水解而使滤液显碱性,A项错误;试剂Ⅰ不能为Ba(NO3)2溶液,否则会引入难以除去的NO,B项错误;图示中的两次过滤操作可以合并为一次,D项错误。] 8.(2019·惠州模拟)为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( ) 被提纯的物质 除杂试剂 分离方法 A NaBr溶液(NaI) 氯水、CCl4 萃取、分液 B NH4Cl溶液(FeCl3) NaOH溶液 过滤 C CO2(CO) CuO粉末 通过灼热的CuO粉末 D SiO2(Al2O3) NaOH溶液 过滤 C [氯水具有强氧化性,能与NaBr和NaI都发生反应,A项错误;NH4Cl能和NaOH反应生成一水合氨,B项错误;灼热的CuO粉末能与CO反应生成Cu和CO2,灼热的CuO粉末与CO2不反应,C项正确;SiO2是酸性氧化物,Al2O3是两性氧化物,二者都能与NaOH溶液反应,D项错误。] 9.(2019·专家原创)环己烯是重要的化工原料。其实验室制备流程如下: Ⅰ.环己烯的制备与提纯 (1)原料FeCl3·6H2O中若含FeCl2杂质,检验方法为取一定量的该样品配成溶液,加入________(填化学式)溶液,现象为_____________________________。 (2)操作1的装置如图所示(加热和夹持装置已略去)。 ①浓硫酸也可作该反应的催化剂,选择FeCl3·6H2O而不用浓硫酸的原因为________(填序号)。 a.浓硫酸易使原料炭化并产生SO2 b.FeCl3·6H2O污染小、可循环使用,符合绿色化学理念 c.同等条件下,用FeCl3·6H2O比浓硫酸的平衡转化率高 ②仪器B的作用为_______________________________________________。 (3)下列玻璃仪器中,操作2中需使用的有________(填标号)。 a b c d (4)将操作3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,__________________(填序号)。 ①弃去前馏分,收集83 ℃的馏分 ②加热 ③通冷凝水 [解析] (1)检验FeCl3·6H2O中的FeCl2时,不能用KSCN溶液和氯水,也不能用酸性高锰酸钾溶液(Cl-能被酸性高锰酸钾溶液氧化),应选择K3[Fe(CN)6]溶液,现象为产生蓝色沉淀。(2)①a项,浓硫酸具有吸水性、脱水性和强氧化性,易使原料炭化并产生SO2,会降低原料利用率,正确;b项,FeCl3·6H2 O不产生有毒气体,污染小,可以循环使用,正确;c项,浓硫酸能吸收反应生成的水,使平衡向正反应方向移动,平衡转化率高,错误。②仪器B的作用为冷凝回流,减少环己醇的蒸出。(3)经操作2得到水相和有机相,操作2为分液,需要用到的仪器有分液漏斗和烧杯。(4)蒸馏时需先通冷凝水,后开始加热,以防冷凝管炸裂,然后弃去前馏分,收集83 ℃时的馏分即可得到环己烯。 [答案] (1)K3[Fe(CN)6] 出现蓝色沉淀 (2)①ab ②冷凝回流,减少环己醇的蒸出 (3)ad (4)③②① 10.以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4·7H2O的过程如图所示: 硼镁泥的主要成分如下表: 成分 MgO SiO2 FeO、Fe2O3 CaO Al2O3 B2O3 含量 30%~ 40% 20%~ 25% 5%~ 15% 2%~ 3% 1%~ 2% 1%~ 2% 回答下列问题: (1)“酸解”时应该加入的酸是________,“滤渣1”中主要含有________(写化学式)。 (2)“除杂”时加入Ca(ClO)2、MgO的作用分别是____________________、_____________________。 (3)判断“除杂”基本完成的方法是__________________________________ ____________________________________________________________________。 (4)分离“滤渣3”应趁热过滤的原因是_______________________________ ____________________________________________________________________。 [解析] (1)由目标产物MgSO4·7H2O可知“酸解”时加入的酸是H2SO4。根据表格中硼镁泥的主要成分可知只有SiO2不溶于H2SO4,“滤渣1”中主要成分为SiO2。(2)加入Ca(ClO)2的目的是将Fe2+氧化成Fe3+,加入MgO的目的是消耗过量的H2SO4,调节溶液的pH,使Fe3+、Al3+生成Fe(OH)3、Al(OH)3沉淀而除去。(3)可以通过检验滤液中是否含有Fe3+来判断“除杂”是否完成。(4)较低温度下,MgSO4·7H2O的溶解度减小,会结晶析出,造成产品损失,所以分离滤渣3应趁热过滤。 [答案] (1)H2SO4 SiO2 (2)将Fe2+氧化成Fe3+ 消耗过量的酸,调节溶液的pH,使Fe3+、Al3+以氢氧化物的形式沉淀除去 (3)取少量滤液,将其酸化后滴加KSCN溶液,若溶液未变红,则说明除杂完全 (4)防止MgSO4·7H2O结晶析出 11.(2019·广东名校联考)苯甲酸(C6H5COOH)的相对分子质量为122,熔点为122.4 ℃,沸点为249 ℃,密度为1.265 9 g·cm-3,在水中的溶解度:0.35 g(25 ℃)、2.7 g(80 ℃)、5.9 g(100 ℃),不易被氧化,是一种一元有机弱酸,微溶于水、溶于乙醇。实验室中由甲苯(分子式:C6H5CH3、相对分子质量:92,沸点为110.6 ℃,密度为0.866 9 g·cm-3)制备苯甲酸的实验如下: 第一步:将9.2 g甲苯和硫酸酸化的KMnO4 溶液(过量)置于如图的三颈烧瓶中,加热保持反应物溶液温度在90 ℃左右至反应结束,制备过程中不断从分水器分离出水。 第二步:将反应后混合液趁热过滤,滤液冷却后用硫酸酸化,抽滤得粗产品。 第三步:粗产品用水洗涤2到3次,干燥称量得固体11.7 g。 请回答下列问题: (1)第一步发生反应的化学方程式为_________________________________ ___________________________________________________________________。 (2)分水器的作用是______________________________________________, 判断该反应完成的现象是________________________________________。 (3)第二步中抽滤的优点是________________________________________。 (4)第三步证明粗产品洗涤干净的方法是____________________________ _______________________________________________________________; 干燥的最佳方法是________(填代号)。 a.空气中自然风干 b.沸水浴干燥 c.直接加热干燥 (5)由以上数据知苯甲酸的产率为________。 (6)设计合理的实验方案确定苯甲酸是弱酸,可从下列仪器和试剂中选择最简单的组合是________(填编号)。 ①pH计 ②0.01 mol·L-1 NaOH溶液 ③酚酞 ④甲基橙 ⑤1 mol·L-1 NaOH溶液 ⑥0.01 mol·L-1苯甲酸溶液 ⑦滴定管 ⑧锥形瓶 ⑨量筒 [解析] (1)根据得失电子守恒和原子守恒可知,C6H5CH3和硫酸酸化的KMnO4溶液反应的化学方程式为5C6H5CH3+6KMnO4+9H2SO45C6H5COOH+3K2SO4+6MnSO4+14H2O。(2)实验过程中,经冷凝管冷凝回流的冷凝液进入分水器,分层后,甲苯自动流回到三颈烧瓶中,生成的水从分水器中放出去,这样可以促使反应正向进行,提高甲苯的利用率,同时能减少抽滤所需时间。该反应完成时,三颈烧瓶中酸性KMnO4溶液颜色不再发生变化,或停止搅拌,静置,液体不再出现分层现象。(3)抽滤具有过滤速率快,得到的固体水分少等优点。(4)由于第二步用硫酸酸化滤液,因此可通过检验SO来判断粗产品是否洗涤干净,检验的方法是向少许最后一次的洗涤液中滴入几滴BaCl2溶液,若无沉淀生成,则说明粗产品洗涤干净。为了加快干燥过程,并减少损耗,干燥的最佳方法是沸水浴干燥,故b正确。(5)9.2 g 甲苯的物质的量为0.1 mol,理论上生成苯甲酸0.1 mol,其质量为0.1 mol×122 g·mol-1=12.2 g,根据实际生成11.7 g苯甲酸可求出苯甲酸的产率为×100%≈95.9%。(6)要通过实验确定苯甲酸是弱酸,最简单的方法就是用pH计测定0.01 mol·L-1苯甲酸溶液的pH,故最简单的组合为①和⑥。 [答案] (1)5C6H5CH3+6KMnO4+9H2SO45C6H5COOH+3K2SO4+6MnSO4+14H2O (2)分离出水,提高甲苯利用率,减少抽滤所需时间 停止搅拌,静置,液体不分层(或三颈烧瓶中溶液不再变色) (3)过滤速率快,得到的固体水分少 (4)取最后一次的洗涤液少许于试管中,滴加几滴BaCl2溶液,若无沉淀生成,则说明粗产品洗涤干净 b (5)96%(或95.9%) (6)①⑥ [教师用书独具] (2019·专家原创)氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室制备氯苯的装置如图所示(夹持仪器已略去)。 请回答下列问题: (1)仪器a中盛有KMnO4晶体,仪器b中盛有浓盐酸,打开仪器b的活塞,使浓盐酸缓缓滴下,可观察到仪器a中的现象是____________________________,用离子方程式表示产生该现象的原因:____________________________________ ___________________________________________________________________。 (2)仪器b外侧玻璃导管的作用是____________________________________ ____________________________________________________________________。 (3)仪器d内盛有苯和FeCl3固体粉末,仪器a中生成的气体经过仪器e进入仪器d中。 ①仪器e的名称是________,其盛装的试剂名称是________。 ②仪器d中的反应进行过程中,保持温度在40~60 ℃,以减少副反应发生。仪器d的加热方式最好是______加热,其优点是_________________________。 (4)仪器c的作用是_______________________________________________。 (5)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3、HCl及部分Cl2,然后通过碱洗除去Cl2,碱洗后通过分液得到含氯苯的有机混合物,混合物成分及沸点如下表: 有机物 苯 氯苯 邻二氯苯 间二氯苯 对二氯苯 沸点/℃ 80.0 132.2 180.4 173.0 174.1 从该有机混合物中提取氯苯时,采用蒸馏的方法,收集________℃的馏分。 (6)实际工业生产中,苯的流失如下表: 流失项目 蒸气挥发 二氯苯 其他 合计 苯流失量/(kg·t-1) 28.8 14.5 56.7 100.0 某一次投产加入13 t苯,则制得氯苯________t(保留一位小数)。 [解析] (1)仪器a中盛有KMnO4晶体,仪器b中盛有浓盐酸,混合时发生反应:2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O,故可观察到仪器a中有黄绿色气体生成。(2)仪器b外侧玻璃导管的作用是平衡仪器a、b内的气压,使浓盐酸能顺利滴下。(3)① a中制备的氯气中含有水蒸气,需用浓硫酸干燥,e为洗气瓶。②仪器d中的反应进行过程中,保持温度在40~60 ℃,反应温度较低,加热方式最好是水浴加热,水浴加热的优点是受热均匀,便于控制温度。(4)仪器c为球形冷凝管,其作用是冷凝回流。(5)由表可知,氯苯的沸点为132.2 ℃,故应收集132.2 ℃的馏分。(6)苯的总流失量为100 kg·t-1,故1 t苯中参加反应的苯的质量为1 t-0.1 t=0.9 t,苯与氯苯的相对分子质量之比为78∶112.5,则13 t苯可制得的氯苯的质量为13×0.9× t≈16.9 t。 [答案] (1)有黄绿色气体产生 2MnO+10Cl-+16H+===2Mn2++5Cl2↑+8H2O (2)平衡仪器a、b内的气压(或使浓盐酸能顺利滴下) (3)①洗气瓶 浓硫酸 ②水浴 受热均匀,易于控制温度 (4)冷凝回流 (5)132.2 (6)16.9查看更多