2019届高考化学二轮复习建模思想在高三化学复习中的应用学案
建模思想在高三化学复习中的应用
在高三化学复习阶段,大多数学生感觉化学知识点多,易懂难记。那么怎样使学生在复习阶段经过对知识点的系统梳理、深化拓宽而达到概括化、网络化、程序化,并能灵活迁移到习题或实践中解决问题呢?本文从建模思想角度论述化学复习的教与学,相信能给化学教师和高中学生新的启迪。
1 建模思想
证明
具体化
抽象化
解释
模型,中文原意即规范。按钱学森的观点:“模型就是通过我们对问题的分析,利用我们考察来的机理,吸收一切主要因素,略去一切不主要因素所创造出来的一幅图画。”因此,笔者提出的“建模思想”就是把研究对象(原型)的一些次要细节及非本质的联系舍去,从而以简化和理想化的形式去再现原型的各种复杂结构、功能和联系的一种科学思想。可以用如下图式表达科学建模过程。
研究的对象或原型或知识 模型 理论或规律
比如:αg H2在氧气中充分燃烧后,再通过足量过氧化钠,固体质量增加多少呢?a g CO在氧气中充分燃烧后,再通过足量过氧化钠,固体质量增加多少呢?通过讨论,归纳,抽象后,我们发现
O2
O2
H2+Na2O2 2NaOH CO+Na2O2 Na2CO3,
因此固体质量增加为H2或CO的质量。进一步归纳抽象,可以获得计算模型,符合(CO)n·(H2)m型的化学式,在O2存在下完全燃烧,其产物通过足量Na2O2固体完全反应,固体质量增加,恰好为该有机物的质量。应用上述的计算模型解答2004年理综试题中第12题,也就显得轻而易举。
取αg
某物质在氧气中完全燃烧,将其生成物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了αg。下面物质中不能满足上述结果的是( D )
A、H2 B、CO D、C6H12O6 D、C12H22O11
2 建模思想应用于化学复习
2.1应用建模思想梳理化学知识,使知识网络化、系统化。
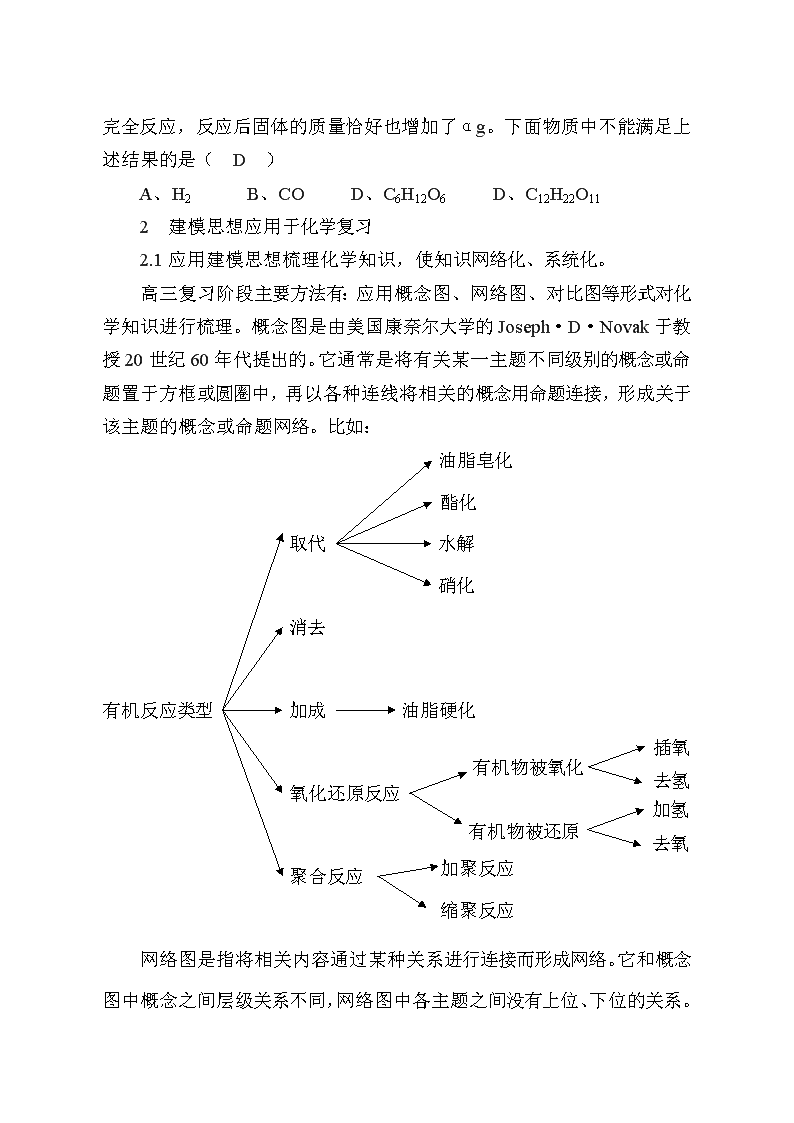
高三复习阶段主要方法有:应用概念图、网络图、对比图等形式对化学知识进行梳理。概念图是由美国康奈尔大学的Joseph·D·Novak于教授20世纪60年代提出的。它通常是将有关某一主题不同级别的概念或命题置于方框或圆圈中,再以各种连线将相关的概念用命题连接,形成关于该主题的概念或命题网络。比如:
油脂皂化
酯化
取代 水解
硝化
消去
插氧
有机反应类型 加成 油脂硬化
去氢
有机物被氧化
去氧
加氢
氧化还原反应
加聚反应
有机物被还原
缩聚反应
聚合反应
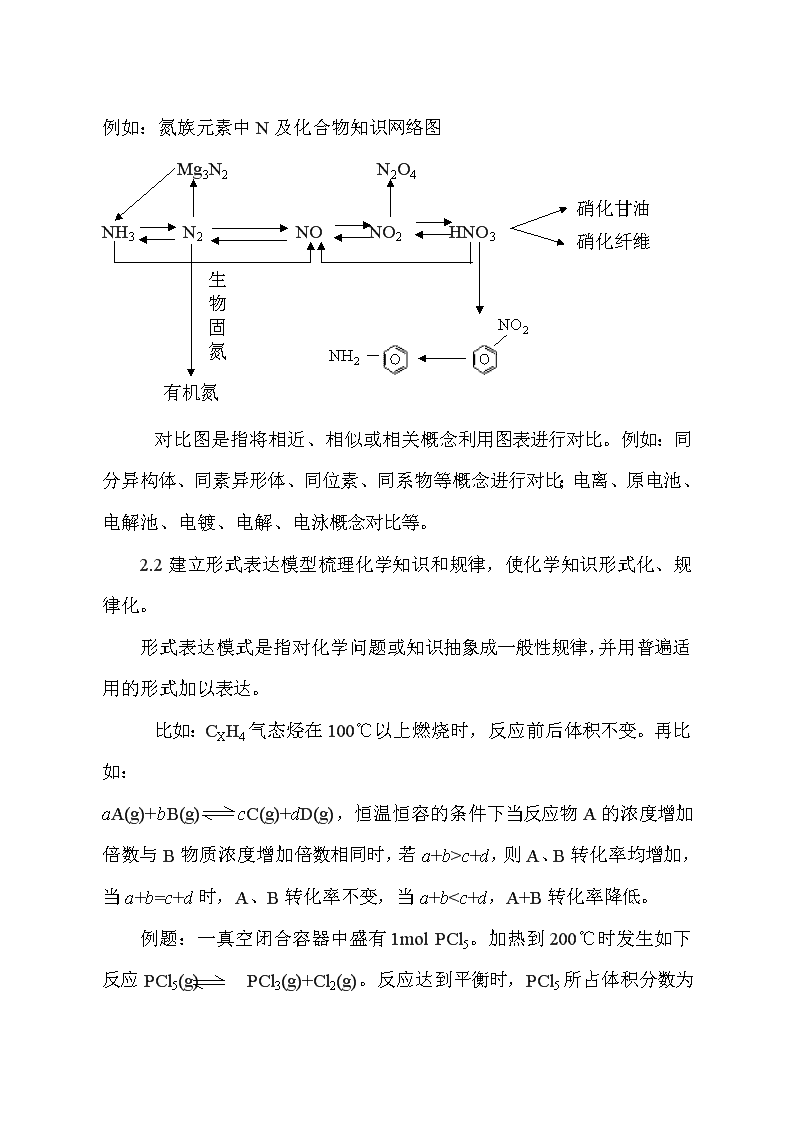
网络图是指将相关内容通过某种关系进行连接而形成网络。它和概念图中概念之间层级关系不同,网络图中各主题之间没有上位、下位的关系。例如:氮族元素中N及化合物知识网络图
Mg3N2 N2O4
硝化甘油
硝化纤维
NH3 N2 NO NO2 HNO3
生物固氮
NH2
NO2
有机氮
对比图是指将相近、相似或相关概念利用图表进行对比。例如:同分异构体、同素异形体、同位素、同系物等概念进行对比;电离、原电池、电解池、电镀、电解、电泳概念对比等。
2.2建立形式表达模型梳理化学知识和规律,使化学知识形式化、规律化。
形式表达模式是指对化学问题或知识抽象成一般性规律,并用普遍适用的形式加以表达。
比如:CXH4气态烃在100℃以上燃烧时,反应前后体积不变。再比如:
aA(g)+bB(g) cC(g)+dD(g),恒温恒容的条件下当反应物A的浓度增加倍数与B物质浓度增加倍数相同时,若a+b>c+d,则A、B转化率均增加,当a+b=c+d时,A、B转化率不变,当a+b
N B. N>M C. M=N D.无法比较
[解答策略]:在恒温恒容的条件下,因为反应前后的气体分子数目在增加,因此当增加PCl5的量时,PCl5的分解率在降低,故PCl5的体积百分含量在增加。
2.3应用数学模型解答化学问题,使知识应用灵活化、方法化。
数学是思维的工具。在高中化学中,数学有17个方面的应用,它们是应用坐标图像去解决问题、应用数轴帮助我们解答讨论型化学计算题、商余数、代数方程、不定方程、平均值法、不等式、指数与对数、数列、数学归纳法求有机物通式、排列组合、平面几何、立体几何、待定系数法配平化学方程式、拼凑搭配法、换元思想、数形结合思想等。
V/L
11.2
2.8
11.25
45
m粉/g
例:在100mL稀盐酸中加入混合均匀的NaHCO3和KHCO3的固体粉末,使之充分反应,右图表示加入粉末的质量
与产生气体的体积(标准状况下测定)的关系。
请计算:
(1)该盐酸的物质的量浓度。
(2)若该盐酸为140mL时,加入的粉末为67.5g ,产生的气体体积。
(3)若该盐酸为180mL,加入的粉末仍为67.5g,产生的气体体积。
[解答策略]:问题(1)解答。观察题中曲线,我们可以认定45 g粉末已将HCl完全消耗。根据离子反应方程式H++HCO3-=H2O+CO2↑,因此n(HCl)=11.2÷22.4=0.5mol,所以盐酸的物质的量浓度为0.5÷
0.1=5mol·L-1。
16.8L
问题(2)解答。因为H++HCO3-=H2O+CO2↑,
15.68L
故固体粉末质量增加时,若盐酸足量,则产生
11.2L
的气体的量和固体粉末质量成正比,即在原来
的直线上延伸(如右图),因此产生气体体积
140mL
盐酸
67.5g粉末
150mL盐酸
45g粉末
100mL盐酸
为15.68L,此时粉末过量。
问题(3)解答。同样用上述图,我们可以得到气体体积为16.8L,此时盐酸过量。
2.4形成解答问题思路模型,使解答过程模式化、格式化,提高解题过程准确性、规划化。
解答化学问题时,很多同学因为思路不清晰,导致解答问题常常无从下手。因此掌握解答一些化学问题的思路,形成解题的模型,能提高解题的准确度,降低试题的难度。
例3:乙二酸(HOOC—COOH)俗称草酸,其主要物理常数如下:
名 称
分子式
颜色、状态
溶解性(g)
熔点(℃)
密度(g/cm3)
乙二酸
H2C2O4
——
8.6(20℃)
189.5
1.900
二水合乙二酸
H2C2O4·2H2O
无色晶体
——
101.5
1.650
注:表中“——”是尚未有具体数据。
又知:草酸钙不溶于水。
175℃
已知草酸分解的化学方程式为
H2C2O4 H2O + CO2↑+ CO↑。
为了验证草酸受热分解及其产物,有人认为该装置不合理。请你根据草酸晶体的某些物理常数和实验目的,指出用该装置进行实验可能存在的不合理因素的主要原因。
[解答策略]解答化学实验方案设计评价的模式是:从化学实验方案设计4个基本要求出发:
一是科学性:指实验原理、实验操作程序、实验方法等。
二是安全性:造成大气污染、人身伤害。
三是可行性:化学实验药品、仪器、设备及方法等在中学现有条件下可实现。
四是简约性:实验步骤少、实验药品少、实验时间短、实验装置简单。
根据上述解答思路,我们可以得到以下的参考答案:
(1)科学性欠妥:因为乙二酸晶体往往带两个结晶水,在乙二酸分解前,它已熔化。
(2)安全性欠妥:CO有毒,排放到大气中会造成污染及人身伤害。
(3)可行性欠妥:本实验要证明乙二酸分解的所有产物,而本实验方案只设计证明了产物CO2
(4)简约性:尚可
例:恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2(g)+3H2(g) 2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=-6mol,计算α的值。
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同)n(原):n(平)= ______________。
(4)原混合气体中,α:b = ____________。
(5)达到平衡时,N2和H2的转化率之比α(N2):α(H2)= _________。
(6)平衡混合气体中,n(N2):n(NH3)= ________________。
[解答策略]:可逆反应计算的模式是:三步曲
第一步写出起始量,第二步写出反应量,第三步写出平衡量或剩余量。具体思路如下:
起始量
N2(g)+3H2(g) 2NH3(g)
αmol b mol 0mol
到t时刻反应量 α-13 2(α-13)
到t时刻剩余量 13mol 6mol
因此,问题(1)的答案为:观察起始量和剩余量,可得到(α-13)×2=6,α=16。同理,其他问题的答案分别为:8mol 5:4 2:3 1:2 3:3:2
综上所述,在高考备考阶段,培养学生建模思想,使千头万绪的化学知识点模式化、网络化、程序化、不仅有利于提高学生学习知识的效率,更能提高学生的解题能力,学习能力。