- 2021-07-08 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】山西省吕梁市2020届高三第一次模拟考试
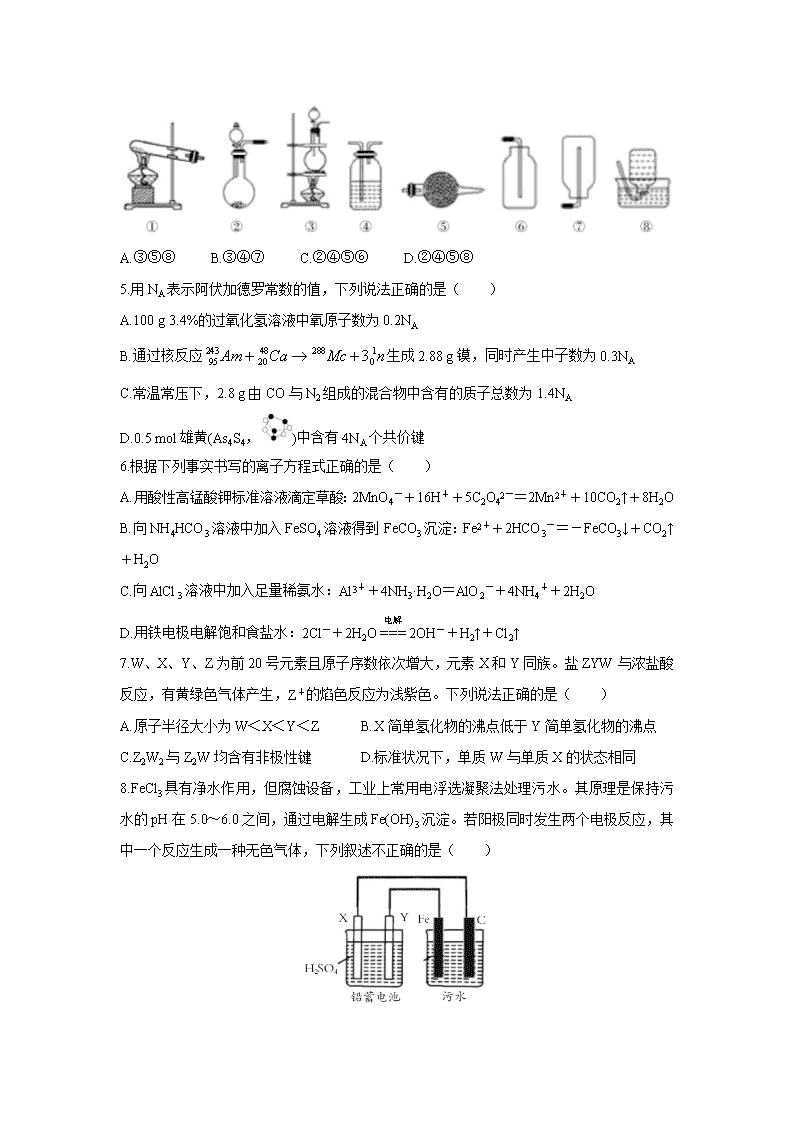
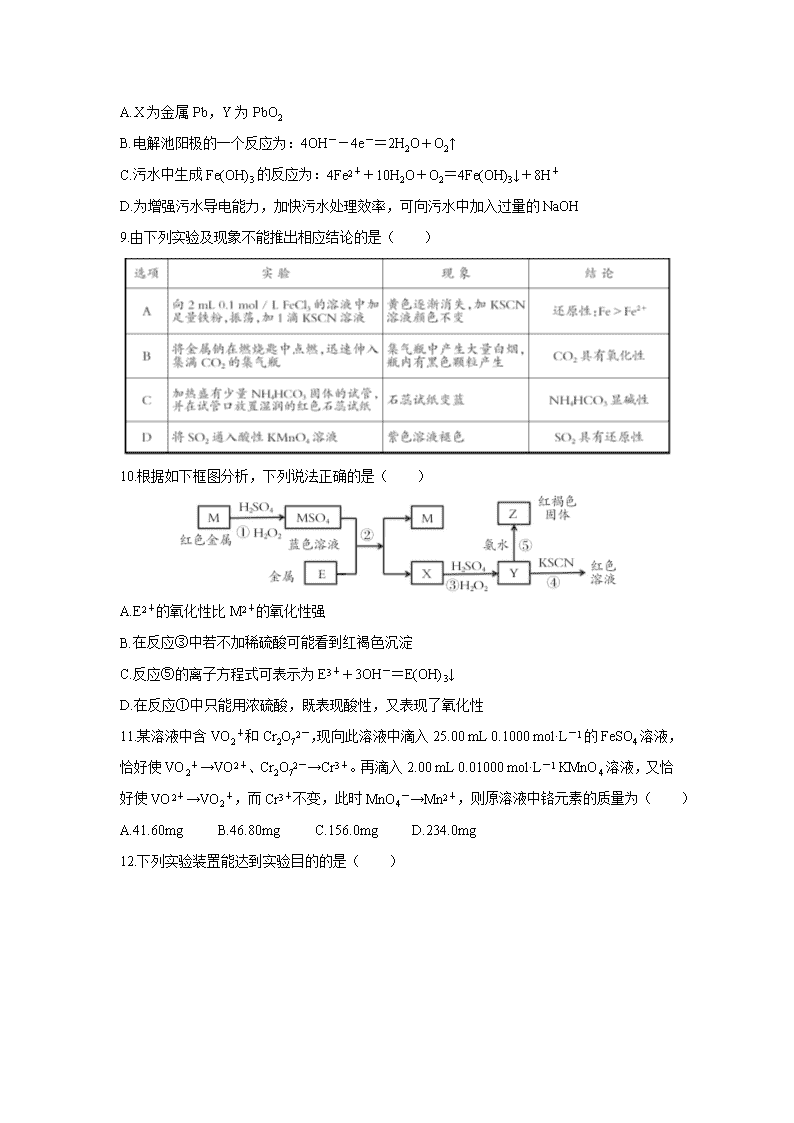
山西省吕梁市2020届高三第一次模拟考试 第Ⅰ卷(选择题 共48分) 可能用到的相对原子质量:H:1 C:12 O:16 Cr:52 一、选择题(本大题共16个小题,每小题3分,共48分) 在每小题列出的四个选项中,只有一项是最符合题目要求的,请将正确选项的字母标号在答题卡相应位置涂黑。 1.化学在生活中有着重要的应用。下列叙述错误的是( ) A.燃煤中加入生石灰可以减少酸雨的形成 B.高纯度的二氧化硅广泛用于制作光导纤维 C.花生油中的主要成分属于酯类,是天然高分子化合物 D.碳纳米管表面积大,可用作新型储氢材料 2.中华文化源远流长、博大精深。下列有关蕴含的化学知识的说法中,不正确的是( ) A.“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 B.“陶尽门前土,屋上无片瓦。十指不沾泥,鳞鳞居大厦。”黏土烧制陶瓷的过程发生了化学变化 C.“兰陵美酒郁金香,玉碗盛来琥珀光。”粮食发酵产生的酒精分散在酒糟中,可以通过蒸馏与酒糟分离 D.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 3.下表中相关物质的信息都正确的一项是( ) 4.如图所示是实验室常见的气体制取、干燥和收集装置。若用稀盐酸和石灰石制取干燥的CO2,则合理的组合是( ) A.③⑤⑧ B.③④⑦ C.②④⑤⑥ D.②④⑤⑧ 5.用NA表示阿伏加德罗常数的值,下列说法正确的是( ) A.100 g 3.4%的过氧化氢溶液中氧原子数为0.2NA B.通过核反应生成2.88 g镆,同时产生中子数为0.3NA C.常温常压下,2.8 g由CO与N2组成的混合物中含有的质子总数为1.4NA D.0.5 mol雄黄(As4S4,)中含有4NA个共价键 6.根据下列事实书写的离子方程式正确的是( ) A.用酸性高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O B.向NH4HCO3溶液中加入FeSO4溶液得到FeCO3沉淀:Fe2++2HCO3-=-FeCO3↓+CO2↑+H2O C.向AlCl3溶液中加入足量稀氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O D.用铁电极电解饱和食盐水:2Cl-+2H2O2OH-+H2↑+Cl2↑ 7.W、X、Y、Z为前20号元素且原子序数依次增大,元素X和Y同族。盐ZYW与浓盐酸反应,有黄绿色气体产生,Z+的焰色反应为浅紫色。下列说法正确的是( ) A.原子半径大小为W<X<Y<Z B.X简单氢化物的沸点低于Y简单氢化物的沸点 C.Z2W2与Z2W均含有非极性键 D.标准状况下,单质W与单质X的状态相同 8.FeCl3具有净水作用,但腐蚀设备,工业上常用电浮选凝聚法处理污水。其原理是保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。若阳极同时发生两个电极反应,其中一个反应生成一种无色气体,下列叙述不正确的是( ) A.X为金属Pb,Y为PbO2 B.电解池阳极的一个反应为:4OH--4e-=2H2O+O2↑ C.污水中生成Fe(OH)3的反应为:4Fe2++10H2O+O2=4Fe(OH)3↓+8H+ D.为增强污水导电能力,加快污水处理效率,可向污水中加入过量的NaOH 9.由下列实验及现象不能推出相应结论的是( ) 10.根据如下框图分析,下列说法正确的是( ) A.E2+的氧化性比M2+的氧化性强 B.在反应③中若不加稀硫酸可能看到红褐色沉淀 C.反应⑤的离子方程式可表示为E3++3OH-=E(OH)3↓ D.在反应①中只能用浓硫酸,既表现酸性,又表现了氧化性 11.某溶液中含VO2+和Cr2O72-,现向此溶液中滴入25.00 mL 0.1000 mol·L-1的FeSO4溶液,恰好使VO2+→VO2+、Cr2O72-→Cr3+。再滴入2.00 mL 0.01000 mol·L-1 KMnO4溶液,又恰好使VO2+→VO2+,而Cr3+不变,此时MnO4-→Mn2+,则原溶液中铬元素的质量为( ) A.41.60mg B.46.80mg C.156.0mg D.234.0mg 12.下列实验装置能达到实验目的的是( ) 13.下列说法正确的是( ) A.根据反应Cu+H2SO4CuSO4+H2↑,可推出Cu的还原性比H2的强 B.4Fe2++4Na2O2+6H2O=4Fe(OH)3+O2↑+8Na+,每生成4 mol Fe(OH)3共转移4 mol电子 C.根据反应2Co(OH)3+6HCl=2CoCl2+Cl2↑+6H2O可知氧化性:Co(OH)3>Cl2 D.因Cl2的氧化性强于I2,所以置换反应I2+2NaClO3=2NaIO3+Cl2不能发生 14.已知反应2NO2(g)N2O4(g) △H=-56.9 kJ·mol-1,不同温度下,容器中NO2浓度与反应时间的关系如图所示,下列说法正确的是( ) A.T1>T2 B.a点的正反应速率大于b点的逆反应速率 C.a点的反应速率小于c点的反应速率 D.b点时N2O4的浓度为0.9 mol·L-1 15.下列说法正确的是( ) A.甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1 B.已知N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应后放出46.2kJ的热量 C.12 g石墨转化为CO时,放出110.5 kJ的热量:2C(石墨,s)+O2(g)=2CO(g) △H=-221 kJ·mol-1 D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 16.常温下,Ka(HA)=1×10-5,分别向20 mL 0.1 mol·L-1 NaHCO3溶液和20 mL 0.1 mol·L-1 HA溶液中逐滴加入0.1 mol·L-1 NaOH溶液,滴定曲线如右图所示,下列叙述正确的是( ) A.a点溶液中存在:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) B.a、b点溶液中钠离子浓度的关系为:ca(Na+):cb(Na+)=1:3 C.c点溶液中存在:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) D.d点溶液中:=100 第Ⅱ卷(非选择题 共52分) 二、非选择题(本大题包含4个小题,共52分) 17.(12分)用电镀锡渣(主要含Sn、SnO)联合生产氯化亚锡和硫酸亚锡晶体,其工艺流程如下: 已知: ①SnCl2易水解生成碱式氯化亚锡Sn(OH)Cl; ②在水溶液中,Sn2+易被氧化为Sn4+。 请回答下列问题: (1)锡在周期表中的位置为________________________。 (2)已知反应Ⅰ得到的沉淀是SnO,产生气体的结构式为____________,反应的化学方程式为_____________________________________________。 (3)图中滤液的主要成分为______________、______________(写化学式)。 (4)酸溶时一般加入浓盐酸进行溶解,请用化学方程式及必要文字解释原因:______________ _______________________________________________________。 (5)电镀锡渣中的锡与烧碱、硝酸钠溶液反应可生产锡酸钠,并产生一种碱性气体,该反应的化学方程式为__________________________________________。 18.(13分)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色,各物质的转化关系如下图(部分反应产物已略去)。 请回答下列问题; (1)N氧化物的化学式为____________________,F的电子式为____________________。 (2)反应③的化学方程式为___________________________________________。 (3)在反应①②③④中不属于置换反应的是____________________(填序号)。 (4)写出X与F以等物质的量进行反应的离子方程式_________________________________。 (5)500 mL KNO3和X的混合溶液,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL。 ①写出电解时阳极的电极反应式________________________________; ②电解后溶液中c(H+)为_________________mol·L-1。 19.(13分)利用O2和PCl3为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去): 已知PCl3和三氯氧磷的性质如下表: (1)仪器乙的名称是___________________。 (2)实验过程中仪器丁的进水口为______________(选填“a”或“b”)口。 (3)装置B的作用是____________(填标号)。 a.气体除杂 b.加注浓硫酸 c.观察气体流出速度 d.调节气压 (4)整个装置必须干燥,若未干燥,写出所有副反应的化学方程式______________________。 (5)制备三氯氧磷所用PCl3测定纯度的方法如下:迅速称取mg产品,水解完全后配成250 mL溶液,取出25.00 mL加入过量的c1 mol·L-1 V1 mL碘溶液,充分反应后再用c2 mol·L-1 Na2S2O3溶液滴定过量的碘,终点时消耗V2 mL Na2S2O3溶液。 已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应。根据上述数据,该产品中PCl3(相对分子质量为137.5)的质量分数的计算式为_________%。(用含c1、c2、V1、V2的代数式表示) 20.(14分)工业上可用NO与Cl2合成亚硝酰氯(ClNO),可以用于有机合成。回答下列问题: (1)一定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及有关反应的热化学方程式如下: ①2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) △H1 ②4NO2(g)+2NaCl(s)2NaNO3(g)+2NO(g)+Cl2(g) △H2 ③2NO(g)+Cl2(g)2ClNO(g) △H3 则△H1=________(用△H2、△H3表示)。 (2)300℃时,在一密闭容器中发生反应:2ClNO(g)2NO(g)+Cl2(g),其正反应速率表达式: v正=k正cx(ClNO)。测得正反应速率和对应浓度的数据如表: 则y=________。达到平衡后,若减小压强,则混合气体的平均相对分子质量将________(选填“增大”、“减小”或“不变”)。 (3)25℃时,向体积为2L且带气压计的恒容密闭容器中通入0.008 mol NO和0.004 mol Cl2发生反应:2NO(g)+Cl2(g)2ClNO(g) △H。已知:反应起始和平衡时温度相同。 ①测得反应过程中压强(p)随时间(t)的变化如图1曲线a所示,则△H________(选填“>”、“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得压强(p)随时间(t)的变化如图1曲线b所示,则改变的条件是_________________________________。 ②图2是两位同学描绘的上述反应平衡常数的对数值(lgK)与温度的变化关系图象,其中正确的曲线是________(选填“甲”或“乙”);m的值为____________。 【参考答案】 一、 选择题(每小题3分,共48分) 1——5 CABCC 6——10BDDCB 11——15 ADCBC 16 D 17. (12分,除标明外,每空2分) (1)第五周期第ⅣA族(2分) (2)O=C=O (2分) Na2CO3+SnCl2===SnO↓+2NaCl+CO2↑(2分) (3)NaCl (1分) Na2CO3(1分) (4)SnCl2极易水解,存在平衡SnCl2+H2OSn(OH)Cl+HCl;加入盐酸,使该平衡向左移动,抑制Sn2+水解(2分) (5)2Sn+3NaOH+NaNO3===2Na2SnO3+NH3↑(2分) 18.(13分) (1)Al2O3 (1分) Na+[:::]2-Na+ (2分) (2)2Al+Fe2O32Fe+Al2O3(2分) (3)②④(2分) (4) 2Cu2++2Na2O2 +2H2O = 2 Cu (OH)2 +O2 ↑ + 4Na+ (2分) (5) 4OH-—4e-=O2↑ +2H2O 或 2H2O —4e-=O2↑ +4 H+ (2分) 0.4 (2分) 19.(13分) (1)圆底烧瓶(只答烧瓶不给分) (2分) (2) a (2分) (3) acd(3分) (只要答案出现b,本小题0分,答1个且正确得1分,答2个且正确得2分) (4)PCl3+3H2O =H3PO3+3HCl(2分)POCl3+3H2O == H3PO4+3HCl (2分) (5)(2分) 20(14) (1)(ΔH2+ΔH3) (2分) (2)1.2(2分) 减小(2分) (3)① < (2分)加入催化剂 (2分) ② 乙 (2分) 3 (2分)查看更多