- 2021-07-08 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】江西省南昌市进贤县第一中学2019-2020学年高一上学期期末考试试题
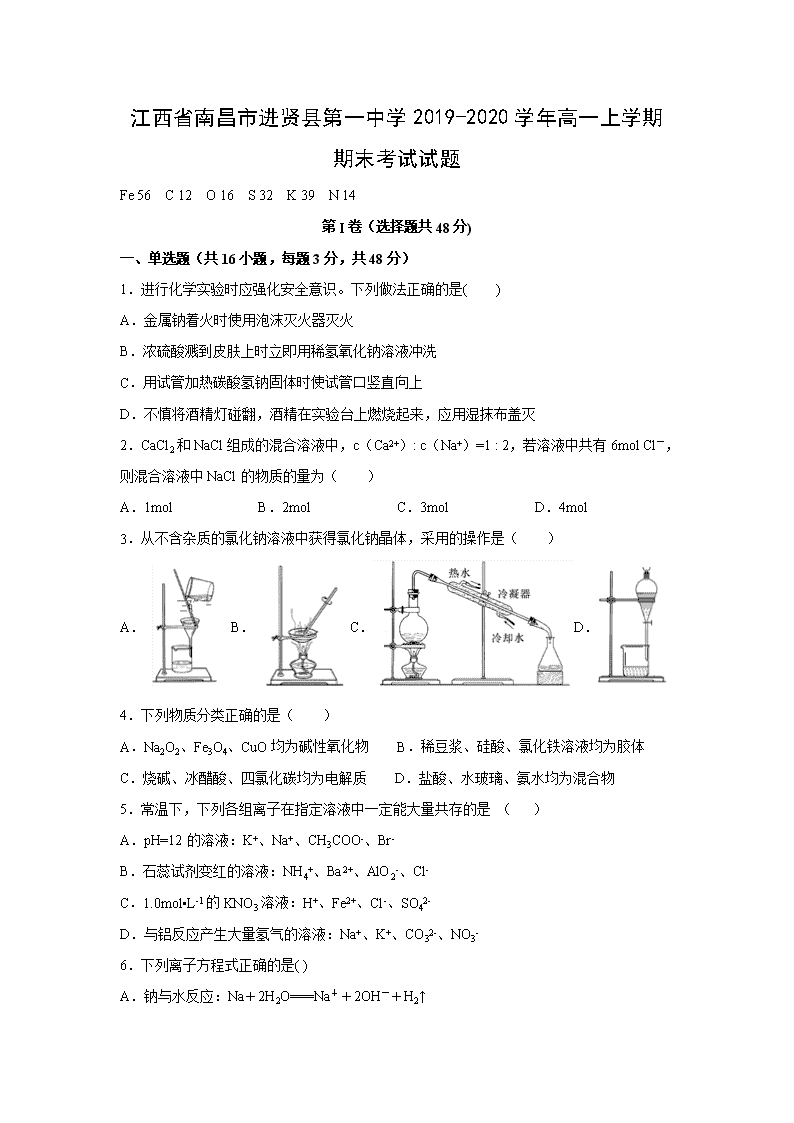
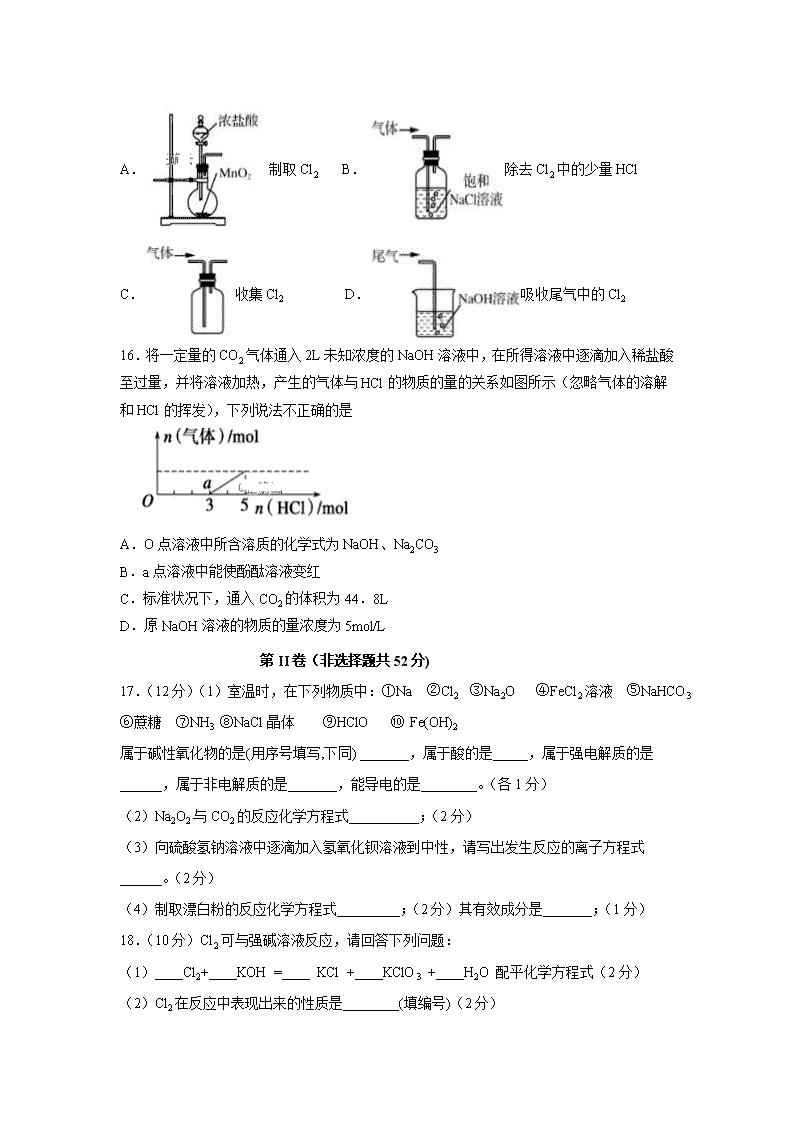
江西省南昌市进贤县第一中学2019-2020学年高一上学期期末考试试题 Fe 56 C 12 O 16 S 32 K 39 N 14 第I卷(选择题共48分) 一、单选题(共16小题,每题3分,共48分) 1.进行化学实验时应强化安全意识。下列做法正确的是( ) A.金属钠着火时使用泡沫灭火器灭火 B.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 C.用试管加热碳酸氢钠固体时使试管口竖直向上 D.不慎将酒精灯碰翻,酒精在实验台上燃烧起来,应用湿抹布盖灭 2.CaCl2和NaCl组成的混合溶液中,c(Ca2+): c(Na+)=1 : 2,若溶液中共有6mol Cl-,则混合溶液中NaCl的物质的量为( ) A.1mol B.2mol C.3mol D.4mol 3.从不含杂质的氯化钠溶液中获得氯化钠晶体,采用的操作是( ) A. B.C.D. 4.下列物质分类正确的是( ) A.Na2O2、Fe3O4、CuO均为碱性氧化物 B.稀豆浆、硅酸、氯化铁溶液均为胶体 C.烧碱、冰醋酸、四氯化碳均为电解质 D.盐酸、水玻璃、氨水均为混合物 5.常温下,下列各组离子在指定溶液中一定能大量共存的是 ( ) A.pH=12的溶液:K+、Na+、CH3COO-、Br- B.石蕊试剂变红的溶液:NH4+、Ba2+、AlO2-、Cl- C.1.0mol▪L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- 6.下列离子方程式正确的是( ) A.钠与水反应:Na+2H2O===Na++2OH-+H2↑ B.硫酸铝溶液中加入过量氨水:Al3++4OH-===AlO2-+2H2O C.将氯气通入氯化亚铁溶液:2Fe2++Cl2===2Fe3++2Cl- D.金属铝溶于氢氧化钠溶液:Al+2OH-===AlO2-+H2↑ 7.下列不能通过单质间反应而制得的物质是( ) A.CuCl2 B.CuS C.FeCl3 D.FeS 8.既能与酸(H+)反应,又能与碱(OH-)反应的化合物是 ( ) ①MgO ②Al(OH)3 ③NaHSO4 ④NaHCO3 ⑤CH3COONH4 ⑥Al A.②④ B.②③④ C.②④⑤ D.②④⑥ 9.取Fe、FeO、Fe2O3的均匀混合物质量为7.2g,向其中加入200 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出1120 mL(标准状况)的气体。所得溶液中,加入KSCN溶液无血红色出现,那么若用足量的CO在高温下还原相同质量的此混合物,能产生铁的质量为 ( ) A.1.4g B.2.8g C.5.6g D.11.2g 10.加热熔化氢氧化钠的坩埚,应选用的是( ) A.瓷坩埚 B.石英坩埚 C.铁坩埚 D.铝坩埚 11.某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等。向该无色溶液中滴加少量溴水,溶液仍呈无色。下列关于该溶液的判断正确的是 A.肯定不含I- B.肯定含有SO32-、I- C.肯定不含SO42- D.肯定含有NH4+ 12.在一定条件下,NO跟NH3可以发生反应:6NO+4NH3=5N2+6H2O,该反应中被氧化和被还原的氮元素的质量比是 ( ) A.3∶2 B.2∶1 C.1∶1 D.2∶3 13.下列四种有色溶液与SO2 作用,均能褪色,其实质相同的是( ) ①品红溶液 ②酸性KMnO4溶液 ③溴水 ④滴有酚酞的NaOH溶液 A.①④ B.②③ C.②③④ D.①②③ 14.已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO4-→Mn2+;Cl2→2Cl-;HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,则得到I2最多的是( ) A.Fe3+ B.MnO4- C.Cl2 D.HNO2 15.实验室用下列装置制取、提纯、收集Cl2、尾气处理,不能达到实验目的是( ) A.制取Cl2 B.除去Cl2中的少量HCl C.收集Cl2 D.吸收尾气中的Cl2 16.将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是 A.O点溶液中所含溶质的化学式为NaOH、Na2CO3 B.a点溶液中能使酚酞溶液变红 C.标准状况下,通入CO2的体积为44.8L D.原NaOH溶液的物质的量浓度为5mol/L 第II卷(非选择题共52分) 17.(12分)(1)室温时,在下列物质中:①Na ②Cl2 ③Na2O ④FeCl2溶液 ⑤NaHCO3 ⑥蔗糖 ⑦NH3 ⑧NaCl晶体 ⑨HClO ⑩ Fe(OH)2 属于碱性氧化物的是(用序号填写,下同) _______,属于酸的是_____,属于强电解质的是______,属于非电解质的是_______,能导电的是________。(各1分) (2)Na2O2与CO2的反应化学方程式__________;(2分) (3)向硫酸氢钠溶液中逐滴加入氢氧化钡溶液到中性,请写出发生反应的离子方程式 ______。(2分) (4)制取漂白粉的反应化学方程式_________;(2分)其有效成分是_______;(1分) 18.(10分)Cl2可与强碱溶液反应,请回答下列问题: (1)____Cl2+____KOH =____ KCl +____KClO3 +____H2O 配平化学方程式(2分) (2)Cl2在反应中表现出来的性质是________(填编号)(2分) ①只有还原性 ②只有氧化性 ③既有氧化性又有还原性 (3)该反应过程有0.5mol电子转移,则参加反应的Cl2为________mol,(2分)其体积在标准状况下为_______L。(2分) (4)氧化产物是_____________,还原产物是___________。(2分) 19.(9分)A、B、C均为中学化学常见的纯净物,它们之间存在如下转化关系: 其中①②③均为有单质参与的反应。 (1)若A是常见的金属,①③中均有同一种黄绿色气体参与反应,B溶液遇KSCN显血红色,且②为化合反应,写出反应②的离子方程式_________________________。(2分) (2)如何检验上述C溶液中的阳离子?______________________。(2分) (3)若B是太阳能电池用的光伏材料,①②③为工业制备B的反应。C的化学式是____________,(2分)属于置换反应____________,(填序号)(1分)写出反应①的化学方程式____________________。(2分) 20.(12分)已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中 使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀。 (1)物质A的化学式为 ________,(1分)F化学式为 ________;(1分) (2)B和R在溶液中反应生成F的离子方程式为__________________________;(2分) (3)H在潮湿空气中变成M的实验现象是 ,(2分)化学方程式为 ;(2分) (4)A和水反应生成B和C的化学方程式为__________________________(2分) (5)印刷行业刻制印刷电路板(含有铜箔)时,要用W溶液中作为“腐蚀液”,写出该反应的离子方程式______________________。(2分) 21.(9分)ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2 成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应 :2NaClO2 + Cl2 ===2ClO2 + 2NaCl。 下图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2) (1)仪器P的名称是_________________。(1分) (2)写出装置A中烧瓶内发生反应的离子方程式:_______________________(2分) (3)B装置中所盛试剂是______________,(1分)C装置的作用____________,(2分)G装置的作用 。(1分) (4)F为ClO2收集装置,应选用的装置是 (填序号)(1分),其中与E装置导管相连的导管口是________(填接口字母)(1分)。 【参考答案】 1.D 2.C 3.B 4.D 5.A 6.C 7.B 8.C 9.C 10.C 11.C 12.D 13.B 14.B 15.A 16.D 17.(12分)(1) ③ ⑨ ③⑤⑧ ⑥⑦ ①④ (各1分) (2)2Na2O2+2CO2=2Na2CO3+O2 (2分) (3)2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O (2分) (4)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O (2分); Ca(ClO)2 (1分) 18. (10分)(1)3 Cl2 + 6 KOH = 5 KCl + 1 KClO3 + 3 H2O (2分) (2) ③ (2分) (3) 0.3 mol (2分); 6.72 L (2分) (4) KClO3(1分); KCl (1分) 19. (9分)(1)Fe+2Fe3+=3Fe2+ (2分) (2) 取少量溶液于试管,加KSCN溶液,无明显现象,再加氯水,溶液变成血红色,则证明含Fe2+ (2分) (3) SiCl4 (2分); ① ③ (1分); 2C+SiO2Si+2CO↑(2分) 20. (12分)(1)Na2O2 (1分) ; H2 (1分) (2)2Al + 2OH- + 2H2O=2AlO2- + 3H2↑ (2分) (3)白色沉淀迅速变为灰绿色,最终变为红褐色 (2分) 4Fe(OH)2 + 2H2O + O2 =4Fe(OH)3 (2分) (4) 2Na2O2 + 2H2O =4NaOH + O2↑ (2分) (5) 2Fe3+ +Cu=2Fe2++Cu2+ (2分) 21. (9分)(1)分液漏斗(1分) (2)MnO2+4H++2Cl- Mn2+ +Cl2 +2H2O (2分) (3) 饱和食盐水(1分) ; 除去Cl2 中的水蒸汽 (2分); 做安全瓶防倒吸 (1分) ; (4) ②(1分) ; d (1分) 查看更多