- 2021-07-08 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
选修4第三章第一节:弱电解质的电离3
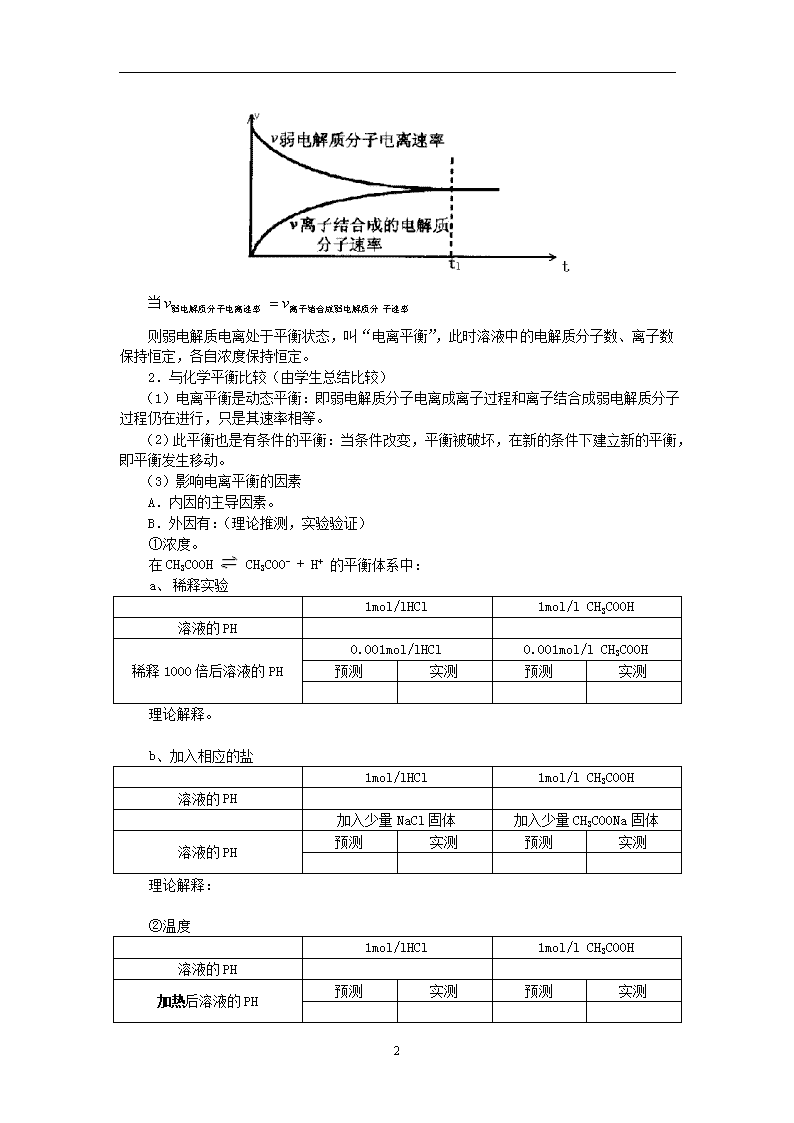
第三章第一节:弱电解质的电离 教学目标: 1. 掌握弱电解质的电离平衡。 2. 了解电离平衡常数的概念。 3. 了解影响电离平衡的因素 重点、难点: 外界条件对电离平衡的影响,电离平衡常数。 教学方法:实验探究、类比、推理等教学方法结合使用。 引入: 问题:什么是电解质?哪些物质属于电解质? 一、电解质,非电解质 1.定义:在水溶液中或熔融状态下,能导电的化合物叫电解质。 上述两种情况下都不导电的化合物叫非电解质。 2.酸、碱、盐都是电解质。 二、强电解质,弱电解质 1. 区分电解质强弱的依据: 分组实验3-1 1mol/lHCl 1mol/l CH3COOH 与镁条反应现象 实验结论 分组实验3-1 1mol/lHCl 1mol/l CH3COOH 溶液的PH(用PH计测定) 实验结论 2.电离方程式: (1)强电解质: HCl = H+ + Cl- (2)弱电解质: CH3COOH CH3COO- + H+ 3.强弱电解质与结构关系。 (1)强电解质:强碱、强酸和多数盐; (2)弱电解质:弱酸、弱碱和水等。 三、弱电解质电离平衡 1.电离平衡定义 在一定条件下(如温度,浓度),当电解质分子电离成离子的速率和离子重新结合成分子的速度相等时,电离过程就达到了平衡状态,这叫做电离平衡。 弱电解质电离过程(用图像分析建立) 10 当 则弱电解质电离处于平衡状态,叫“电离平衡”,此时溶液中的电解质分子数、离子数保持恒定,各自浓度保持恒定。 2.与化学平衡比较(由学生总结比较) (1)电离平衡是动态平衡:即弱电解质分子电离成离子过程和离子结合成弱电解质分子过程仍在进行,只是其速率相等。 (2)此平衡也是有条件的平衡:当条件改变,平衡被破坏,在新的条件下建立新的平衡,即平衡发生移动。 (3)影响电离平衡的因素 A.内因的主导因素。 B.外因有:(理论推测,实验验证) ①浓度。 在CH3COOH CH3COO- + H+ 的平衡体系中: a、 稀释实验 1mol/lHCl 1mol/l CH3COOH 溶液的PH 稀释1000倍后溶液的PH 0.001mol/lHCl 0.001mol/l CH3COOH 预测 实测 预测 实测 理论解释。 b、加入相应的盐 1mol/lHCl 1mol/l CH3COOH 溶液的PH 加入少量NaCl固体 加入少量CH3COONa固体 溶液的PH 预测 实测 预测 实测 理论解释: ②温度 1mol/lHCl 1mol/l CH3COOH 溶液的PH 加热后溶液的PH 预测 实测 预测 实测 10 理论解释:电离过程是一个吸热过程,所以,升高温度,平衡向电离方向移动。 练习:完成下表 在氨水中进行如下实验操作 操作/项目 PH [OH-] [NH4+] [NH3H2O] 加入NH4Cl固体 加入NaOH固体 加入HCl溶液 3.电离平衡常数(自学点拨) 实验3-2(分组) 1mol/l硼酸 1mol/l CH3COOH 溶液的PH 加入Na2CO3溶液现象 实验结论及解释: (1)一元弱酸电离平衡常数: (2)一元弱碱电离平衡常数: (3)多元弱酸是分步电离,每步各有电离常数。如: (4)电离平衡常数只随温度变化而变化,而与浓度无关。 (5)K的意义: ①电离平衡常数化是温度函数,温度不变K不变。 10 ②值越大,该弱电解质较易电离,其对应的弱酸弱碱较强;值越小,该弱电解质越难电离,其对应的弱酸弱碱越弱;即值大小可判断弱电解质相对强弱。 ③多元弱酸是分步电离的,一级电离程度较大,产生,对二级、三级电离产生抑制作用。 随堂练习 1.足量镁和一定量的盐酸反应,为减慢反应速率,但又不影响的总量,可向盐酸中加入下列物质中的( ) A. B. C. D. 2.是比碳酸还要弱的酸,为了提高氯水中的浓度,可加入( ) A. B. C. D. 3.浓度和体积都相同的盐酸和醋酸,在相同条件下分别与足量固体(颗粒大小均相同)反应,下列说法中正确的是( ) A.盐酸的反应速率大于醋酸的反应速率 B.盐酸的反应速率等于醋酸的反应速率 C.盐酸产生的二氧化碳比醋酸更多 D.盐酸和醋酸产生的二氧化碳一样多 4.下列叙述中可说明酸甲比酸乙的酸性强的是( ) A.溶液导电性酸甲大于酸乙 B.钠盐溶液的碱性在相同物质的量浓度时,酸甲的钠盐比酸乙的钠盐弱 C.酸甲中非金属元素比酸乙中非金属元素化合价高 D.酸甲能与酸乙的铵盐反应有酸乙生成 5.有两种一元弱酸的钠盐溶液,其物质的量浓度相等,现将这两种盐的溶液中分别通入适量的,发生如下反应: 和的酸性强弱比较,正确的是( ) A.较弱 B.较弱 C.两者相同 D.无法比较 总结、扩展 1.化学平衡知识与电离平衡知识对照比较。 2.一元弱酸弱碱中与的求法: 弱电酸中浓度:(酸为弱酸物质的量浓度) 弱碱中浓度:(碱为弱碱物质的量浓度) 3.讨论中存在哪些微粒?(包括溶剂) 4.扩展 10 难溶电解质在水溶液中存在着电离平衡。在常温下,溶液中各离子浓度以它们的系数为方次的乘积是一个常数,该常数叫溶度各()。例如 溶液中各离子浓度(加上其方次)的乘积大于、等于溶度积时出现沉淀,反之沉淀溶解。 (1)某溶液中,如需生成沉淀,应调整溶液的使之大于 。 (2)要使0.2mol/L 溶液中的沉淀较为完全(使浓度降低至原来的千分之一),则应向溶液里加入溶液,使溶液为 。 10 第三章第一节:弱电解质的电离(学习卷) 一、电解质,非电解质 1. 定义:在水溶液中或熔融状态下,能导电的化合物叫电解质。 上述两种情况下都不导电的化合物叫非电解质 2. 酸、碱和盐都是 二、强电解质,弱电解质 1.区分电解质强弱的依据: 分组实验3-1 1mol/lHCl 1mol/l CH3COOH 与镁条反应现象 实验结论 分组实验3-1 1mol/lHCl 1mol/l CH3COOH 溶液的PH(用PH计测定) 实验结论 2.电离方程式: (1)强电解质: HCl = H+ + Cl- (2)弱电解质: CH3COOH CH3COO- + H+ 3.强弱电解质与结构关系。 (1)强电解质:强碱、强酸和多数盐;如: (2)弱电解质:弱酸、弱碱和水等。如: 三、弱电解质电离平衡 1.电离平衡定义 在一定条件下(如温度,浓度),当电解质分子电离成离子的速率和离子重新结合成分子的速度相等时,电离过程就达到了平衡状态,这叫做电离平衡。 弱电解质电离过程(用图像分析建立) 10 当时,弱电解质电离处于平衡状态,叫“电离平衡”,此时溶液中的电解质分子数、离子数保持恒定,各自浓度保持 。 2.与化学平衡比较(学生总结比较) (1)电离平衡的特点: (2)影响电离平衡的因素 A.内因的主导因素。 B.外因有:(理论推测实验验证) ①浓度。 在CH3COOH CH3COO- + H+ 的平衡体系中: a、 稀释实验 1mol/lHCl 1mol/l CH3COOH 溶液的PH 稀释1000倍后溶液的PH 0.001mol/lHCl 0.001mol/l CH3COOH 预测 实测 预测 实测 理论解释。 c、加入相应的盐 1mol/lHCl 1mol/l CH3COOH 溶液的PH 加入少量NaCl固体 加入少量CH3COONa固体 溶液的PH 预测 实测 预测 实测 理论解释: ②温度 1mol/lHCl 1mol/l CH3COOH 溶液的PH 加热后溶液的PH 预测 实测 预测 实测 理论解释:电离过程是一个吸热过程,所以,升高温度,平衡向电离方向移动。 10 练习:完成下表 在氨水中进行如下实验操作 操作/项目 PH [OH-] [NH4+] [NH3H2O] 加入NH4Cl固体 加入NaOH固体 加入HCl溶液 1. 电离平衡常数(自学) 实验3-2(分组) 1mol/l硼酸 1mol/l CH3COOH 溶液的PH 加入Na2CO3溶液现象 实验结论及解释: (1)一元弱酸电离平衡常数: = (2)一元弱碱电离平衡常数: = (3)多元弱酸是分步电离,每步各有电离常数。如: (4)k的意义(与化学平衡常数比较) ①电离平衡常数化是温度函数,温度不变K不变。 ②值越大,该弱电解质较易电离,其对应的弱酸弱碱较强;值越小,该弱电解质越难电离,其对应的弱酸弱碱越弱;即值大小可判断弱电解质相对强弱。 ③多元弱酸是分步电离的,一级电离程度较大,产生,对二级、三级电离产生抑制作用。如: 10 随堂练习 1.足量镁和一定量的盐酸反应,为减慢反应速率,但又不影响的总量,可向盐酸中加入下列物质中的( ) A. B. C. D. 2.是比碳酸还要弱的酸,为了提高氯水中的浓度,可加入( ) A. B. C. D. 3.浓度和体积都相同的盐酸和醋酸,在相同条件下分别与足量固体(颗粒大小均相同)反应,下列说法中正确的是( ) A.盐酸的反应速率大于醋酸的反应速率 B.盐酸的反应速率等于醋酸的反应速率 C.盐酸产生的二氧化碳比醋酸更多 D.盐酸和醋酸产生的二氧化碳一样多 4.下列叙述中可说明酸甲比酸乙的酸性强的是( ) A.溶液导电性酸甲大于酸乙 B.钠盐溶液的碱性在相同物质的量浓度时,酸甲的钠盐比酸乙的钠盐弱 C.酸甲中非金属元素比酸乙中非金属元素化合价高 D.酸甲能与酸乙的铵盐反应有酸乙生成 5.有两种一元弱酸的钠盐溶液,其物质的量浓度相等,现将这两种盐的溶液中分别通入适量的,发生如下反应: 和的酸性强弱比较,正确的是( ) A.较弱 B.较弱 C.两者相同 D.无法比较 总结、扩展 1.化学平衡知识与电离平衡知识对照比较。 2.一元弱酸弱碱中与的求法: 弱电酸中浓度:(酸为弱酸物质的量浓度) 弱碱中浓度:(碱为弱碱物质的量浓度) 10 3.讨论中存在哪些微粒?(包括溶剂) 4.扩展 难溶电解质在水溶液中存在着电离平衡。在常温下,溶液中各离子浓度以它们的系数为方次的乘积是一个常数,该常数叫溶度各()。例如 溶液中各离子浓度(加上其方次)的乘积大于、等于溶度积时出现沉淀,反之沉淀溶解。 (1)某溶液中,如需生成沉淀,应调整溶液的使之大于 。 (2)要使0.2mol/L 溶液中的沉淀较为完全(使浓度降低至原来的千分之一),则应向溶液里加入溶液,使溶液为 。 10查看更多