- 2021-07-08 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届高考化学二轮复习海水资源的开发利用作业
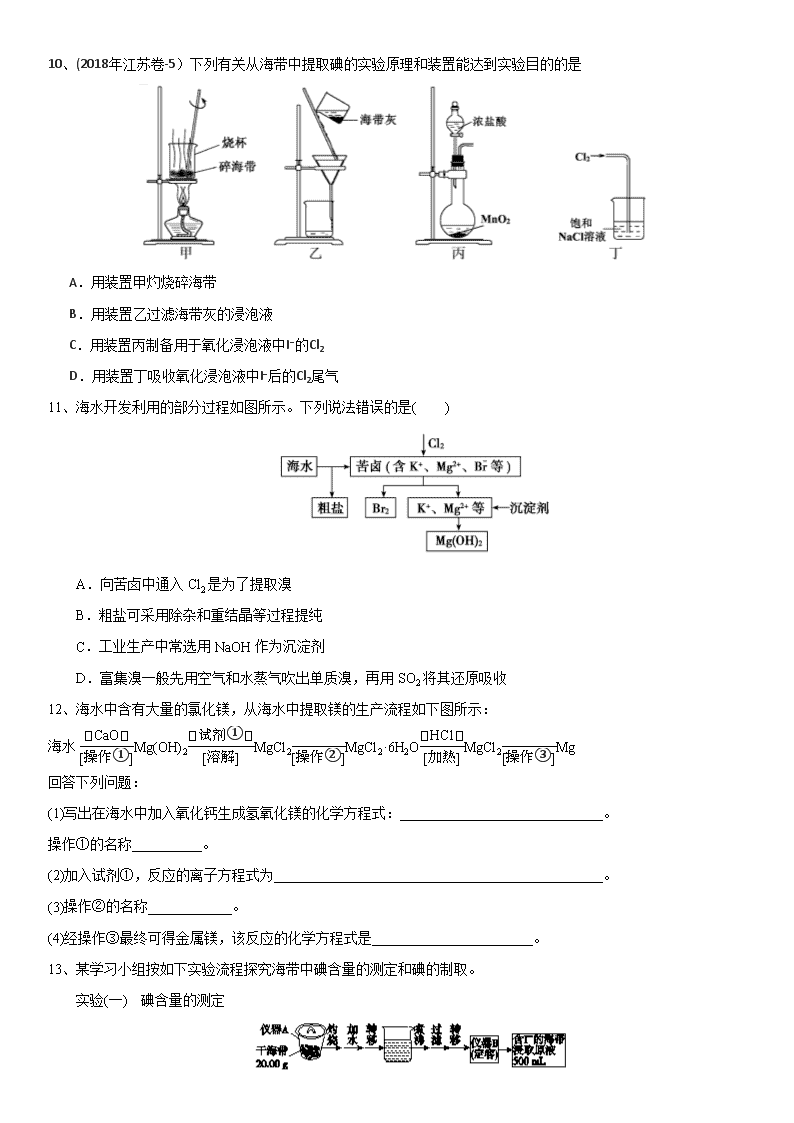
海水资源的开发利用 1、下列有关说法错误的是( ) A.新能源汽车的推广与使用,有助于减少光化学烟雾的产生 B.氯气泄漏时,可用蘸有肥皂水的湿毛巾捂住口鼻疏散到安全区域 C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈 D.地球上99%的溴元素以Br-的形式存在于海水中,溴化钠和溴化钾在医药上常用作镇静剂 2、镁及其合金是用途很广的金属材料,目前世界上60%的镁是从海水中提取的。实验室模拟海水中提取镁的主要步骤如下,下列说法错误的是( ) A.步骤Ⅰ分离物质需要的主要玻璃仪器有烧杯、漏斗、玻璃棒 B.溶液A中的阴离子主要有Cl-、SO、OH- C.试剂②应选用稀盐酸 D.步骤Ⅲ可直接加热MgCl2溶液得到MgCl2固体 3、如果实行海水淡化来供用居民饮用水,下列方法中在原理上完全不可行的是( ) A.加明矾使海水中的盐沉淀出来而淡化 B.利用太阳能使海水升温,通过蒸馏而使其淡化 C.将海水缓慢降温使盐析出以获取淡水 D.将海水通过离子交换树脂以除去杂质离子 4、NaCl是海水中提取出来的一种重要物质,除食用外,它还是一种工业原料,下列以NaCl为原料制得的产品(或物质)是( ) ①烧碱 ②纯碱 ③金属钠 ④氯气 ⑤盐酸 A.①②③④⑤ B.①②③④ C.①②③⑤ D.①②④⑤ 5、从海水中提取镁的工艺流程可表示如下: 下列说法不正确的是( ) A.用此法提取镁的优点之一是原料来源丰富 B.步骤⑥电解MgCl2时阴极产生氯气 C.步骤⑤可将晶体置于HCl气体氛围中脱水 D.上述工艺流程中涉及化合、分解和复分解反应 6、下图所示为海水综合利用的部分流程,下列有关说法错误的是( ) A.实验室进行①的操作需要用到坩埚、玻璃棒、酒精灯 B.②是一个将电能转化为化学能的过程 C.③④⑤涉及的反应均为氧化还原反应 D.④中反应的离子方程式为SO2+Br2+2H2O===4H++SO+2Br- 7、化学与生产、生活密切相关。下列说法中不正确的是( ) A.绿色化学要求从源头上减少或消除工业生产对环境的污染 B.金属在潮湿空气中生锈,主要是发生吸氧腐蚀 C.光导纤维和制作航天服的聚酯纤维都是新型无机非金属材料 D.海水提取镁、溴的过程中均涉及氧化还原反应 8、工业上制备相关物质,涉及的反应原理及部分流程较为合理的是( ) A.制取镁:海水Mg(OH)2MgOMg B.冶炼铝:铝土矿NaAlO2无水AlCl3Al C.制溴:浓缩海水Br2HBr(aq)Br2 D.制碘:海带海带灰I2(aq)I2 9、溴是海水中重要的非金属元素,地球上90%的溴元素以Br-的形式存在于海水中,所以人们称溴为“海洋元素”。下列有关说法中正确的是( ) A.从海水中提取溴时,不涉及氧化还原反应 B.苯与溴水反应生成溴苯 C.可以用CCl4萃取溴水中的溴 D.向FeBr2溶液中通入Cl2时,一定会发生如下反应: 2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl- 10、(2018年江苏卷-5)下列有关从海带中提取碘的实验原理和装置能达到实验目的的是 A.用装置甲灼烧碎海带 B.用装置乙过滤海带灰的浸泡液 C.用装置丙制备用于氧化浸泡液中I−的Cl2 D.用装置丁吸收氧化浸泡液中I−后的Cl2尾气 11、海水开发利用的部分过程如图所示。下列说法错误的是( ) A.向苦卤中通入Cl2是为了提取溴 B.粗盐可采用除杂和重结晶等过程提纯 C.工业生产中常选用NaOH作为沉淀剂 D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 12、海水中含有大量的氯化镁,从海水中提取镁的生产流程如下图所示: 海水Mg(OH)2MgCl2MgCl2·6H2OMgCl2Mg 回答下列问题: (1)写出在海水中加入氧化钙生成氢氧化镁的化学方程式:_____________________________。 操作①的名称__________。 (2)加入试剂①,反应的离子方程式为_______________________________________________。 (3)操作②的名称____________。 (4)经操作③最终可得金属镁,该反应的化学方程式是_______________________。 13、某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。 实验(一) 碘含量的测定 取0.010 0 mol·L-1的AgNO3标准溶液装入滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中c(I-)的变化,部分数据如下表示: 实验(二) 碘的制取 已知:3I2+6NaOH===5NaI+NaIO3+3H2O。 请回答 (1)实验(一)中的仪器名称: 仪器A__________,仪器B__________。 (2)①根据表中数据绘制滴定曲线: ②该次滴定终点时用去AgNO3溶液的体积为______ mL,计算得海带中碘的百分含量为______%。 (3)①分液漏斗使用前须检漏,检漏方法为___________________。 ②步骤X中,萃取后分液漏斗内观察到的现象是____________。 ③下列有关步骤Y的说法,正确的是________(填选项字母)。 A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层 C.主要是除去海带浸取原液中的有机杂质 D.NaOH溶液可以由乙醇代替 ④实验(二)中操作Z的名称是__________。 (4)方案甲中采用蒸馏不合理,理由是_________________。 答案 1、【答案】C 2、【答案】D 3、【答案】A 4、【答案】A 5、【答案】B 6、【答案】A 7、【答案】C 8、【答案】C 9、【答案】C 10、【答案】B 11、【答案】C 12、【答案】(1)CaO+H2O+MgCl2===CaCl2+Mg(OH)2↓ 过滤 (2)Mg(OH)2+2H+===Mg2++2H2O (3)蒸发结晶 (4)MgCl2Mg+Cl2↑ 13、【答案】(1)坩埚 500 mL容量瓶 (2)① ②20.00 0.635 (3)①向分液漏斗中加入少量水,检查旋塞处是否漏水;将漏斗倒转过来,检查玻璃塞是否漏水 ②液体分上下两层,下层呈紫红色 ③AB ④过滤 (4)主要由于碘易升华,会导致碘的损失查看更多