- 2021-07-08 发布 |
- 37.5 KB |
- 70页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学高考一轮复习课件:第3章 第2讲 钠的其他常见化合物 碱金属元素
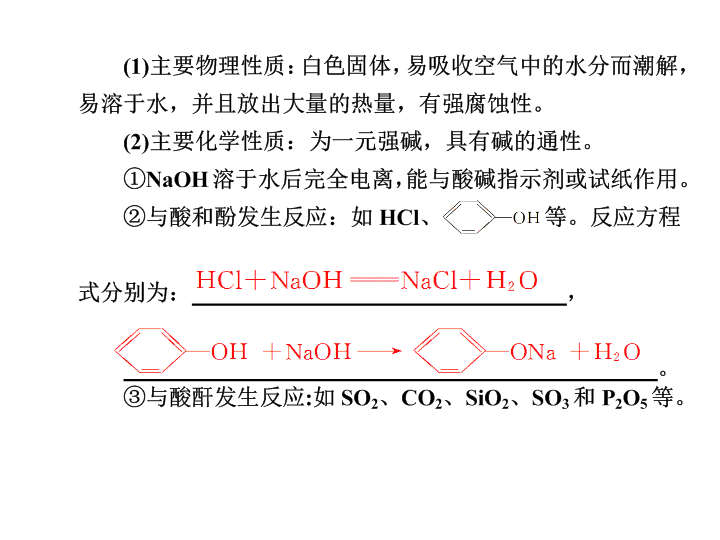
烧碱、火碱、苛性钠 第三章 常见的金属及其化合物 2Al+2NaOH+2H2O===2NaAlO2+3H2↑。 NH4Cl+NaOH NaCl+H2O+NH3↑。 名称(化 学式) 碳酸钠(Na2CO3) 碳酸氢钠 (NaHCO3) 俗名 主 要 性 质 色态 白色晶体 细小白色晶体 水溶 性 易溶于水, 溶液呈碱性 易溶于水(但比 同温下Na2CO3溶 解度小),溶液 呈碱性 稳定 性 不稳定,受热易 分解 纯碱或苏打 小苏打 稳定,但结晶碳酸钠 (Na2CO3·10H2O) 易风化 硫 酸 铝 主 要 性 质 与H+反应 CO +2H+ H2O+CO2↑ HCO +H+ H2O +CO2↑ 与OH-不反应, 但Ca2++CO CaCO3↓ Ca2++OH-+HCO CaCO3↓+H2O(碱过量) Ca2++2OH-+2HCO CaCO3↓+CO +2H2O (碱不足) 盐 CaCl2 Ca2++CO CaCO3↓↓ 2Al3++3CO + 3H2O 2Al(OH)3↓+ 3CO2↑ 3HCO +Al3+ Al(OH)3↓+3CO2↑ 不反应 与碱反应 [Ca(OH)2] 主要用途 玻璃、造纸、 制皂、洗涤 发酵、医药、灭火器 相互转化 提示 以NaOH溶液为代表的碱性溶 液中的OH-可与磨口玻璃塞中裸露 的SiO2反应,生成Na2SiO3,使瓶 塞和瓶体粘连在一起不易打开。 提示 溶液中将析出白色晶体(沉淀)。原因 是:发生Na2CO3+CO2+ H2O===2NaHCO3↓,①同温下,NaHCO3 的溶解度比Na2CO3小,②生成的NaHCO3 的质量比消耗的Na2CO3的大(即106 g Na2CO3生成168 g NaHCO3),即溶质增加, ③反应消耗了水,即溶剂减少,因此出现沉 淀,主要原因是①。 1 依次增多 依次增大 银白 小 较小 较低 +1 碱 减小 增强 增强 剧烈 增强 物理 黄色 蓝色钴玻璃 黄绿 答案 C 答案 B 答案 D 答案 B 。 答案 D 答案 A 答案 A 答案 C × √ 。 Na+H2O—Na++OH-+H2 HCO-+2OH-==CO2 +2H2O3 Na2CO3+H2SO4== Na2SO4+H2O Na2O2 1:1 H2O2 Ⅰ、Ⅳ、Ⅴ 2Na2CO3+Cl2+H2O==NaClO+2NaHCO3+NaCl 3 2- 3 2- 2 -2 2- 2查看更多