- 2021-07-08 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版定量实验设计与评价作业
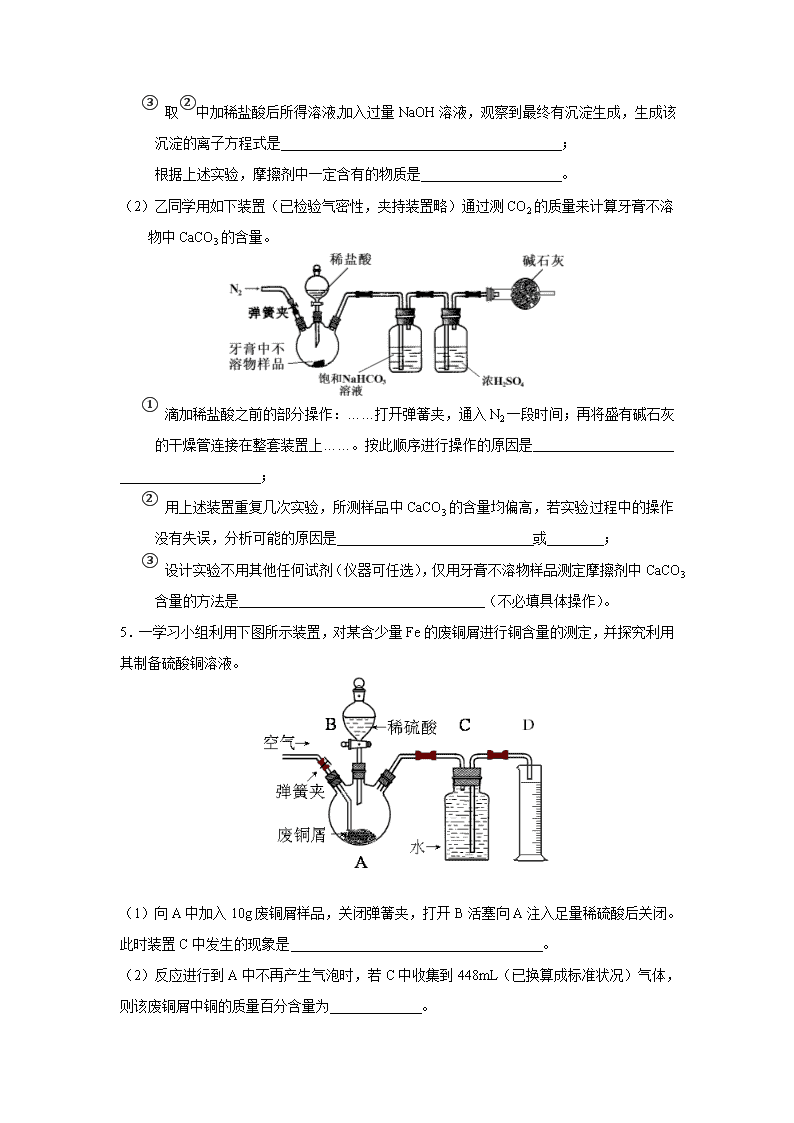
定量实验设计与评价 1.BaCl2·xH2O中结晶水数目可通过重量法来确定: ①称取1.222g样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀完全,静置; ②过滤并洗涤沉淀; ③将盛有沉淀的滤纸包烘干并中温灼烧;转入高温炉中,反复灼烧到恒重,称得沉淀质量为1.165g。 回答下列问题: (1)在操作②中,需要先后用稀硫酸和 洗涤沉淀;检验沉淀中氯离子是否洗净的方法是 。 (2)计算BaCl2·xH2O中的x= (要求写出计算过程)。 (3)操作③中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,这使x的测定结果 (填“偏低”、“偏高”或“不变”)。 2.某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。 请回答下列问题。 (1)仪器中装入的试剂:B_________ 、C________、D___________; (2)连接好装置后应首先_________________________,其方法是________________ (3)“加热反应管E”和“从A瓶逐滴滴加液体”这两步操作应该先进行的是 _______________。在这两步之间还应进行的操作是____________________________; (4)反应过程中G管逸出的气体是________________,其处理方法是__________ (5)从实验中测得了下列数据 ①空E管的质量a ;②E管和WO3的总质量b ;③反应后E管和W粉的总质量c(冷却到室温称量);④反应前F管及内盛物的总质量d ;⑤反应后F管及内盛物的总质量e 由以上数据可以列出计算W的相对原子质量的两个不同计算式(除W外,其他涉及的元素的相对原子质量均为已知): 计算式1:Ar(W)=____________;计算式2:Ar(W)=____________。 3.某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。 ⑴m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是 ①常温下碳与浓硫酸不反应;② 。 ⑵写出加热时A中碳与浓硫酸发生反应的化学方程式 。 ⑶B中的现象是: ;C的作用是: 。 ⑷待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为 (写表达式)。 ⑸甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因: 。 ⑹最后对所得测量结果进行评价,小组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低是(任答一条即可) 。 4.牙膏是由摩擦剂和一些可溶于水的物质组成。常用的摩擦剂主要有:CaCO3、Al(OH)3、SiO2·nH2O、Ca3(PO4)2。资料显示:Ca3(PO4)2高温不分解;Ca3(PO4)2和CaHPO4不溶于水;Ca(H2PO4)2溶于水;Ca3(PO4)2 + 4H+ = 3Ca2+ + 2H2PO4-。 (1)为测定某牙膏的酸碱性和摩擦剂的主要成分,甲同学设计并完成以下实验: ① 取一小段牙膏与一定量蒸馏水充分搅拌后过滤,用pH试纸测定滤液酸碱性的方法是 (填相应操作),读出其pH接近8; ② 若向①所得不溶物中加入适量稀盐酸,得到澄清溶液,有气体产生,则产生气体的离子方程式是 ;若向①所得不溶物中加入NaOH溶液,经测定,不溶物的质量不发生变化; ③ 取②中加稀盐酸后所得溶液,加入过量NaOH溶液,观察到最终有沉淀生成,生成该沉淀的离子方程式是 ; 根据上述实验,摩擦剂中一定含有的物质是 。 (2)乙同学用如下装置(已检验气密性,夹持装置略)通过测CO2的质量来计算牙膏不溶物中CaCO3的含量。 ① 滴加稀盐酸之前的部分操作:……打开弹簧夹,通入N2一段时间;再将盛有碱石灰的干燥管连接在整套装置上……。按此顺序进行操作的原因是 ; ② 用上述装置重复几次实验,所测样品中CaCO3的含量均偏高,若实验过程中的操作没有失误,分析可能的原因是 或 ; ③ 设计实验不用其他任何试剂(仪器可任选),仅用牙膏不溶物样品测定摩擦剂中CaCO3含量的方法是 (不必填具体操作)。 5.一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液。 (1)向A中加入10g废铜屑样品,关闭弹簧夹,打开B活塞向A注入足量稀硫酸后关闭。此时装置C中发生的现象是 。 (2)反应进行到A中不再产生气泡时,若C中收集到448mL(已换算成标准状况)气体,则该废铜屑中铜的质量百分含量为 。 (3)拆除C、D装置后,打开弹簧夹,持续将空气通入A中,至A中固体全部消失,再继续通入一段时间空气后,关闭弹簧夹,停止通入空气。 ①该过程中发生反应的离子方程式是 、 ; ②为使A中固体加快溶解速率,以下方法运用合理的是 。 a. 对A装置加热 b. 向A内加入少量Fe2O3 c. 向A内加入少量CuO d. 增大空气通入量 e. 向A内加入少量FeSO4 f. 向A内加入少量H2O (4)将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液,此过程离子反应方程式是 。 (5)有同学认为,可以不用测量气体法计算废铜屑中铜的质量百分含量,则其采用的方法是 ,其具体操作步骤可续写为: 。 6.氯化铁是实验室中的重要试剂。某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3·6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如下装置(夹持装置略,气密性已检验): 操作步骤如下: Ⅰ. 打开弹簧夹K1、关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。 Ⅱ. 当……时,关闭弹簧夹K1、打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。 Ⅲ. 将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeCl3·6H2O晶体。 请回答: (1)A中发生的置换反应的化学方程式是 。 (2)操作Ⅱ中“……”的内容是 ,烧杯中的现象是 ,相应的离子方程式和化学方程式是 、 。 (3)操作Ⅲ不采用直接加热制FeCl3·6H2O晶体的原因是 (用简要文字并结合离子方程式解释)。 (4)测得B中所得的气体是V mL(标准状况时),由此计算出该废铁屑中铁的质量分数是 ,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是 。 (5)为了准确测定铁的质量分数,还可以另取mg废铁屑和某种常见的还原剂气体在加热时充分反应到恒重,测得实验后剩余固体质量是wg。由此求出铁的准确质量分数是 (用含m、和w的式子表示)。 7.实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数。回答以下问题: ⑴ 化学小组主要选用了下列药品和仪器进行实验。(图中每种仪器装置只选用了一次,铁 架台等固定仪器未画出) 请按气流由左向右的方向,仪器连接顺序是(填仪器的接口字母a、b...) a→ → → → → f →g → → 。 ⑵ 实验开始,混合物加酸前,A装置需要鼓入空气,作用是 ;加酸后A装置再次鼓入空气的作用是 。 ⑶ E装置的作用是 。 ⑷ 实验中,若C瓶中溶液褪色,则测定结果可能会偏 (填“高”或“低”)。为了确 保实验中C瓶溶液不褪色,若取样品的质量为m g,实验前 E中所装 a mol·L-1的KMnO4 溶液体积(V)不少于 mL。 ⑸ 若混合物样品质量为13.1 g,充分作用后碱石灰增重4.4 g,则混合物中NH4HCO3的质 量分数为 。 ⑹ 从定量测定的准确性考虑,该套装置还应作进一步的改进是 。 可能用到的相对原子质量:H~1 C~12 N~14 O~16 Na~23 S~32 8.某研究性小组借助A~D的仪器装置完成有关实验。 【实验一】收集NO气体。 (1)用装置A收集NO气体,正确的操作是 (填序号)。 a.从①口进气,用排水法集气 b.从①口进气,用排气法集气 c.从②口进气,用排水法集气 d..从②口进气,用排气法集气 【实验二】为了探究镀锌薄铁板上的锌的质量分数w(Zn)和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO2+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。 方案甲:通过测量试样与碱反应生成的氢气体积来实现探究目标。 (2)选用B和 (填仪器标号)两个装置进行实验。 (3测得充分反应后生成氢气的体积为VL(标准状况),w(Zn)= 。 (4)计算镀层厚度,还需要检索的一个物理量是 。 (5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将 (填“偏大”、“偏小”或“无影响”)。 方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g 。 (6)w(Zn)= 。 方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。 (7)从实验误差角度分析,方案丙 方案乙(填“优于”、“劣于”或“等同于”)。 9.某小组同学将一定浓度Na2CO3溶液滴入CuSO4 溶液中发现生成了蓝色沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。 已知:CuCO3和Cu(OH)2均为蓝色,难溶于水。 (1)按照甲同学的观点,发生的反应属于4种基本反应类型中的 。 空气 NaOH溶液 K1 K2 稀硫酸 浓硫酸 A B C D 碱石灰 碱石灰 E 样品 K3 K4 (2)乙同学利用下图装置进行测定。 ①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为 、洗涤、干燥。 ②装置E中碱石灰的作用是 。 ③实验过程中有以下操作步骤: a.关闭K1、K3,打开K2、K4,充分反应 b.打开K1、K4,关闭K2、K3,通入过量空气 c.打开K1、K3,关闭K2、K4,通入过量空气 正确的顺序是(填选项序号,下同) 。 若未进行步骤 ,将使测量结果偏低。 ④若沉淀样品的质量为m g,装置D的质量增加了n g,则沉淀中CuCO3的质量分数为 。 (3)丙同学认为还可以通过测量CO2的体积或测量 来测定沉淀中CuCO3的质量分数。 10.某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。 实验一 制取氯酸钾和氯水 利用如图所示的实验装置进行实验。 (1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有______。 (2)若对调B和C装置的位置,_____(填“能”或“不能”)提高B中氯酸钾的产率。 实验二 氯酸钾与碘化钾反应的探究 (3)在不同条件下KClO3可将KI氧化为I2或KIO3 。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行): ①系列a实验的实验目的是_______。 ②设计1号试管实验的作用是___________。 ③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为_________________。 实验三 测定饱和氯水中氯元素的总量 (4)该小组设计的实验方案为:使用右图装置,加热15.0mL饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是_______。(不考虑实验装置及操作失误导致不可行的原因) (5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):______ 资料:i.次氯酸会破坏酸碱指示剂; ii.次氯酸或氯水可被SO2、H2O2、FeCl2等物质还原成Cl-。 11.某食盐样品中混有NaBr杂质,为了测定该食盐样品的纯度,可设计实验过程如图1所示: 阅读上述实验过程,完成下列填空: (1)请你从图2中选用四个装置(可重复使用)来完成向溶液A中通入过量Cl2的实验,将所选装置的选项字母填入方框,并在括号中写出装置内所放的化学药品; A B C D 图2 ( ) (饱和食盐水) (溶液 A ) ( ) C (2)为了证明溶液D中几乎不存在Br—,可选用的试剂为(多选不给分) (填选项字母); A. 碘水 B. 淀粉碘化钾溶液 C. 新制氯水 D. 食盐水 (3)依据图所示,在萃取操作中应选取的有机溶剂为(多选不给分) ; A.四氯化碳 B.甲苯 C.乙醇 D.裂化汽油 (4)在萃取、分液的过程中,把分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔,其目的是 ; 如图所示,待分液漏斗内的混合液分层后,应采取的操作是 ; (5)加热蒸发溶液D时,除需带有铁圈的铁架台、坩埚钳和火柴外,还必须用到的仪器有 、 、 ; (6)试计算原固体混合物中氯化钠的质量分数为 。 12.二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。回答下列问题: (1)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为 。 (2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2: ①电解时发生反应的化学方程式为 。 ②溶液X中大量存在的阴离子有 。 ③除去ClO2中的NH3可选用的试剂是 (填标号)。 a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水 (3)用下图装置可以测定混合气中ClO2的含量: Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入3 mL稀硫酸; Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口; Ⅲ.将一定量的混合气体通过锥形瓶中吸收; Ⅳ.将玻璃液封装置中的水倒入锥形瓶中; Ⅴ.用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32―==2I―+S4O62―),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中: ①锥形瓶内ClO2与碘化钾反应的离子方程式为 。 ②玻璃液封装置的作用是 。 ③Ⅴ中加入的指示剂通常为 ,滴定至终点的现象是 。 ④测得混合气中ClO2的质量为 g。 (4)用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是 (填标号)。 a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁 【答案与解析】 1.(1)蒸馏水 取水洗液于试管中,加入稀硝酸酸化,滴加AgNO3溶液,若无白色浑浊出现,则表明Cl-已经冼净。 (2)样品中BaCl2的物质的量为: BaCl2的质量: 结晶水与氯化钡的物质的量之比为: (3)偏高 2.(1)锌粒, 水,浓硫酸;(2)检查气密性,将G弯管浸没在盛有水的烧杯中,温热烧瓶B,观察G管口,若有气泡逸出,说明装置的气密性良好;(3)先从A瓶逐滴滴加液体; 检验H2的纯度 (4)氢气;在G管出口处点燃; (5) 【解析】①联想课本改进后的综合实验:氯气与铁反应的性质实验装置: 制备氯气、净化氯气(饱和食盐水除氯化氢、浓硫酸除水蒸气)、性质实验装置、产物检验装置、尾气处理装置有助于本实验的解题。②联想氢气还原氧化铜实验:制备氢气、净化氢气、氢气验纯、通入氢气与点燃酒精灯顺序、熄灭酒精灯与停止同氢气的顺序、氢气的尾气处理方式可以直接用于回答本题。 实验题关键:①明确实验目的和原理,②清楚各装置的作用,③排除实验干扰。 3.⑴ 常温下Fe遇浓硫酸发生钝化 ⑵ C + 2H2SO4(浓) CO2↑ + 2SO2↑ + 2H2O ⑶ 品红溶液褪色(或“颜色变浅”) 除尽反应产物中的SO2气体 ⑷ (11m-3b)/11m ⑸ 装置内的CO2难以赶尽,导致E质量增重偏小 ⑹ SO2不一定能全部被品红、KMnO4除去或E中碱石灰会吸收空气中的CO2、H2O(其它合理的也对) 4. (1)① 用干燥洁净的玻璃棒蘸滤液,滴在pH试纸上,经与标准比色卡比较后。 ② CaCO3 + 2H+ = Ca2+ + CO2↑+ H2O ③ 2H2PO4- + 3Ca2+ + 4OH- = Ca3(PO4)2 + 4H2O CaCO3 Ca3(PO4)2 (2)① 避免碱石灰吸收装置中原有空气中的CO2 ② 干燥管中的碱石灰吸收空气中的CO2或H2O NaHCO3溶液除HCl时产生了CO2 ③ 称量不溶物样品在高温下完全分解前后的质量 5.(1)水面下降,水顺长导管排入D中 (2)88.8% (3)①4Fe2+ + O2 + 4H+ = 4Fe3+ +2H2O 2Fe3+ + Cu = 2Fe2+ + Cu2+ ②a b d e (4)Cu2(OH)2CO3 + H+ + Fe3+ = 2Cu2+ + Fe(OH)3↓ + CO2↑ (5)测定沉淀法,将(4)中所得红褐色沉淀洗涤、干燥、称量、计算 6.(1)Fe+2HCl=FeCl2+H2↑ (2)当A中固体完全消失;无色溶液逐渐变黄,有气泡产生。 2Fe2++H2O2+2H+=2Fe3++2H2O、 2H2O22H2O+O2↑ (3)Fe3++3H2OFe(OH)3+3H+,加热会促进FeCl3水解,产生Fe(OH)3。 (4)Fe3+和Fe发生反应消耗部分Fe,使与盐酸反应的Fe相应减少。 (5) 7.⑴ a→i→h→d→e→f→g→b→c ⑵ 排出装置中原有空气,将生成的气体全部送入后续装置(答使反应产生的CO2 和SO2能被完全吸收也给分 ) ⑶ 除去SO2,以防止SO2对测定结果的影响 ⑷ 高 50m/(13a) ⑸ 60.3% ⑹ 在B之后再接一个阻止空气中水和二氧化碳进入B的装置 8. (1)C (2)D (3)(或等其他合理答案:) (4)金属锌的密度(或其他合理答案:) (5)偏大 (6)(或其他合理答案:) (7)劣于 【解析】本题考查实验的探究,涉及NO气体的收集,混合物中金属含量的计算等。(1)NO遇空气立即被氧化,故不能用排空气法收集,只能用排水法收集。排水时应用短进长出。(2)方案甲:Zn和Fe中只有Zn可以与NaOH产生气体,通过排水收集气体,依据反应方程式即可算出Zn的质量分数。所以需要的装置有测H2的体积的D装置。(3)Zn与H2 之间量为1:1,则n(Zn)=V/22.4 mol,w (Zn)=m(Zn)/m1 = 。(4)有了Zn的质量,如果有密度,则可以求出Zn的体积,再由Zn的截面积,即可求出Zn的高度(厚度)。(5)恒压式分液漏斗产生的气体有部分残留在分液漏斗上方,故排气时收集少了,所以用普通漏斗时收集的H2多一些,则计算出的Zn的量偏大。(6)减少的质量即为Zn的质量。(7)丙方案根据H2的质量差值,显然误差大,因为产生的H2质量很小,计算偏差大。 9.(1)复分解反应 (2)①过滤 ②防止空气中CO2和水蒸气进入装置D ③cab ;b ④ (3)样品质量和样品充分灼烧后的质量(其他合理答案可给分) 10.(1)烧杯、漏斗、玻璃棒、胶头滴管(不填“胶头滴管”也可); (2)能; (3)①研究反应体系中硫酸浓度对反应产物的影响; ②硫酸浓度为0的对照实验; ③ClO3-+6I-+6H+=Cl-+3I2+3H2O (4)因存在Cl2的重新溶解、HClO分解等,此方案无法测算试样含氯总量(或其他合理答案)。 (5)量取一定量的试样,加入足量的H2O2溶液,加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,称量沉淀质量(或其他合理答案)。 【解析】(1)制取实验结束后,取出B中试管冷却结晶、过滤、洗涤。根据进行该实验操作过程使用的仪器可知:在该实验操作过程需要的玻璃仪器有烧杯、漏斗、玻璃棒、胶头滴管; (2)Cl2与热的KOH溶液发生反应产生氯酸钾和氯化钾及水,与冷的KOH发生反应产生的在KCl、KClO和水。因此若对调B和C装置的位置,可以除去Cl2中的杂质HCl气体,故能提高B中氯酸钾的产率。 (3)①根据表格数据可知:KI、KClO3的物质的量不变,改变的只有硫酸的体积和水的多少,二者的和相等,可见研究的目的就是研究反应体系中硫酸浓度对反应产物的影响;②设计1号试管实验的作用是硫酸溶液没有加入,即硫酸的浓度是0,可以进行对照实验,比较硫酸不同浓度的影响。③ 若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色,证明产生了I2;假设氧化产物唯一,还原产物为KCl,根据氧化还原反应中电子守恒、电荷守恒及原子守恒,可得该反应的离子方程式为: ClO3-+6I-+6H+=Cl-+3I2+3H2O。 (4)该小组设计的实验方案为:使用右图装置,加热15.0mL饱和氯水试样,测定产生气体的体积。此方案不可行,主要原因是在溶液中存在Cl2的重新溶解及HClO分解产生HCl和氧气等。 (5)由于次氯酸会破坏酸碱指示剂,因此实验设计时不用酸碱指示剂,可以利用氯水的强氧化性,向该溶液中加入足量的足量的H2O2溶液,发生氧化还原反应产生Cl-,H2O2被氧化变为O2,然后加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,发生沉淀反应形成AgCl沉淀,称量沉淀质量可根据物质的元素组成确定其中含有的氯元素的质量。 (MnO2和浓HCl) (饱和食盐水) (溶液A) (NaOH溶液) (1) 11. A C C C (2)C (3)B (4)使漏斗内外空气相通,以保证漏斗里的液体能够流出 打开活塞,使下层液体慢慢流出。注意不要使上层液体流出。上层液体从分液漏斗上口倒出 (5)蒸发皿、酒精灯、玻璃棒 (6)90.0% 12.(1)2∶1 (2)①NH4Cl+2HCl3H2↑+NCl3 ②Cl-、OH- ③C (3)①2ClO2+10I-+8H+==2Cl-+5I2+4H2O ②吸收残余的二氧化氯气体(避免碘的逸出) ③淀粉溶液;溶液由蓝色变为无色,且半分钟内溶液颜色不再改变 ④0.02700 (4)d 【解析】(1)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2 ,在反应中氯元素的化合价从+5价降低到+4价,得到1个电子,氯酸钾是氧化剂。S元素的化合价从+4价升高到+6价,失去2个电子,亚硫酸钠是还原剂,则根据电子得失守恒可知该反应氧化剂与还原剂物质的量之比为2∶1。 (2)①根据流程图可知电解时生成氢气和NCl3,则电解时发生反应的化学方程式为NH4Cl+2HCl3H2↑+NCl3。 ②反应中有氨气生成,所以存在氢氧根离子。根据氯离子守恒可知,溶液中还应该存在大量的氯离子。 ③ClO2易溶于水,能与碱反应,所以除去ClO2中的NH3可选用的试剂是浓硫酸,答案选C。 (3)①ClO2具有强氧化性,则锥形瓶内ClO2与碘化钾反应的离子方程式为2ClO2+10I―+8H+==2Cl―+5I2+4H2O。 ②由于二氧化氯是气体,容易挥发到空气中,所以玻璃液封装置的作用是吸收残余的二氧化氯气体。 ③由于碘遇淀粉显蓝色,则V中加入的指示剂通常为淀粉,滴定至终点的现象是溶液由蓝色变为无色且半分钟内不变色。 ④根据方程式可知2ClO2~5I2~10S2O32-,则测得混合气体中ClO2的质量为: 0.1 mol / L×0.02 L×67.5 g / mol / 5=0.02700 g。 (4)亚氯酸盐具有氧化性,因此若要除去超标的亚氯酸盐,最适宜的是硫酸亚铁,因为氧化物铁离子能净水。查看更多