- 2021-07-08 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】四川省泸县第四中学2020届高三三诊模拟考试理综
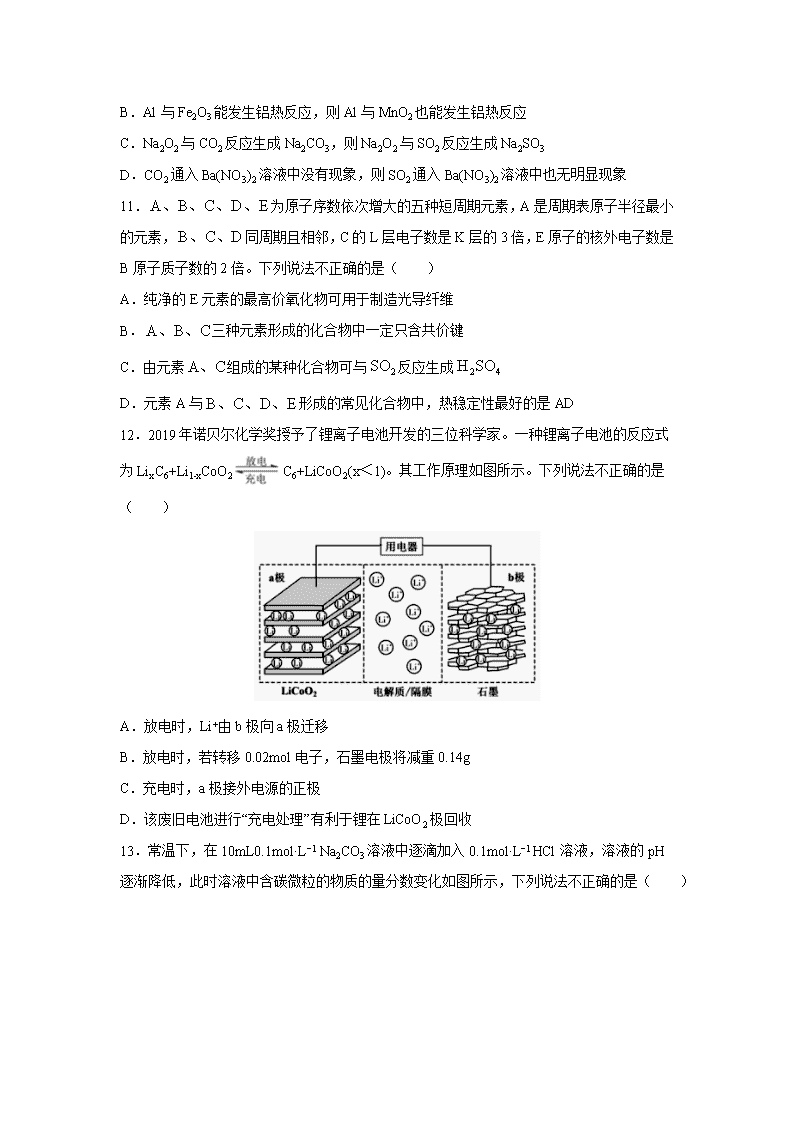
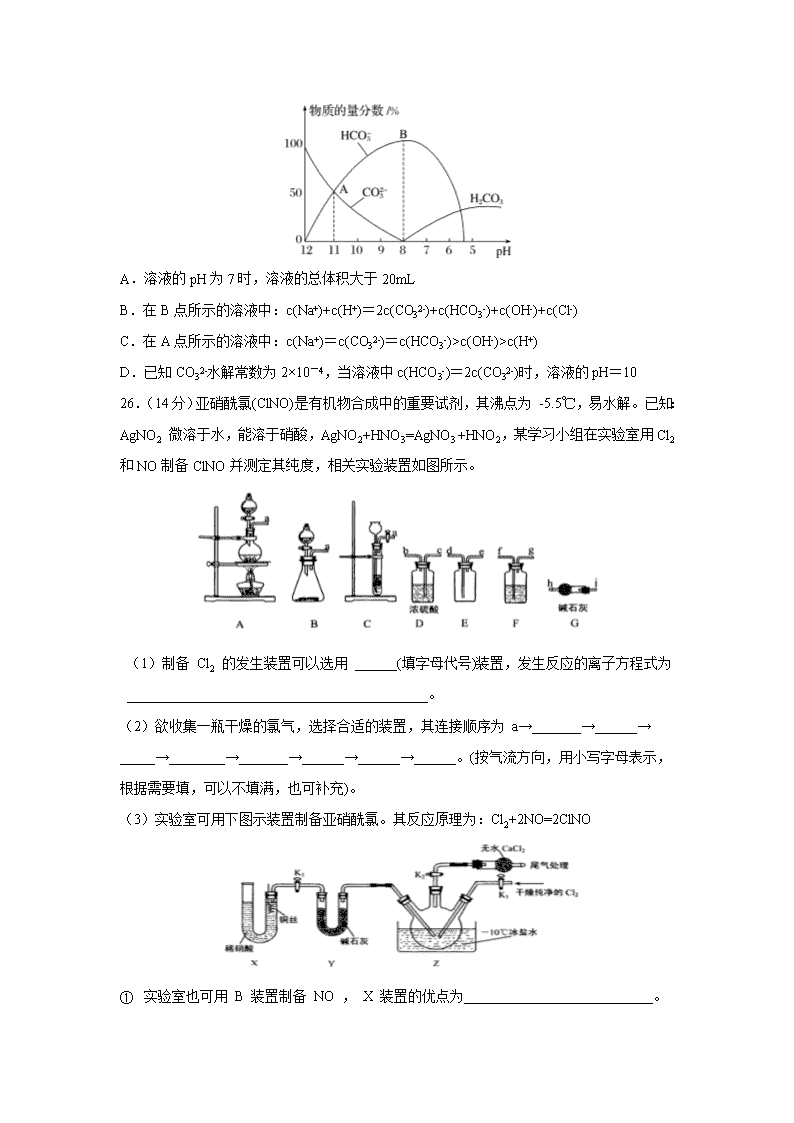
四川省泸县第四中学2020届高三三诊模拟考试理综 7.新型冠状病毒是一种致病性很强的 RNA 病毒,下列说法错误的是( ) A.新型冠状病毒组成元素中含有 C、H、O B.用“84 消毒液”进行消毒时,消毒液越浓越好 C.3M 防颗粒物口罩均使用 3M 专有高效过滤材料——聚丙烯材质,聚丙烯属于高分子 D.不去人群聚集处、勤洗手可预防新型冠状病毒 8.设 NA 为阿伏加德罗常数的数值,下列说法正确的是( ) A.22.4 L 乙烷中所含的极性共价键数目为 7NA B.某温度下,将 1molCl2 通入足量水中转移电子数为 NA C.常温常压下,3.0 g 含葡萄糖的冰醋酸中含有的原子总数为 0.4NA D.室温下,1LpH 为 13 的 NaOH 溶液和 Ba(OH)2 混合溶液中含 OH-个数为 0.01NA 9.下列有关实验现象和解释或结论都一定正确的是( ) 选项 实验操作 实验现象 解释或结论 A 某钾盐溶于盐酸后,产生无色无味气体,将其通入澄清石灰水 有白色沉淀出现 该钾盐是 B 将少量的溴水分别滴入溶液、溶液中,再分别滴加振荡 下层分别呈无色和紫红色 还原性: C 将充满的密闭玻璃球浸泡在热水中 红棕色变深 反应的 D 将受热分解产生的气体通入某溶液 溶液变浑浊,继续通入该气体,浑浊消失 该溶液是溶液 10.类推法是常见的研究物质性质的方法之一,可用来预测很多物质的性质,但类推是相对的,必须遵循客观实际,下列说法中正确的是( ) A.Cu与Cl2反应生成CuCl2,则Cu与S反应生成CuS B.Al与Fe2O3能发生铝热反应,则Al与MnO2也能发生铝热反应 C.Na2O2与CO2反应生成Na2CO3,则Na2O2与SO2反应生成Na2SO3 D.CO2通入Ba(NO3)2溶液中没有现象,则SO2通入Ba(NO3)2溶液中也无明显现象 11.为原子序数依次增大的五种短周期元素,A是周期表原子半径最小的元素,同周期且相邻,C的L层电子数是K层的3倍,E原子的核外电子数是B原子质子数的2倍。下列说法不正确的是( ) A.纯净的E元素的最高价氧化物可用于制造光导纤维 B.三种元素形成的化合物中一定只含共价键 C.由元素组成的某种化合物可与反应生成 D.元素A与形成的常见化合物中,热稳定性最好的是AD 12.2019年诺贝尔化学奖授予了锂离子电池开发的三位科学家。一种锂离子电池的反应式为LixC6+Li1-xCoO2C6+LiCoO2(x<1)。其工作原理如图所示。下列说法不正确的是( ) A.放电时,Li+由b极向a极迁移 B.放电时,若转移0.02mol电子,石墨电极将减重0.14g C.充电时,a极接外电源的正极 D.该废旧电池进行“充电处理”有利于锂在LiCoO2极回收 13.常温下,在10mL0.1mol·L−1 Na2CO3溶液中逐滴加入0.1mol·L−1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示,下列说法不正确的是( ) A.溶液的pH为7时,溶液的总体积大于20mL B.在B点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-) C.在A点所示的溶液中:c(Na+)=c(CO32-)=c(HCO3-)>c(OH-)>c(H+) D.已知CO32-水解常数为2×10-4,当溶液中c(HCO3-)=2c(CO32-)时,溶液的pH=10 26.(14分)亚硝酰氯(ClNO)是有机物合成中的重要试剂,其沸点为 -5.5℃,易水解。已知:AgNO2 微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3 +HNO2,某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验装置如图所示。 (1)制备 Cl2 的发生装置可以选用 ______(填字母代号)装置,发生反应的离子方程式为___________________________________________。 (2)欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为 a→_______→______→ _____→________→_______→______→______→______。(按气流方向,用小写字母表示,根据需要填,可以不填满,也可补充)。 (3)实验室可用下图示装置制备亚硝酰氯。其反应原理为:Cl2+2NO=2ClNO ① 实验室也可用 B 装置制备 NO , X 装置的优点为___________________________。 ②检验装置气密性并装入药品,打开 K2,然后再打开 K3,通入一段时间气体,其目的是 ________________________,然后进行其他操作,当 Z 中有一定量液体生成时,停止实验。 (4)已知:ClNO 与 H2O 反应生成 HNO2 和 HCl。 ①设计实验证明 HNO2 是弱酸:_______________________________________________ ___________________________________________________________。(仅提供的试剂:1 mol•L-1 盐酸、 1 mol•L-1HNO2 溶液、 NaNO2 溶液、红色石蕊试纸、蓝色石蕊试纸)。 ②通过以下实验测定ClNO 样品的纯度。取 Z 中所得液体m g 溶于水,配制成 250 mL 溶液;取出 25.00 mL 样品溶于锥形瓶中,以 K2CrO4 溶液为指示剂,用 c mol•L-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 20.00mL。滴定终点的现象是_____亚硝酰氯(ClNO)的质量分数为 _________。(已知: Ag2CrO4 为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12) 27.(14分)某校学习小组的同学设计实验,制备(NH4)2Fe(SO4)2•6H2O并探究其分解规律。实验步骤如下: Ⅰ.称取7.0g工业废铁粉放入烧杯中,先用热的Na2CO3溶液洗涤,再水洗,最后干燥。 Ⅱ.称取6.0g上述处理后的铁粉加入25mL某浓度硫酸中加热,加热过程中不断补充蒸馏水,至反应充分。 Ⅲ.冷却、过滤并洗涤过量的铁粉,干燥后称量铁粉的质量。 Ⅳ.向步骤Ⅲ的滤液中加入适量(NH4)2SO4晶体,搅拌至晶体完全溶解,经一系列操作得干燥纯净的(NH4)2Fe(SO4)2•6H2O。 V.将(NH4)2Fe(SO4)2•6H2O脱水得(NH4)2Fe(SO4)2,并进行热分解实验。 已知在不同温度下FeSO4•7H2O的溶解度如表: 温度(℃) 1 10 30 50 溶解度(g) 14.0 17.0 25.0 33.0 回答下列问题: (1)步骤Ⅰ用热的Na2CO3溶液洗涤工业废铁粉的目的是___________________________,步骤Ⅱ中设计铁粉过量,是为了___________________________,加热反应过程中需不断补充蒸馏水的目的是________________________________。 (2)步骤Ⅲ中称量反应后剩余铁粉的质量,是为了________________________________。 (3)(NH4)2Fe(SO4)2分解的气态产物可能有N2、NH3、SO2、SO3及水蒸气,用下列装置检验部分产物。 ①检验气态产物中的SO2和SO3时,装置连接顺序依次为______________________(气流从左至右);C中盛放的试剂为_________________。 ②装置A的作用是_____________________________________。 ③检验充分分解并冷却后的瓷舟中铁的氧化物中是否含有二价铁,需用到的试剂为_______。 28.(15分)还原法处理氮的氧化物是环境科学研究的热点课题。 I.氧气还原法。H2还原NO发生的反应为:2NO(g)+2H2(g)N2(g)+2H2O(g)。 (1)已知儿种化学键的键能数据如下: 2NO(g)+2H2(g)N2(g)+2H2O(g) ΔH=________kJ·mol-1。 (2)2NO(g)+2H2(g)N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行: 反应1:2NO(g)+H2(g)N2(g)+H2O2(g); 反应2:H2O2(g)+H2(g)2H2O(g)。 总反应速率由反应较慢的一步决定,由此推知上述两步反应中,活化能较大的是反应___(填“l”或“2”)。c(NO)对总反应速率的影响程度________c(H2)(填“大于”“小于”或“等于”)。 Ⅱ.NH3还原法。在恒容密闭容器中充入NH3和NO2,在一定温度下发生反应:8NH3(g)+6NO2(g)7N2(g)+12H2O(g)。 (3)下列表明该反应达到平衡状态的是___(填字母)。 A.混合气体密度保持不变 B.NO2和N2的消耗速率之比为6:7 C.混合气体中c(N2)=c(NO2) D.混合气体压强保持不变 III.CO还原法。利用高效催化剂处理汽车尾气中的NO和CO,发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH。在2L恒容密闭容器中充人2molCO和2molNO,测得NO的转化率与温度、时间的火系如图所示。 (4)下列说法正确的是___(填字母)。 A.图像中,T1>T2 B.上述反应在高温下能自发进行 C.10min时,T2K下正、逆反应速率相等 D.增大NO的浓度,反应物的转化率增大 (5)T2K温度下,0一10min内用CO表示的平均反应速率v(CO)=________mol/L-1·min-1;T1K温度下,上述反应的平衡常数K=________L·mol-1。 (6)T1K温度下,向平衡后的容器内再加入2molN2和2molNO,则平衡_____________(填“向右移动”“向左移动”或“不移动”)。 35.(15分)X、Y、Z、R、W 均为周期表中前四周期的元素,其原子序数依次增大;X2-和 Y+有相 同的核外电子排布;Z 的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R 的基 态原子在前四周期元素的基态原子中单电子数最多;W 为金属元素,X 与 W 形成的某 种化合物与 Z 的氢化物的浓溶液加热时反应可用于实验室制取 Z 的气态单质。回答下 列问题(相关回答均用元素符号表示): (1)R 的基态原子的核外电子排布式是__________________。 (2)Z 的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是____________________________________________。 (3)X 与 Z 中电负性较大的是__________。Z 的某种含氧酸盐常用于实验室中 X 的单质的 制取,此酸根离子的空间构型是______________,此离子中含有的化学键类型是_________,X—Z—X 的键角_______109.5°(填“>”、“=”或“<”)。 (4)X 与 Y 形成的化合物 Y2X 的晶胞如图。其中 X 离子的配位数 为___________,以相距一个 X 离子最近的所有 Y 离子为顶点构成的几何体为___________ 。该化合物与 MgO 相比,熔点较高的是____________。 (5)已知该化合物的晶胞边长为 a pm,则该化合物的密度为________________g·cm-3(只要求列算式,不必计算出数值,阿伏加德岁常数的数值为 NA)。 36.(15分)化合物F是一种食品保鲜剂,可按如下途径合成: 已知:RCHO+CH3CHORCH(OH)CH2CHO。 试回答: (1)A的结构简式是_________,E→F的反应类型是_________。 (2)B→C反应的化学方程式为______________________________________。 (3)C→D所用试剂和反应条件分别是_________。E中官能团的名称是________________。 (4)检验F中碳碳双键的方法是_________________________。 (5)连在双键碳上的羟基不稳定,会转化为羰基,则D的同分异构体中,只有一个环的芳香族化合物有______种(除D外)。其中苯环上只有一个取代基,核磁共振氢谱有4个峰,峰面积比为3∶2∶2∶1的同分异构体的结构简式为____________。 【参考答案】 7.B 8.C 9.C 10.B 11.B 12.D 13.C 26.A(或B) MnO2+4H++2Cl- Mn2++Cl2↑+2H2O(或2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O) f g c b d e j h 排除装置内空气的干扰,可以随开随用,随关随停 排干净三颈瓶中的空气 用玻璃棒蘸取NaNO2溶液,点在红色石蕊试纸上,试纸变蓝,说明HNO2是弱酸 滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化,说明反应达到终点 27.除去油污 防止Fe2+被氧化 保持溶液的体积,防止硫酸亚铁析出,减少损失 计算加入硫酸铵晶体的质量 盐酸酸化的氯化钡溶液 吸收尾气SO2,避免污染环境 稀硫酸和铁氰化钾溶液或稀硫酸和酸性高锰酸钾溶液 28.-666 1 大于 BD AC 0.08 1 向右移动 35. HF分子间存在氢键,而HCl分子间不存在氢键 O 三角锥形 共价键 < 8 正方体 MgO 36. 消去反应 +NaOH+NaCl O2/Cu或Ag,加热 羟基、醛基 用Br2的CCl4溶液或先加足量银氨溶液或新制氢氧化铜,充分反应后,酸化后再用溴水检验碳碳双键 8 查看更多