【化学】安徽省六安一中2020-2021学年高二上学期开学考试
安徽省六安一中2020-2021学年高二上学期开学考试
满分:100分 时间:90分钟
可能用到的相对原子质量H 1 O 16 F 19
一、选择题(每小题3分,共48分,每小题仅有一个最佳答案)
1.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.1.8 g重水(D2O)中含0.9NA个中子
B.2.24 LH2与过量CuO加热反应,转移的电子总数为0.2NA
C.足量的铜与含2 molH2SO4的浓硫酸充分反应,可生成NA个SO2分子
D.将3NA的H2与NA的N2在密闭容器充分反应,放出38 kJ热量,则3H2(g)+N2(g) 2NH3(g) △H=-38 kJ/mol
2.X、Y、Z、W四种短周期元素在周期表中的位置如图所示,这四种元素的原子最外层电子数之和为22,下列关于四种元素的说法正确的是
A.X的最高价氧化物对应的水化物酸性最强
B.化合物XY2、ZY2均能溶于水生成含氧酸
C.四种元素中W原子半径最大
D.Y的氢化物比W的氢化物沸点高
3.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是
A.X的氢化物溶于水显酸性 B.Y的氧化物是共价化合物
C.其离子半径大小:Z>Y>X D.X和Z的最高价氧化物对应的水化物都是强酸
4.X、Y、Z、W为四种短周期元素,有关这四种元素的说法中一定正确的是
元素
X
Y
Z
W
原子半径(nm)
0.077
0.075
0.102
0.099
最高正价或最低负价
+4
+5
-2
-1
A.X与Z形成XZ2时各原子均满足8电子稳定结构
B.1 mol W的单质参加氧化还原反应时转移的电子数为2 mol
C.0.3 mol Cu分别与足量HYO3和H2ZO4的稀溶液反应均产生0.2 mol气体
D.Y的氢化物与W的氢化物反应的产物只含有共价键
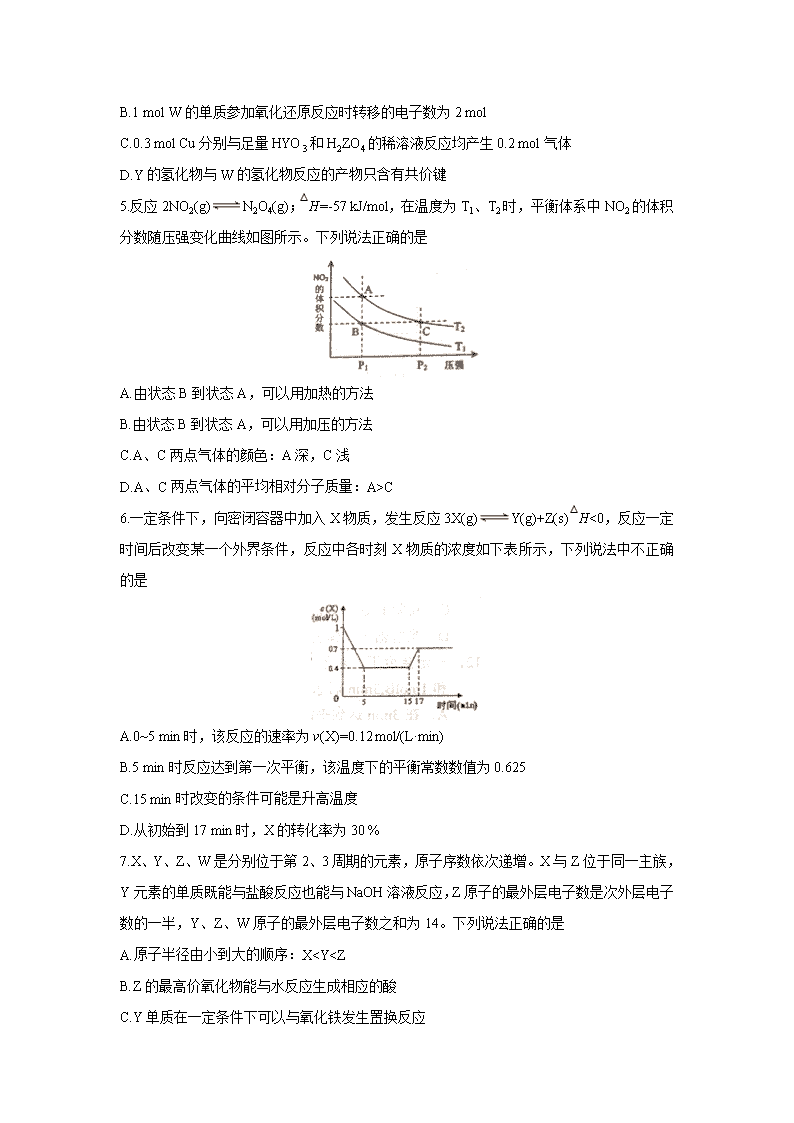
5.反应2NO2(g)N2O4(g);△H=-57 kJ/mol,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
A.由状态B到状态A,可以用加热的方法
B.由状态B到状态A,可以用加压的方法
C.A、C两点气体的颜色:A深,C浅
D.A、C两点气体的平均相对分子质量:A>C
6.一定条件下,向密闭容器中加入X物质,发生反应3X(g)Y(g)+Z(s)△H<0,反应一定时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示,下列说法中不正确的是
A.0~5 min时,该反应的速率为v(X)=0.12 mol/(L·min)
B.5 min时反应达到第一次平衡,该温度下的平衡常数数值为0.625
C.15 min时改变的条件可能是升高温度
D.从初始到17 min时,X的转化率为30 %
7.X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是
A.原子半径由小到大的顺序:X
1
B.实验放出的热量关系为b>2a
C.实验II在20 min达到平衡时的速率v(A)为0.005 mol/(L·min)
D.当容器内气体密度不随时间而变化时,上述反应已达平衡
12.一定温度下,对于反应2A(g)+B(g)3C(g)+D(s),向容积为2 L的固定容器中通入2 molA和1 molB,3 min后达到平衡,A的物质的量是0.8 mol。下列说法正确的是
A.在3 min达到平衡时的速率v(D)为0.1 mol/(L·min)
B.当压强不变时,说明反应达到平衡状态
C.如果此时再向容器中通入少量C,平衡逆向移动,再次平衡时C的体积分数增大
D.反应达到平衡时,v(A):v(B):v(C)=2:1:3
13.对于平衡体系:mA(g)+nB(g)pC(g)+qD(g) △H<0,下列说法错误的是
A.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.58倍,则m+n>p+q
B.若反应从正反应开始,达平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若m+n=p+q,则当容器内温度升高时,平衡逆向移动,容器中气体的压强不变
D.若平衡体系中共有气体a mol,再向其中加入b mol B,当重新达到平衡时,气体的总物质的量等于(a+b) mol,则m+n=p+q
14.恒温恒容下的密闭容器中,充入2.0 mol的A和1.0 mol的B,发生如下反应:2A(g)+B(g)xC(g)。达到平衡后,C的体积分数为a。若保持温度和容积不变,开始时充入0.6 molA、0.3 molB和1.4 molC,达平衡时,C的体积分数仍为a,则x的值可能是
①2 ②3 ③4 ④6
A.①② B.①③ C.②③ D.②④
15.已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8 kJ/mol、-1411.0 kJ/mol和-1366.8 kJ/mol,则C2H4(g)+H2O(l) C2H5OH(1)的△H为
A. -44.2 kJ/mol B.+44.2 kJ/mol C.-330 kJ/mol D.+330 kJ/mol
16.E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g)Mx(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法正确的是
A.M的沸点比同主族下一周期元素的气态氢化物沸点低
B.该反应的化学方程式是2HF(HF)2
C.t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时,将增大
D.平衡时混合气体的平均摩尔质量是33
二、填空题(每空2分,共52分)
17.(10分)A、B、C、D、E为短周期主族元素,其原子序数依次增大:C、D、E位于同一周期;A 的简单气态氢化物可以用作制冷剂;B为空气分馏的主要成分之一;C的原子半径短周期最大;1 mol D单质与足量盐酸反应生成气体在标准状况下的体积为33.6 L;E原子最外层电子数与核外电子总数之比为3:8。
(1)A、B简单离子半径由大到小的顺序为__________(填填离子符号)。
(2)B与C可形成原子个数比为1:1的化合物,其电子式为_____________。
(3)A的另一种氢化物A2H4的分子中极性键和非极性键数目比为_____________。
(4)A、B、E最简单气态氢化物稳定性由高到低的顺序是_________(用用化学式表达)。
(5)D单质与C最高价氧化物对应的水化物反应的离子方程式为__________________。
18.(8分)化学键的学习,有利于促进我们对物质的结构与性质的认识与理解,请结合相关知识完成下列问题。
(1)下列物质中:
①CO ②MgCl2 ③H2O2 ④NaO2 ⑤NH4C1 ⑥KO2 ⑦NaClO
①只含离子键的有________________。
②既有离子键又有非极性键的有_________________。
③请写出只含有极性键的化合物的电子式________________。
(2)根据部分键能数据和CH4(g)+4F2(g)=CF4(g)+4HF(g的反应热△H=1940 kJ/mol,计算H-F键的键能为_________kJ/mol。
化学键
C-H
C-F
H-F
F—F
键能/(kJ●mol-1)
414
489
?
155
19.(10分)碳的化合物与人类生产、生活密切相关。
(1)在恒温恒压条件下,将CO和H2的混合气体在催化剂作用下转化为甲醇的反应为:CO(g)+2H2(g)CH3OH(g) △H<0。
①下列一定能说明该反应达到平衡状态的有__________。
a.混合气体的密度不再变化 b.CO和H2的物质的量之比不再变化
C.v(CO)=v(CH3OH) d.CO在混合气中的质量分数保持不变
②T1℃时,在一个起始体积为5 L的恒压容器中充入1 molCO、2 molH2,经过5 min
达到平衡,CO的转化率为0.75,则T1℃时,CO(g)+2H2(g)CH3OH(g)的平衡常数K=____________,达到平衡时容器体积为_________L。
③在T1℃时,在体积为5 L的恒容容器中充入一定量的H2和CO,反应达到平衡时CH3OH的体积分数与的关系如图1所示。温度不变,当=2.5时,达到平衡状态,CH3OH的体积分数可能是图象中的________点。
(2)科学家提出一种由CO2制取C的太阳能工艺如图2所示,若“重整系统”发生的反应中=6,则FexOy的化学式为________________。
20.(12分)甲醇被称为21世纪的新型燃料,研究和合成甲醇有着重要的意义。
一种合成甲醇的方法为:CO(g)+2H2(g)CH3OH(g) △H1,在10 L恒容密闭容器中加入4 moLCO和8 mol H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如下表所示:
t/min
0
1
3
5
n(H2)/mol
8.0
5.4
4.0
4.0
(1)△H1____________(填“>”“<”或“=”)0。
(2)下列说法正确的是__________(填标号)。
a.温度越高,该反应的平衡常数越大
b.若其它条件不变,反应改在绝热条件下进行,CO转化率比在恒温条件下转化率大
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1>p2
(3)0~3 min内用CH3OH表示的反应速率v(CH3OH)=_________(保留三位小数)。
(4)若达平衡状态时,再向容器中投入2 molCH3OH重新达平衡后甲醇的体积分数与原平衡时相比____________(填变大、变小或不变)。
(5)200℃时,该反应的平衡常数K=__________。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡_______(填“正向”“逆向”或“不”)移动。
21.(12分)钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金、农业、电器、化工、环保等方面有着广泛的应用。
(1)Mo可被发烟硝酸氧化,产物MoOF4和MoO2F2的物质的量之比为1:1,完成下列化学方程式:
____Mo+____HF+____HNO3=____MoO2F2+____MoOF4+____NO2↑+____
(2)已知:
①2Mo(s)+3O2(g)= 2MoO3(s) △H1
②MoS2(s)+2O2(g)=Mo(s)+2SO2(g) △H2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) △H3
则△H3=_____________(用含△H1、△H2的代数式表示),在反应③中若有0.2 molMoS2参加反应,则转移电子________mol。
(3)密闭容器中用Na2CO3(s)作固硫剂,同时用一定量的氢气还原辉钼矿(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s)=Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H
实验测得平衡时的有关变化曲线如图所示:
①由图可知p2__________(填“>”或“<”)0.1 MPa。
②由图可知M点时氢气的平衡转化率为____________(计算结果保留三位有效数字)。
③平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=__________(MPa)2。
参考答案
一、选择题
题号
1
2
3
4
5
6
7
8
答案
A
D
D
A
A
B
C
B
题号
9
10
11
12
13
14
15
16
答案
B
B
D
D
C
A
A
C
二、非选择(每空2分,共52分)
17、 (10分)
(1)N3->O2-;(2)
(3)4:1;(4) H2O>NH3>H2S
(5)2Al+2OH-+2H2O=2AlO2-+3H2↑
18、 (8分)
(1)②;④⑥; ;(2)565
19、(10分)
(1)①ad (少选扣1分);②75;2.5;③F
(2)Fe3O4
20、(12分)
(1)<;(2)c;3)0.067 mol/(L·min);(4)变大;(5)6.25;正向
21、(12分)
(1) _2_Mo+__6_HF+_12_HNO3=_1_MoO2F2+___1_MoOF4+__12__NO2↑+_9H2O___
(2)△H3=△H1+△H2;2.8
(3)①;>;②66.7%;③0.01