- 2021-07-08 发布 |
- 37.5 KB |
- 64页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习电化学基础课件(64张)
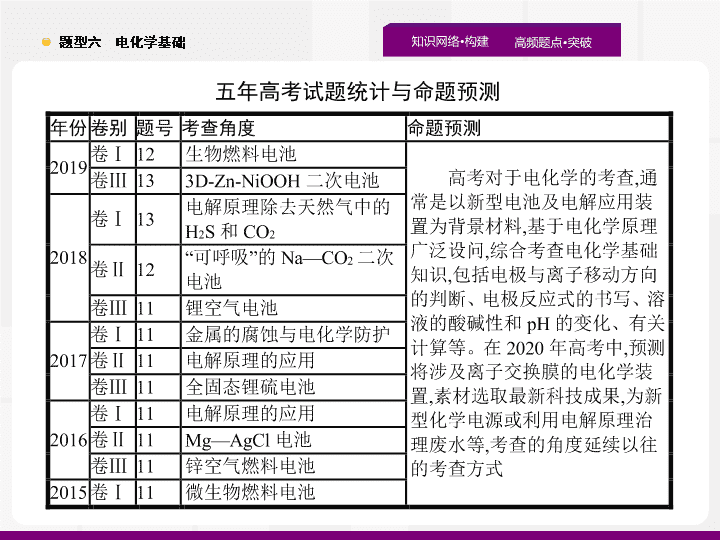
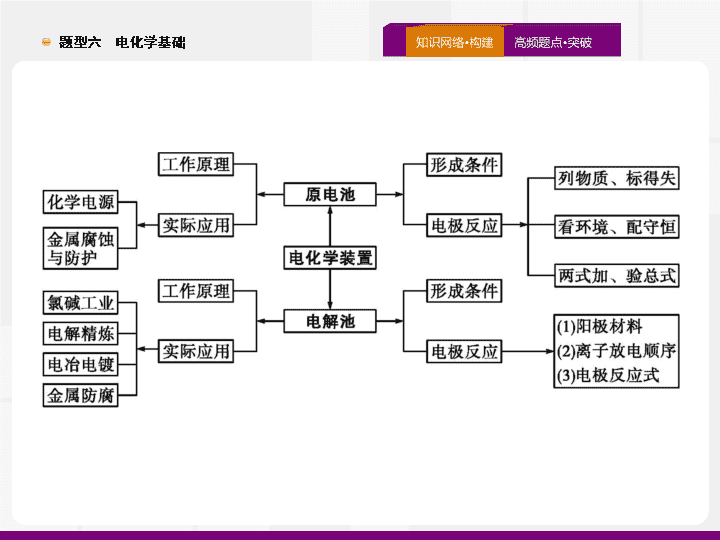
题型六 电化学基础 五年高考试题统计与命题 预测 题点一 题点二 题点三 真题诊断 必备知识 对点演练 原电池 原理及新型化学电源 1 .(2019· 全国 Ⅲ ,13) 为提升电池循环效率和稳定性 , 科学家近期利用三维多孔海绵状 Zn(3D-Zn) 可以高效沉积 ZnO 的特点 , 设计 了采用强碱性电解质的 3D-Zn-NiOOH 二次电池 , 结构如图所示。电池反应为 Zn(s)+2NiOOH(s)+H 2 O(l ) ZnO(s )+2Ni(OH) 2 (s) 。下列说法错误的是 ( ) 题点一 题点二 题点三 真题诊断 必备知识 对点演练 A. 三维多孔海绵状 Zn 具有较高的表面积 , 所沉积的 ZnO 分散度高 B. 充电时阳极反应为 Ni(OH) 2 (s)+OH - (aq)-e - =NiOOH(s)+H 2 O(l) C. 放电时负极反应为 Zn(s)+2OH - (aq)-2e - =ZnO(s)+H 2 O(l) D. 放电过程中 OH - 通过隔膜从负极区移向正极区 答案 : D 解析 : 本题考查了二次电池的工作原理及电极反应式的书写与判断。三维多孔海绵状 Zn 表面积较大 , 可高效沉积 ZnO, 所沉积的 ZnO 分散度也高 ,A 项正确 ; 根据总反应式 Zn(s)+2NiOOH(s)+ H 2 O ZnO(s )+2Ni(OH) 2 (s) 可知 , 充电时 Ni(OH) 2 (s) 在阳极上发生氧化反应 Ni(OH) 2 (s)+OH - (aq)-e - =NiOOH(s)+H 2 O(l),B 项正确 ; 放电时 Zn 在负极上发生氧化反应 Zn(s)+2OH - -2e - =ZnO(s)+H 2 O(l),C 项正确 ; 在放电过程中 , 阴离子应向负极移动 ,D 项错误。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 反思总结 充电电池又称可逆电池 : 放电过程为原电池原理 , 该过程中化学能变为电能 ; 充电过程为电解原理 , 该过程中电能转化为化学能。结合反应前后 Zn 、 Ni 元素的化合价变化可写出充、放电时的电极反应式。不管是原电池还是电解池 , 阴离子总是移向发生氧化反应的电极 , 阳离子总是移向发生还原反应的电极。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 2 .(2019· 全国 Ⅰ ,12) 利用生物燃料电池原理研究室温下氨的合成 , 电池工作时 MV 2+ /MV + 在电极与酶之间传递电子 , 示意图如下所示。下列说法错误的是 ( ) A. 相比现有工业合成氨 , 该方法条件温和 , 同时还可提供电能 B. 阴极区 , 在氢化酶作用下发生反应 H 2 +2MV 2+ =2H + +2MV + C. 正极区 , 固氮酶为催化剂 ,N 2 发生还原反应生成 NH 3 D. 电池工作时质子通过交换膜由负极区向正极区移动 题点一 题点二 题点三 真题诊断 必备知识 对点演练 答案 : B 解析 : 该过程是在室温条件下进行的 , 因此比现有工业合成氨的条件温和 , 同时还能提供电能 ,A 项正确 ; 阴极区发生的是得电子的反应 , 而左池中发生的是失电子的反应 ,B 项错误 ; 右池为正极区 , 氮气发生还原反应生成氨气 ,C 项正确 ; 左池中产生的氢离子通过交换膜向右池移动 , 即由负极区移向正极区 ,D 项正确。 方法点拨 在电化学装置中 , 发生氧化反应的电极叫做阳极 , 发生还原反应的电极叫做阴极。对比原电池中 , 负极发生氧化反应 , 故负极也叫做阳极 , 据此可以理解电化学保护金属中的 “ 牺牲阳极的阴极保护法 ”; 本题 B 项中所说的 “ 阴极区 ” 应该是指该原电池中的正极区。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 3 .(2018· 全国 Ⅱ ,12) 我国科学家研发了一种室温下 “ 可呼吸 ” 的 Na-CO 2 二次电池。将 NaClO 4 溶于有机溶剂作为电解液 , 钠和负载碳纳米管的镍网分别作为电极材料 , 电池的总反应为 : 3CO 2 +4Na 2Na 2 CO 3 +C , 下列说法错误的是 ( ) 题点一 题点二 题点三 真题诊断 必备知识 对点演练 答案 : D 题点一 题点二 题点三 真题诊断 必备知识 对点演练 4 .(2018· 全国 Ⅲ ,11) 一种可充电锂 - 空气电池如图所示。当电池放电时 ,O 2 与 Li + 在多孔碳材料电极处生成 Li 2 O 2 -x ( x =0 或 1) 。下列说法正确的是 ( ) A. 放电时 , 多孔碳材料电极为负极 B. 放电时 , 外电路电子由多孔碳材料电极流向锂电极 C. 充电时 , 电解质溶液中 Li + 向多孔碳材料区迁移 题点一 题点二 题点三 真题诊断 必备知识 对点演练 答案 : D 解析 : 放电时 , 该电池中锂作负极 , 多孔碳材料作正极 ,A 项错误 ; 放电时 , 外电路电子由负极流向正极 , 即由锂电极流向多孔碳材料电极 ,B 项错误 ; 充电时 , 锂电极作阴极 , 多孔碳材料电极作阳极 , 电解质溶液中 Li + 应向锂电极区移动 ,C 项错误 ; 充电反应与放电反应相反 , 方法点拨 放电时 , 电子通过外电路 “ 从负极流向正极 ”, 内电路中离子定向移动方向是 “ 阳离子移向正极 , 阴离子移向负极 ”, 自由电子不会通过内电路。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 5 .(2017· 全国 Ⅲ ,11) 全固态锂硫电池能量密度高、成本低 , 其工作原理如图所示 , 其中电极 a 常用掺有石墨烯的 S 8 材料 , 电池反应为 :16Li+ x S 8 =8Li 2 S x (2 ≤ x ≤ 8) 。下列说法错误的是 ( ) A. 电池工作时 , 正极可发生反应 :2Li 2 S 6 +2Li + +2e - =3Li 2 S 4 B. 电池工作时 , 外电路中流过 0.02 mol 电子 , 负极材料减重 0.14 g C. 石墨烯的作用主要是提高电极 a 的导电性 D. 电池充电时间越长 , 电池中 Li 2 S 2 的量越多 题点一 题点二 题点三 真题诊断 必备知识 对点演练 答案 : D 解析 : 在该电池中电极 a 为正极 , 发生的反应依次为 : mol 电子时被氧化的 Li 的物质的量为 0.02 mol, 质量减少 0.14 g,B 正确 ; 石墨烯能导电 ,a 电极掺有石墨烯 , 可提高电极 a 的导电性 ,C 正确 ; 电池充电时由于 Li + 得到电子生成 Li, 则电池充电时间越长 , 电池中 Li 2 S 2 的量越少 ,D 错误。 方法点拨 本题的解题关键是电极的判断 , 锂电极 b 一定是负极 , 由 Li + 的移动方向可知 , 锂电池的正极一定是 a 极 ;Li 2 S x 中 x 从 8→2 的过程中 , 因 Li + 的数目没有变化 , 则硫的平均化合价逐渐降低。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 6 .(2016· 全国 Ⅱ ,11)Mg-AgCl 电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是 ( ) 答案 : B 解析 : Mg - AgCl 海水电池中 ,Mg 为活泼金属 , 作负极 , 发生反应 :Mg-2e - =Mg 2+ ,A 项正确 ;AgCl 在正极反应 :AgCl+e - =Ag+Cl - ,B 项错误 ; 原电池中 , 阴离子向负极移动 ,C 项正确 ;Mg 可与 H 2 O 缓慢反应 ,D 项正确。 特别提醒 电池放电时 , 部分化学能转化为热能 , 使电极附近的溶液温度升高 , 使镁能够在负极区与水反应。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 答案 : C 题点一 题点二 题点三 真题诊断 必备知识 对点演练 8 .(2015· 全国 Ⅰ ,11) 微生物电池是指在微生物的作用下将化学能转化为电能的装置 , 其工作原理如图所示。下列有关微生物电池的说法错误的是 ( ) A. 正极反应中有 CO 2 生成 B. 微生物促进了反应中电子的转移 C. 质子通过交换膜从负极区移向正极区 D. 电池总反应为 C 6 H 12 O 6 +6O 2 =6CO 2 +6H 2 O 答案 : A 题点一 题点二 题点三 真题诊断 必备知识 对点演练 解析 : C 6 H 12 O 6 中 C 的平均化合价为 0 价 , 二氧化碳中 C 的化合价为 +4 价 , 所以生成二氧化碳的反应为氧化反应 , 故 CO 2 在负极生成 ,A 选项错误 ; 在微生物的作用下 , 该装置为原电池装置 , 反应速率加快 , 所以微生物促进了反应的发生 ,B 项正确 ; 质子交换膜只允许质子 ( 即 H + ) 通过 , 原电池中阳离子向正极移动 ,C 项正确 ; 电池的总反应实质是 C 6 H 12 O 6 的氧化反应 ,D 项正确。 特别提醒 燃料电池或微生物电池的燃料一定在电池的负极上发生氧化反应 ; 通入氧气或空气的电极为正极 , 发生还原反应。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 原电池原理 (1) 原电池工作原理示意图 题点一 题点二 题点三 真题诊断 必备知识 对点演练 (2) 原电池中正、负极的判断 判断原电池的正、负极需抓住闭合回路和氧化还原反应进行分析 , 如图 : 注意 : 原电池的正、负极与电极材料的性质有关 , 也与电解质溶液有关 , 不要形成思维定式 —— 活泼金属一定是负极。如 Al 、 Mg 和 NaOH 溶液构成的原电池中 ,Al 为负极 ,Mg 为正极。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 1 .( 原创题 )2019 年 3 月 14 日 , 第 16 届海南国际车展在海南省会展中心盛大开幕 , 车展上展示出了中国研制的新型燃料电池汽车 , 该车装有 “ 绿色心脏 ”—— 质子交换膜燃料电池。如图是某种质子交换膜燃料电池原理示意图。下列说法正确的是 ( ) A. 该电池的正极是 a B. 质子 (H + ) 通过质子交换膜移动到 a 电极 C. 正极反应为 O 2 +4H + +4e - =2H 2 O D. 消耗 2 mol 氢气时 , 转移电子的物质的量为 2 mol 题点一 题点二 题点三 真题诊断 必备知识 对点演练 答案 : C 解析 : a 电极上氢气失去电子产生氢离子 ,a 电极为电池的负极 ,A 项错误 ; 电池中阳离子定向移动到正极 , 即质子 (H + ) 通过质子交换膜移动到 b 电极 ,B 项错误 ; 正极上氧气在酸性条件下得电子生成水 , 电极反应为 O 2 +4H + +4e - =2H 2 O,C 项正确 ; 根据负极电极反应式 H 2 -2e - =2H + 可知 , 消耗 2 mol 氢气时 , 转移电子的物质的量为 4 mol,D 项错误。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 2 .(2019· 河南部分示范性高中联考 ) 银 -Ferrozine 法检测甲醛 (HCHO) 的原理为 : ① 在原电池装置中 , 氧化银能将甲醛充分氧化为 CO 2 ② Fe 3+ 与产生的 Ag 定量反应生成 Fe 2+ ③ Fe 2+ 与 Ferrozine 形成有色配合物 ④ 测定溶液的吸光度 ( 吸光度与溶液中有色物质的浓度成正比 ) 。下列说法正确的是 ( ) A. ① 中 , 负极的电极反应式为 2Ag 2 O+4H + +4e - =4Ag+2H 2 O B. ① 中 , 溶液中的 H + 由正极移向负极 C. 理论上消耗的甲醛与生成的 Fe 2+ 的物质的量之比为 1 ∶ 4 D. ④ 中 , 甲醛浓度越大 , 吸光度越小 答案 : C 题点一 题点二 题点三 真题诊断 必备知识 对点演练 解析 : ① 中负极的电极反应式为 HCHO-4e - +H 2 O=CO 2 ↑+4H + , 正极的电极反应式为 2Ag 2 O+4H + +4e - =4Ag+2H 2 O,A 项错误 ; ① 中 , 溶液中的 H + 由原电池负极向正极移动 ,B 项错误 ; 根据电子守恒关系 :HCHO~4Ag~4Fe 2+ , 故理论上消耗的甲醛与生成的 Fe 2+ 的物质的量之比为 1 ∶ 4,C 项正确 ; 甲醛浓度越大 , 理论上生成 Fe 2+ 越多 , 进而得到有色配合物的浓度也越大 , 溶液吸光度越大 ,D 项错误。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 下列说法不正确的是 ( ) A. 盐桥中的 K + 移向 FeCl 3 溶液 B. 反应开始时 , 乙池中石墨电极上发生氧化反应 C. 电流计读数为零时 , 反应达到化学平衡状态 D. 电流计读数为零后 , 在甲池中溶入 FeCl 2 固体 , 乙池中石墨电极为负极 题点一 题点二 题点三 真题诊断 必备知识 对点演练 答案 : D 解析 : 甲池中石墨电极为正极 , 乙池中石墨电极为负极 , 盐桥中阳离子向正极移动 , 所以 K + 向 FeCl 3 溶液迁移 ,A 项正确 ; 反应开始时 , 乙池中 I - 失去电子发生氧化反应 ,B 项正确 ; 当电流计读数为零时 , 说明导线中没有电子发生转移 , 反应达到平衡 ,C 项正确 ; 当向甲池中加入 FeCl 2 , 导致平衡逆向移动 , 即 Fe 2+ 失去电子生成 Fe 3+ , 甲池中石墨电极作为负极 , 而乙池中石墨电极成为正极 ,D 项错误。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 4 .(2019· 浙江绍兴诸暨中学模拟 ) 如图所示是一种酸性燃料电池酒精检测仪 , 具有自动吹气流量检测与控制的功能 , 非常适合进行现场酒驾检测。下列说法不正确的是 ( ) A. 电流由 O 2 所在的铂电极流出 B.O 2 所在的铂电极处发生还原反应 C. 该电池的负极反应式为 CH 3 CH 2 OH+3H 2 O-12e - =2CO 2 ↑+12H + D. 微处理器通过检测电流大小可计算出被测气体中酒精的含量 题点一 题点二 题点三 真题诊断 必备知识 对点演练 答案 : C 解析 : 燃料电池中燃料在负极反应 , 氧气在正极反应。氧气在正极发生还原反应 , 电流由正极通过外电路流向负极 ,A 、 B 正确 ; 由图示可知 , 负极反应物为 CH 3 CH 2 OH( 碳元素的平均化合价可视为 -2), 生成物为 CH 3 COOH( 碳元素的平均化合价可视为 0), 由质子交换膜可知溶液呈酸性 , 负极电极反应式为 CH 3 CH 2 OH-4e - +H 2 O=CH 3 COOH+4H + ,C 项错误。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 电解原理的应用 1 .(2018· 全国 Ⅰ ,13) 最近我国科学家设计了一种 CO 2 +H 2 S 协同转化装置 , 实现对天然气中 CO 2 和 H 2 S 的高效去除。示意图如下所示 , 其中电极分别为 ZnO@ 石墨烯 ( 石墨烯包裹的 ZnO) 和石墨烯 , 石墨烯电极区发生反应为 : 该装置工作时 , 下列叙述错误的是 ( ) A. 阴极的电极反应 :CO 2 +2H + +2e - =CO+H 2 O B. 协同转化总反应 :CO 2 +H 2 S=CO+H 2 O+S C. 石墨烯上的电势比 ZnO@ 石墨烯上的低 D. 若采用 Fe 3+ /Fe 2+ 取代 EDTA-Fe 3+ /EDTA-Fe 2+ , 溶液需为酸性 题点一 题点二 题点三 真题诊断 必备知识 对点演练 题点一 题点二 题点三 真题诊断 必备知识 对点演练 答案 : C 解析 : 根据图示可知 ,ZnO@ 石墨烯电极上发生还原反应 , 则该电极为阴极 , 电极反应式为 CO 2 +2H + +2e - =CO+H 2 O,A 项正确 ; 根据题干信息及图中两电极上的反应可知 , 该电化学装置 ( 电解池 ) 中的总反应为 CO 2 +H 2 S=CO+S+H 2 O,B 项正确 ; 石墨烯作阳极 ,ZnO@ 石墨烯作阴极 , 阳极上的电势应高于阴极上的电势 ,C 项错误 ; 若采用 Fe 3+ /Fe 2+ 取代 EDTA - Fe 3+ /EDTA - Fe 2+ , 溶液需为酸性 , 否则 Fe 3+ 、 Fe 2+ 可形成沉淀 , 且 H 2 S 和 S 不能稳定存在 ,D 项正确。 方法点拨 该装置外接了 “ 光伏电池 ”, 故为电解装置 ; 根据天然气流经电极区的变化图示 ,H 2 S 所参加的不是电极反应 ,CO 2 参与的反应为电极反应 , 故可以根据 CO 2 的变化确定电极名称 , 然后利用电解原理判断相关问题。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 2 .(2017· 全国 Ⅱ ,11) 用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜 , 电解质溶液一般为 H 2 SO 4 -H 2 C 2 O 4 混合溶液。下列叙述错误的是 ( ) A. 待加工铝质工件为阳极 B. 可选用不锈钢网作为阴极 C. 阴极的电极反应式为 :Al 3+ +3e - =Al D. 硫酸根离子在电解过程中向阳极移动 答案 : C 解析 : A 项 , 根据题意 “ 铝表面形成致密、耐腐蚀的氧化膜 ”, 即铝失去电子发生氧化反应变为氧化铝 , 因此待加工铝质工件为阳极 ,A 正确 ;B 项 , 阴极上的电极材料本身不反应 , 只传导电流可以选用不锈钢网作为阴极 ,B 正确 ; 阴极的电极反应式为 2H + +2e - =H 2 ↑,C 错误 ;D 项 , 电解过程中阴离子移向阳极 , 即 S 向 阳极移动 ,D 项正确。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 易错警示 题干中明确指出 “ 用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜 ”, 故本题属于电解原理的应用。电极反应式的书写不能受 “ 电解质溶液一般为 H 2 SO 4 - H 2 C 2 O 4 混合溶液 ” 的影响。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 3 .(2016· 全国 Ⅰ ,11) 三室式电渗析法处理含 Na 2 SO 4 废水的原理如图所示 , 采用惰性电极 ,ab 、 cd 均为离子交换膜 , 在直流电场的作用下 , 两膜中间的 Na + 和 S 可 通过离子交换膜 , 而两端隔室中离子被阻挡不能进入中间隔室。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 下列叙述正确的是 ( ) A. 通电后中间隔室的 S 离子 向正极迁移 , 正极区溶液 pH 增大 B. 该法在处理含 Na 2 SO 4 废水时可以得到 NaOH 和 H 2 SO 4 产品 C. 负极反应为 2H 2 O-4e - =O 2 +4H + , 负极区溶液 pH 降低 D. 当电路中通过 1 mol 电子的电量时 , 会有 0.5 mol 的 O 2 生成 答案 : B 解析 : 在负极区发生的电极反应为 4H 2 O+4e - =2H 2 ↑+4OH - , 在正极区发生的电极反应为 2H 2 O-4e - =O 2 ↑+4H + , 故正极区 pH 减小 ,A 选项错误 ;Na + 移向负极区 , 生成 NaOH,S 移 向正极区 , 生成 H 2 SO 4 ,B 选项正确 ; 根据负极区电极反应可知 C 选项错误 ; 每通过 1 mol 电子 , 有 0.25 mol O 2 生成 ,D 选项错误。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 方法点拨 由题干中 “ 在直流电场的作用下 ” 可知 , 该装置为电解装置 , 题图中的 “-” 是指与电源负极相连接 ,“+” 是指与电源正极相连接 , 题图中的负极区其实应为阴极区 , 正极区其实是阳极区。硫酸钠溶液在该装置中 , 起到形成闭合回路的作用 , 通过 Na + 和 S 的 定向移动构成闭合回路 , 达到处理废水的作用。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 1 . 电解原理图解 ( 以电解氯化铜溶液为例 ) 题点一 题点二 题点三 真题诊断 必备知识 对点演练 2 . 离子放电顺序与惰性电极电解电解质溶液的 类型 题点一 题点二 题点三 真题诊断 必备知识 对点演练 3 . 电解的四大类型及其 规律 题点一 题点二 题点三 真题诊断 必备知识 对点演练 温馨提示 书写电极反应式时 , 若溶液为碱性 , 则电极反应式中不出现 H + ; 若溶液为酸性 , 则电极反应式中不出现 OH - 。例如电解 NaOH 溶液时的阴极反应式为 2H 2 O+2e - =H 2 ↑+2OH - ; 电解 H 2 SO 4 溶液时的阳极反应式为 2H 2 O-4e - =O 2 ↑+4H + 。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 4 . 电化学装置中常见的 离子交换膜 题点一 题点二 题点三 真题诊断 必备知识 对点演练 1 .(2019· 河南平顶山一轮质量检测 ) 某实验小组模拟光合作用 , 采用电解 CO 2 和 H 2 O 的方法制备 CH 3 CH 2 OH 和 O 2 的装置如图所示。下列说法不正确的是 ( ) A. 铂极为阳极 , 发生氧化反应 B. 电解过程中 ,H + 由交换膜左侧向右侧迁移 C. 阴极的电极反应式为 2CO 2 +12H + +12e - =CH 3 CH 2 OH+3H 2 O D. 电路上转移 2 mol 电子时铂极产生 11.2 LO 2 ( 标准状况 ) 题点一 题点二 题点三 真题诊断 必备知识 对点演练 答案 : B 解析 : CH 3 CH 2 OH 中 C 为 -2 价 ,CO 2 发生还原反应 , 在铜电极区充入 CO 2 。由电池符号知 , 铂极为阳极 , 发生氧化反应 ,A 项正确 ; 铂极的电极反应为 2H 2 O-4e - =4H + +O 2 ↑, 氢离子由交换膜右侧向左侧迁移 ,B 项错误 ; 阴极上 CO 2 得电子发生还原反应生成乙醇和水 ,C 项正确 ; 电路中转移 2 mol 电子时在铂电极上生成 0.5 mol O 2 ,D 项正确。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 2 .(2019· 福建毕业班质量检查 ) 利用如右图所示装置 , 以 NH 3 作氢源 , 可实现电化学氢化反应。下列说法错误的是 ( ) A.a 为阴极 B.b 电极反应式为 2NH 3 -6e - =N 2 +6H + C. 电解一段时间后 , 装置内 H + 数目增多 题点一 题点二 题点三 真题诊断 必备知识 对点演练 答案 : C 解析 : 从图中箭标方向 “NH 3 →N 2 ” 可判断 NH 3 在 b 电极上失去电子 , 发生氧化反应 ,b 为阳极 , 则 a 为阴极 ,A 项正确 ; 从图中发现电解质中传导 H + , 故 b 电极反应式为 2NH 3 -6e - =N 2 +6H + ,B 项正确 ; 从 “Ar—CO—R→Ar—CH(OH)—R” 即有机芳香类羰基化合物转化为醇类 , 发生了还原反应 :Ar—CO—R+2H + +2e - →Ar—CH(OH)—R, 根据电路中转移的电子数目相等可知 ,b 极产生的 H + 与 a 极消耗的 H + 物质的量相等 ,C 项错误 ,D 项正确。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 3 .(2019· 四川攀枝花三模 ) 电致变色玻璃以其优异的性能将成为市场的新宠。如图所示为五层膜的玻璃电致变色系统 , 其工作原理是在外接电源作用下 , 通过在膜材料内部发生氧化还原反应 , 实现对器件的光透过率进行多级可逆性调节。 ( 已知 :WO 3 和 Li 4 Fe 4 [Fe(CN) 6 ] 3 均为无色透明 ,LiWO 3 和 Fe 4 [Fe(CN) 6 ] 3 均为蓝色 ) 下列有关说法正确的是 ( ) 题点一 题点二 题点三 真题诊断 必备知识 对点演练 A. 当 B 外接电源负极时 , 膜由无色变为蓝色 B. 当 B 外接电源负极时 , 离子储存层发生反应为 Fe 4 [Fe(CN) 6 ] 3 +4Li + +4e - =Li 4 Fe 4 [Fe(CN) 6 ] 3 C. 当 A 接电源的负极时 , 此时 Li + 得到电子被还原 D. 当 A 接电源正极时 , 膜的透射率降低 , 可以有效阻挡阳光 答案 : B 解析 : 当 B 接外接电源负极时 ,B 为阴极 , 此时蓝色的 Fe 4 [Fe(CN) 6 ] 3 得电子并结合 Li + 生成 Li 4 Fe 4 [Fe(CN) 6 ] 3 , 此物质为无色透明物质 , 故当 B 外接电源负极时 , 膜由蓝色变为无色 ,A 项错误 ; 当 B 外接电源负极时发生的电极反应为 Fe 4 [Fe(CN) 6 ] 3 +4Li + +4e - =Li 4 Fe 4 [Fe(CN) 6 ] 3 ,B 项正确 ;A 接电源负极 ,WO 3 得到电子被还原 ,C 项错误 ; 当 A 接电源正极 B 接外接电源负极时 ,B 为阴极 , 此时蓝色的 Fe 4 [Fe(CN) 6 ] 3 得电子生成无色透明的 Li 4 Fe 4 [Fe(CN) 6 ] 3 , 不能有效阻挡阳光 ,D 项错误。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 4 .(2019· 河南九师联盟质量检测 )C 2 H 4 及 C 2 H 2 等均可用适当的羧酸盐采用 Kolbe 电解法得到。如图为制取 C 2 H 2 的电解装置 , 该装置工作时 , 下列说法错误的是 ( ) A. 该装置使电能转变为化学能 B. 阴极周围溶液的 pH 不断升高 D. 制取乙烯可用 CH 3 COOK 溶液作阳极 电解液 题点一 题点二 题点三 真题诊断 必备知识 对点演练 答案 : D 解析 : 电解池中 , 与电源正极相连的是阳极 , 与电源负极相连的是阴极。故电极 a 是阳极 , 电极 b 是阴极。 该装置为电解池 , 是电能转变为化学能 ,A 项正确 ; 阴极与电源的负极相连 , 电解溶液中的阳离子发生还原反应。故阴极的电极反应 题点一 题点二 题点三 真题诊断 必备知识 对点演练 题点一 题点二 题点三 真题诊断 必备知识 对点演练 答案 : A 题点一 题点二 题点三 真题诊断 必备知识 对点演练 6 .(2019· 湖北四地七校联盟 2 月联考 ) 某地海水中主要离子的含量如下表 , 现利用 “ 电渗析法 ” 进行淡化 , 技术原理如图所示 ( 两端为惰性电极 , 阳膜只允许阳离子通过 , 阴膜只允许阴离子通过 ) 。下列有关说法错误的是 ( ) 题点一 题点二 题点三 真题诊断 必备知识 对点演练 A. 甲室的电极反应式为 2Cl - -2e - =Cl 2 ↑ B. 海水淡化过程中易在戊室形成水垢 C. 乙室和丁室中部分离子的浓度增大 , 淡水的出口为 b D. 当戊室收集到 22.4 L( 标准状况 ) 气体时 , 通过甲室阳膜的离子的物质的量一定为 2 mol 答案 : D 题点一 题点二 题点三 真题诊断 必备知识 对点演练 解析 : 由题图可知 , 甲室电极与电源正极相连 , 为阳极室 ,Cl - 放电能力大于 OH - , 所以阳极的电极反应式为 2Cl - -2e - =Cl 2 ↑,A 项正确 ; 戊室电极与电源负极相连 , 为阴极室 , 开始电解时 , 阴极上水得电子生成氢气 , 同时生成 OH - , 生成的 OH - 和 HC 反应 生成 C ,Ca 2 + 转化为 CaCO 3 沉淀 ,OH - 也可以和 Mg 2+ 生成 Mg(OH) 2 沉淀 ,CaCO 3 和 Mg(OH) 2 是水垢的主要成分 ,B 项正确 ; 阳膜只允许阳离子通过 , 阴膜只允许阴离子通过 , 电解时丙室中阴离子移向乙室 , 阳离子移向丁室 , 所以丙室中剩余物质主要是水 , 故淡水出口为 b,C 项正确 ; 根据对 B 项的分析 , 戊室收集到的是 H 2 , 当戊室收集到 22.4 L( 标准状况 ) 气体时 , 则电路中转移 2 mol 电子 , 通过甲室阳膜的离子为阳离子 , 由于既有 +1 价的阳离子 , 又有 +2 价的阳离子 , 所以通过甲室阳膜的离子的物质的量并不是 2 mol,D 项错误。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 金属腐蚀与防护 1 .(2019· 江苏卷 ,10) 将铁粉和活性炭的混合物用 NaCl 溶液湿润后 , 置于如图所示装置中 , 进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是 ( ) A. 铁被氧化的电极反应式为 Fe-3e - =Fe 3+ B. 铁腐蚀过程中化学能全部转化为电能 C. 活性炭的存在会加速铁的腐蚀 D. 以水代替 NaCl 溶液 , 铁不能发生吸氧腐蚀 答案 : C 题点一 题点二 题点三 真题诊断 必备知识 对点演练 解析 : 题述条件下铁粉发生了吸氧腐蚀 ,Fe 失电子生成 Fe 2+ ,A 项错误 ; 在铁的腐蚀过程中 , 化学能会转换为电能和热能 ,B 项错误 ; 活性炭与 Fe 、 NaCl 溶液构成原电池 , 可加快铁的腐蚀速率 ,C 项正确 ; 以水代替 NaCl 溶液 , 水虽是一种弱电解质 , 但也能使铁发生吸氧腐蚀 , 只是速率会变慢 ,D 项错误。 反思总结 本题的装置为人教版《化学反应原理》教材中的 “ 实验 4-3” 的改编 , 金属在 NaCl 溶液中发生的腐蚀为吸氧腐蚀 , 加入碳粉作为正极 , 构成原电池 , 加速铁的腐蚀。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 2 .(2017· 全国 Ⅰ ,11) 支撑海港码头基础的钢管桩 , 常用外加电流的阴极保护法进行防腐 , 工作原理如图所示 , 其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是 ( ) A. 通入保护电流使钢管桩表面腐蚀电流接近于零 B. 通电后外电路电子被强制从高硅铸铁流向钢管桩 C. 高硅铸铁的作用是作为损耗阳极材料和传递电流 D. 通入的保护电流应该根据环境条件变化进行调整 答案 : C 题点一 题点二 题点三 真题诊断 必备知识 对点演练 解析 : 外加电流的阴极保护法 , 使被保护的钢管桩上无腐蚀电流 ,A 项正确 ; 通电后 , 高硅铸铁为惰性阳极 , 钢管桩为阴极 , 外电路电子从阳极流向阴极 ,B 项正确 ; 由于高硅铸铁为惰性阳极 , 因此应是海水中的 OH - 失电子 ,2H 2 O-4e - =O 2 ↑+4H + , 阳极材料不被损耗 ,C 项错误 ; 在外加电流的阴极保护法中 , 应依据环境条件变化调整电流大小。 易错警示 本题对于铸铁作为阳极 , 忽视了题干中 “ 高硅铸铁为惰性辅助阳极 ” 的提示 , 容易做出错误的判断。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 1 . 金属腐蚀快慢程度的判断 方法 2 . 金属电化学保护的两种 方法 题点一 题点二 题点三 真题诊断 必备知识 对点演练 1 .(2019· 山东济南莱芜期末 ) 如图所示 , 在水槽中装入蒸馏水后 , 铁块腐蚀速率的大小顺序正确的是 ( ) A. Ⅰ > Ⅱ > Ⅲ B. Ⅰ > Ⅲ > Ⅱ C. Ⅱ > Ⅰ > Ⅲ D. Ⅱ > Ⅲ > Ⅰ 答案 : B 解析 : Ⅰ 形成原电池 , 铁为负极 , 腐蚀较快 ; Ⅱ 形成原电池 , 铁为正极 , 被保护 , 腐蚀慢 ; 所以铁块腐蚀速率的大小顺序为 Ⅰ > Ⅲ > Ⅱ ,B 项正确。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 2 .(2019· 山东德州期末 )2018 年 , 国家文物局对北洋海军军舰 “ 经远舰 ” 进行海上考古 , 考古队为舰体焊接锌块以实施保护。下列判断不合理的是 ( ) A. 焊接锌块后的负极反应 :Fe-2e - =Fe 2+ B. 上述保护方法中可用镁合金块代替锌块 C. 腐蚀过程中的正极反应 :O 2 +2H 2 O+4e - =4OH - D. 考古队采用的是牺牲阳极的阴极保护法 答案 : A 解析 : 金属活动性 Zn>Fe, 所以焊接锌块后 Zn 为负极 , 负极反应为 Zn-2e - =Zn 2+ ,A 项符合题意 ; 若用镁合金块代替锌块 , 由于 Mg 的活动性比 Fe 强 , 也可以保护 Fe 不被腐蚀 ,B 项正确 ; 海水为中性溶液 , 钢铁发生的是吸氧腐蚀 , 正极反应式是 O 2 +2H 2 O+4e - =4OH - ,C 项正确 ; 采用在舰体上焊接活泼金属的方法就是牺牲阳极的阴极保护法 ,D 项正确。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 3 .(2019· 广东东莞二模 ) 近年来 , 我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象 , 在铁帽上加锌环能有效防止铁帽的腐蚀 , 下列说法正确的是 ( ) . 阴极电极反应为 4OH - -4e - =O 2 ↑+2H 2 O B. 阳极电极反应为 Zn—2e - =Zn 2+ C. 该装置为牺牲阳极的阴极保护法 D. 绝缘子表面产生的 OH - 向阴极移动 答案 : B 解析 : 阴极电极反应为 H 2 O+2e - =H 2 ↑+OH - ,A 项错误 ; 阳极锌失电子产生锌离子 , 电极反应为 Zn-2e - =Zn 2+ ,B 项正确 ; 该装置为外加电流的阴极保护法 ,C 项错误 ; 电解池中绝缘子表面产生的 OH - 向阳极移动 ,D 项错误。 题点一 题点二 题点三 真题诊断 必备知识 对点演练 4 .(2019· 贵州遵义航天高级中学最后一卷 ) 在潮湿的深层土壤中 , 钢管主要发生厌氧腐蚀 , 有关厌氧腐蚀的机理有多种 , 其中一种理论为厌氧细菌可促使 S 与 H 2 反应生成 S 2- , 加速钢管的腐蚀 , 其反应原理如图所示。下列说法正确的是 ( ) C. 钢管腐蚀的直接产物中含有 FeS 、 Fe(OH) 2 D. 在钢管表面镀锌或铜可减缓钢管的腐蚀 题点一 题点二 题点三 真题诊断 必备知识 对点演练 答案 : C查看更多