- 2021-07-08 发布 |
- 37.5 KB |
- 20页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年甘肃省静宁县第一中学高一上学期期中考试化学试卷+Word版含解析
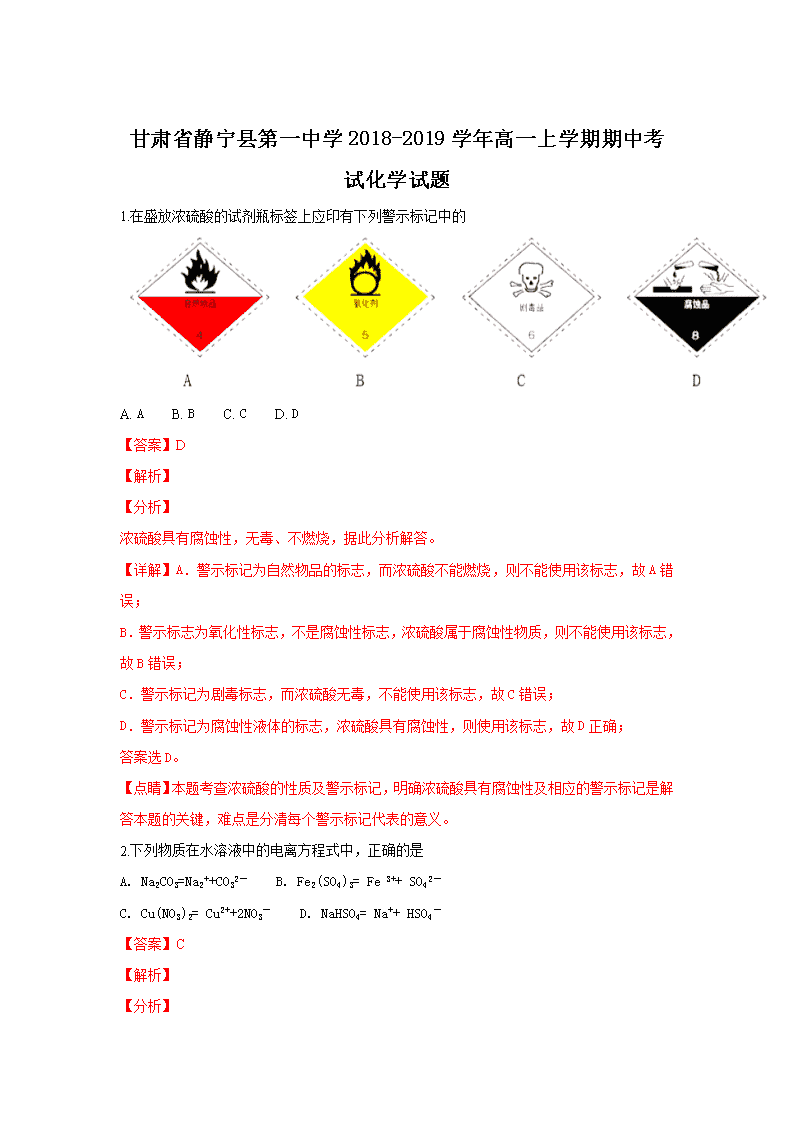
甘肃省静宁县第一中学2018-2019学年高一上学期期中考试化学试题 1.在盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的 A. A B. B C. C D. D 【答案】D 【解析】 【分析】 浓硫酸具有腐蚀性,无毒、不燃烧,据此分析解答。 【详解】A.警示标记为自然物品的标志,而浓硫酸不能燃烧,则不能使用该标志,故A错误; B.警示标志为氧化性标志,不是腐蚀性标志,浓硫酸属于腐蚀性物质,则不能使用该标志,故B错误; C.警示标记为剧毒标志,而浓硫酸无毒,不能使用该标志,故C错误; D.警示标记为腐蚀性液体的标志,浓硫酸具有腐蚀性,则使用该标志,故D正确; 答案选D。 【点睛】本题考查浓硫酸的性质及警示标记,明确浓硫酸具有腐蚀性及相应的警示标记是解答本题的关键,难点是分清每个警示标记代表的意义。 2.下列物质在水溶液中的电离方程式中,正确的是 A. Na2CO3=Na2++CO32- B. Fe2(SO4)3= Fe 3++ SO42- C. Cu(NO3)2= Cu2++2NO3- D. NaHSO4= Na++ HSO4- 【答案】C 【解析】 【分析】 用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式,据此判断。 【详解】A.碳酸钠是强电解质,完全电离,电离方程式为:Na2CO3=2Na++CO32-,故A错误; B.Fe2(SO4)3在溶液中完全电离,电离方程式为:Fe2(SO4)3=2Fe3++3SO42-,故B错误; C.Cu(NO3)2是强电解质,在溶液中完全电离出铜离子和硝酸根离子,电离方程式为:Cu(NO3)2=Cu2++2NO3-,故C正确; D.NaHSO4是强酸的酸式盐,属强电解质,溶液中完全电离,电离出Na+、H+、SO42-离子,电离方程式为:NaHSO4=Na++H++SO42-,故D错误; 答案选C。 【点睛】本题考查电解质的电离方程式书写,掌握电离方程式书写规则并能灵活运用是正确解答此类题的关键,要注意原子守恒、电荷守恒的应用。 3.下列反应不属于氧化还原反应的是 A. 2F2+2H2O===4HF+O2 B. 3CO+Fe2O32Fe+3CO2 C. AgNO3+NaCl===AgCl↓+NaNO3 D. MgCl2(熔融) Mg+Cl2↑ 【答案】C 【解析】 【分析】 氧化还原反应的特征是有化合价的变化,有化合价变化的反应是氧化还原反应,据此判断。 【详解】A、F、O元素的化合价均发生了变化,属于氧化还原反应,故A不符合; B、Fe、C元素的化合价均发生了变化,属于氧化还原反应,故B不符合; C、没有元素的化合价发生变化,不属于氧化还原反应,属于复分解反应,故C符合; D、Mg、Cl元素的化合价均发生了变化,属于氧化还原反应,故D不符合。 答案选C。 4.KOH是我国古代纺织业常用作漂洗的洗涤剂。古代制取KOH的流程如下: 上述流程中没有涉及的化学反应类型是 A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应 【答案】C 【解析】 【分析】 发生CaCO3CaO+CO2↑、CaO+H2O=Ca(OH)2、K2CO3+Ca(OH)2=CaCO3↓+2KOH,结合四种基本反应类型的概念来解答。 【详解】由制备流程可知,发生的分液依次为CaCO3CaO+CO2↑、CaO+H2O=Ca(OH)2、K2CO3+Ca(OH)2=CaCO3↓+2KOH,其反应类型分别为分解反应、化合反应、复分解反应,没有涉及置换反应,答案选C。 5.下列实验操作或装置错误的是 A. A B. B C. C D. D 【答案】A 【解析】 【详解】A.蒸馏时,温度计水银球应位于蒸馏烧瓶的支管口附近,用于测量馏分的温度,故A错误; B.过滤可用于分离不溶性固体和液体,装置图符合操作要求,故B正确; C.萃取后通过分液漏斗分离,装置图符合操作要求,故C正确; D.转移液体时要为防止液体飞溅,需通过玻璃棒引流,装置图符合操作要求,故D正确。 故答案A。 6.下列离子在溶液中可大量共存且溶液无色的是 A. Cu2+、SO42-、Fe3+、Cl- B. Fe2+、H+、ClO-、CO32- C. MnO4-、Al3+、Na+、SO42- D. Na+、NO3-、K+、SO42- 【答案】D 【解析】 【分析】 离子间如果不发生化学反应,则可以大量共存,结合离子的性质以及溶液无色分析。 【详解】A. Cu2+、Fe3+在溶液中均不是无色的,不能大量共存,A错误; B. Fe2+、H+、ClO-之间发生氧化还原反应,H+、CO32-之间发生复分解反应,均不能大量共存,B错误; C. MnO4-在溶液中不是无色的,不能大量共存,C错误; D. Na+、NO3-、K+、SO42-在溶液中不反应,且均是无色的,可以大量共存,D正确。 答案选D。 7.除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法均正确的一组是( ) 选项 待提纯的物质 选用的试剂 操作的方法 A CaO(CaCO3) 水 溶解、过滤、结晶 B Cu(CuO) 稀盐酸 溶解、过滤、洗涤、干燥 C CuSO4(H2SO4) 氢氧化钠溶液 过滤 D CO(H2) 氧气 点燃 A. A B. B C. C D. D 【答案】B 【解析】 试题分析:A.在混合物中加水后,氧化钙会与水反应生成氢氧化钙,而碳酸钙不会与水反应,这样除去了物质,剩下了杂质,故A错误;B.在混合物中加入盐酸,氧化铜会与盐酸反应而溶解,铜不会与盐酸反应,过滤后再进行洗涤、干燥即可得到铜,故B正确;C.混合物中加入氢氧化钠,氢氧化钠既会与硫酸反应,也会与硫酸铜反应,杂质除去了,物质也除去了,故C错误;D.一氧化碳可以在氧气中燃烧,将原物质除掉,故D错误.故选B。 考点:物质的分离、提纯和除杂。 8. 化学是一门以实验为基础的自然科学,掌握实验方法和必需的实验技能是学好化学的关键。下列实验所选用的仪器合理的是 ①用50mL量筒量取52mL稀硫酸 ②用分液漏斗分离乙醇和水的混合物 ③用托盘天平称量11.7g氯化钠晶体 ④配制250mL0.2mol/L的NaOH溶液选用250mL容量瓶 A. ①② B②③ B. ③④ C. ②④ 【答案】C 【解析】 试题分析:①用50mL量筒量最多可以量取50mL液体,因此不能量取52mL稀硫酸,错误;②乙醇能够以任意比溶于水,因此不能用分液漏斗分离乙醇和水的混合物,错误;③托盘天平精确度是0.1g,所以可以用托盘天平称量11.7g氯化钠晶体,正确;④容量瓶是准确配制一定体积一定物质的量浓度的溶液的仪器,故可以用250mL容量瓶配制250mL0.2mol/L的NaOH溶液,正确。故所选用的仪器合理的是③④,选项C正确。 [ 考点:考查化学仪器的使用正误判断的知识。 9.可以用离子方程式H++OH-=H2O来表示的化学反应是 A. 硫酸和Ca(OH)2溶液的反应 B. 盐酸和Cu(OH)2的反应 C. 醋酸和NaOH溶液的反应 D. 硫酸氢钠溶液和KOH溶液的反应 【答案】D 【解析】 【分析】 离子方程式H++OH-=H2O表示强酸和强碱反应生成可溶于水的盐和水的反应,如:盐酸和氢氧化钠、盐酸和氢氧化钡、硝酸和氢氧化钾等。 【详解】稀硫酸和Ca(OH)2溶液生成的硫酸钙是沉淀,硫酸钙不能拆成离子的形式,A错误;氢氧化铜是弱碱,在离子方程式中不能拆成离子的形式,B错误;醋酸是弱酸,在离子方程式中不能拆成离子的形式,C错误;NaHSO4溶液为强酸的酸式盐,书写时要拆写为H+,硫酸氢钠溶液和KOH溶液的反应生成硫酸钾和水,D正确。 故选D。 【点睛】本题考查离子反应方程式书写的正误判断,侧重复分解反应的离子反应考查,把握发生的反应及离子反应的书写方法为解答的关键,注意化学式的拆分是否正确。 10.下列说法中正确的是 A. 有单质参加或有单质生成的化学反应一定是氧化还原反应 B. 置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应 C. 氧化还原反应中的反应物不是氧化剂就是还原剂 D. 氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原 【答案】B 【解析】 【分析】 有元素化合价变化的反应为氧化还原反应;置换反应中一定存在元素的化合价变化,复分解反应中没有元素的化合价变化;氧化还原反应中的反应物,可能不是氧化剂,也不是还原剂;氧化还原反应中可能是一种元素即被氧化有被还原。 【详解】有元素化合价变化的反应为氧化还原反应,置换反应一定为氧化还原反应,同素异形体的转化中没有化合价变化,不属于氧化还原反应,A错误;置换反应中一定存在元素的化合价变化,如Zn与酸反应生成氢气,一定为氧化还原反应,复分解反应中没有元素的化合价变化,则凡是氧化还原反应,都不可能是复分解反应,B正确;氧化还原反应中的反应物,可能不是氧化剂,也不是还原剂,如氯气与NaOH溶液的反应中,NaOH为反应物,不是氧化剂也不是还原剂,C错误;氧化还原反应中,被氧化和被还原的元素可以是同一种元素,如碳与二氧化碳反应生成一氧化碳,被氧化和被还原的元素都是碳元素,D错误。 故选B。 【点睛】本题考查氧化还原反应,把握反应中元素的化合价变化和氧化还原反应与四种基本反应类型的关系为解答的关键。 11.化学实验时,必须十分重视安全和环保问题。下列操作方法不符合要求的是 A. 少量的浓硫酸溅到皮肤上时,应用大量的水冲洗并涂上3%~5%的NaHCO3溶液 B. 氢气还原氧化铜时为防止氢气损耗应该先加热后通氢气 C. 使用容量瓶、分液漏斗前,先检查是否漏水 D. 给试管中的液体加热时,沿试管倾斜方向不停移动试管或加入碎瓷片,以免液体暴沸伤人 【答案】B 【解析】 【详解】A.浓硫酸不慎沾在皮肤上,用大量水冲洗,然后再涂上3%~5%的NaHCO3溶液,操作合理,故A正确; B.氢气还原氧化铜时应先通氢气,排净装置内的空气,防止加热时发生爆炸,然后再加热,故B错误; C.带有活塞的仪器,为防止漏水,使用前必须检查是否漏液,故C正确; D.给试管中的液体加热时,应防止液体剧烈沸腾,则加热时不停沿试管倾斜方向移动试管或加入碎瓷片,以免液体暴沸伤人,故D正确; 答案选B。 【点睛】本题考查化学实验方案的评价,把握混合物分离提纯、实验操作、实验安全、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析。 12.下列图示中说法正确的是 A. A B. B C. C D. D 【答案】A 【解析】 试题分析:A.体现了Na的结构与性质,正确;B.元素的还原性的强弱与失去电子的多少无关,而与失去电子的难易有关,错误;Ca2+中原子的核外最外层已经达到8个电子的稳定结构,化合价是+2价,所以只能得到电子,表现氧化性,而没有还原性,错误;Fe2+中Fe元素的化合价是+2价,处于该元素的中间价态,既可以失去电子表现还原性,也可以得到电子表现氧化性,错误。 考点:考查图示法在表示微粒的性质的应用的知识。 13.下列反应的离子方程式书写正确的是 A. 硝酸银溶液与铜粉反应:Ag++Cu = Cu 2++Ag B. 稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ C. 铁与氯化铁溶液反应:Fe+2Fe3+=3Fe2+ D. 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ 【答案】C 【解析】 【详解】A.硝酸银溶液与铜粉发生置换反应,离子方程式应该是2Ag++Cu=Cu2++2 Ag,A错误; B.稀H2SO4与铁粉反应生成硫酸亚铁和氢气,离子方程式应该是Fe+2H+=Fe2++H2↑,B错误; C.铁与氯化铁溶液反应生成氯化亚铁:Fe+2Fe3+=3Fe2+,C正确; D.碳酸钙难溶,与盐酸反应的离子方程式为CaCO3+2H+=H2O+CO2↑+Ca2+,D错误。 答案选C。 14.在反应中,X元素的原子将电子转移给Y元素的原子,则下列说法正确的是 ①元素X被氧化 ②元素Y被氧化 ③元素X发生还原反应 ④元素Y发生还原反应 A. ①② B. ③④ C. ②③ D. ①④ 【答案】D 【解析】 【分析】 反应中,元素X的原子将电子转移给元素Y的原子,则X失去电子,Y得到电子,以此来解答。 【详解】反应中,元素X的原子将电子转移给元素Y的原子,X失去电子,Y得到电子,则元素X被氧化,发生氧化反应,①正确,③错误;元素Y被还原,发生还原反应,②错误,④正确;答案选D。 【点睛】本题考查氧化还原反应,明确还原剂失去电子、氧化剂得到电子即可解答,注重氧化还原的反应中基本概念的考查。 15.下列现象或应用不能用胶体的知识解释的是 A. 清晨,人们经常看到的阳光穿过茂密的树木枝叶所产生的美丽景象 B. 土壤表面积巨大且一般带负电,能吸收NH4+等营养离子,使土壤具有保肥能力 C. 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀 D. 水泥、冶金工厂常用高压电除去工厂烟尘,减少对空气的污染 【答案】C 【解析】 【分析】 气溶胶具有丁达尔现象;胶粒带电荷,能吸附带相反电荷的离子;红褐色沉淀是生成的氢氧化铁,不是胶体;烟尘属于气溶胶,胶体具有电泳性质。 【详解】阳光穿过茂密的树木枝叶所产生的美丽景象是胶体的丁达尔现象,和胶体性质有关,A正确;土壤胶粒带电荷,能吸附带相反电荷的离子,可用胶体的知识解释,B正确;在FeCl3溶液中滴加NaOH溶液出现红褐色沉淀,发生的是复分解反应,与胶体无关,C错误;烟尘属于气溶胶,用高压电除去工厂烟尘是应用了胶体的电泳性质,D正确。 故选C。 【点睛】本题考查胶体的性质,掌握胶体性质是丁达尔现象、电泳是解题关键。 16.设NA为阿伏加德罗常数的值,下列有关说法不正确的是 A. 常温下,48gO3和O2含有的氧原子数为3NA B. 1molOH-离子中含电子数目为10NA C. 0.5L0.2mol·L-1的NaCl溶液中含有的Na+数是0.1NA D. 33.6LCO中含有的原子数是3NA 【答案】D 【解析】 【详解】A.氧气和臭氧均是氧元素形成的不同单质,48gO3和O2含有的氧原子的物质的量是48g÷16g/mol=3mol,氧原子数目为3NA,故A正确; B.1个氢氧根离子含有10个电子,1molOH-离子中含电子数目为10NA,故B正确; C.0.5L0.2mol·L-1的NaCl溶液中含有氯化钠的物质的量为0.5L×0.2mol·L-1=0.1mol,含有的Na+数是0.1NA,故C正确; D.未告知气体所处的温度和压强,无法计算33.6LCO中含有的原子总数,故D错误; 答案选D。 17.下列溶液中的氯离子浓度与50 mL 0.1 mol·L-1AlCl3溶液中氯离子的浓度相等的是 A. 150 mL 0.1 mol·L-1 NaCl溶液 B. 75 mL 0.2 mol·L-1 NH4Cl溶液 C. 300 mL 0.1 mol·L-1 KCl溶液 D. 150 mL 0.1 mol·L-1 FeCl3溶液 【答案】D 【解析】 【分析】 根据化学式AlCl3可以知道0.1 mol·L-1AlCl3溶液中氯离子浓度为0.3 mol·L-1,结合各选项中化学式判断溶液中氯离子浓度,注意离子的浓度与溶液的体积无关,与物质的构成有关。 【详解】已知50 mL 0.1 mol·L-1氯化铝溶液中氯离子的浓度0.3 mol·L-1,则 A. 150 mL 0.1 mol·L-1 NaCl溶液中氯离子的浓度为0.1mol·L-1; B. 75 mL 0.2 mol·L-1 NH4Cl溶液中氯离子的浓度为0.2mol·L-1; C. 300 mL 0.1 mol·L-1 KCl溶液中氯离子的浓度为0.1mol·L-1; D. 150 mL 0.1 mol·L-1 FeCl3溶液中氯离子的浓度为0.3mol·L-1; 根据以上分析可知选项D正确,答案选D。 18.下列各项中的物质,能满足如图中阴影部分关系的 选项 ① ② ③ ④ A NaCl K2SO4 KCl (NH4)2SO4 B NaCl K2SO4 KCl NH4Cl C Na2SO4 K2SO4 KCl NH4Cl D Na2SO4 K2SO4 KCl (NH4)2SO4 A. A B. B C. C D. D 【答案】C 【解析】 【分析】 根据盐电离出的阴阳离子的种类分类即可。阳离子为钠离子的盐统称为钠盐;阳离子为钾离子的盐统称为钾盐;阳离子为铵根离子的盐统称为铵盐;阴离子为硫酸根离子的盐统称为硫酸盐;阴离子为氯离子的盐统称为盐酸盐。 【详解】A.①NaCl属于盐酸盐,不是硫酸盐,④(NH4)2SO4属于硫酸盐,不是盐酸盐,故A错误; B.①NaCl属于盐酸盐,不是硫酸盐,故B错误; C.各项均符合,故C正确; D.④(NH4)2SO4属于硫酸盐,不是盐酸盐,故D错误; 答案选C。 19.实验中需0.2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3·10H2O的质量分别是 A. 1000mL,57.2g B. 1000mL,28.6g C. 950 mL,54.3g D. 950mL,28.6g 【答案】A 【解析】 【分析】 由于容量瓶没有950mL规格,应用1000mL的容量瓶进行配制,然后根据m=cVM进行计算。 【详解】容量瓶没有950mL规格,应用1000mL的容量瓶进行配制,则m(Na2CO3·10H2O)=cVM=1L×0.2mol/L×286g/mol=57.2g,故选A。 【点睛】本题考查溶液的配制知识,注意实验室常用容量瓶的规格。 20.已知I-、Fe2+、SO2和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为H2O2查看更多