- 2021-07-08 发布 |
- 37.5 KB |
- 59页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021高考化学一轮复习专题3第2讲原电池化学电源课件苏教版
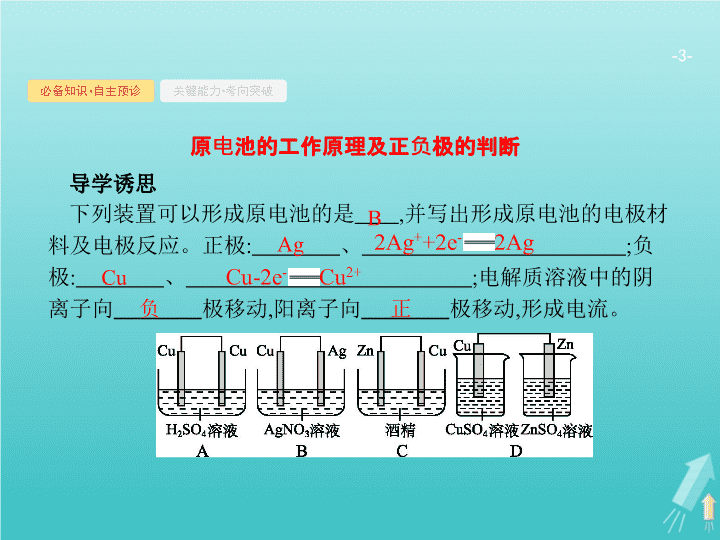
第 2 讲 原电池 化学电源 - 2 - 考纲要求 : 1 . 理解原电池的构成、工作原理及应用 , 能写出电极反应和总反应方程式。 2 . 了解常见化学电源的种类及其工作原理。 - 3 - 必备知识 • 自主预诊 关键能力 • 考向突破 导学诱思 下列装置可以形成原电池的是 , 并写出形成原电池的电极材料及电极反应。正极 : 、 ; 负极 : 、 ; 电解质溶液中的阴离子向 极移动 , 阳离子向 极移动 , 形成电流。 B Ag Cu 负 正 原电池的工作原理及正负极的判断 - 4 - 必备知识 • 自主预诊 关键能力 • 考向突破 落实基础 1 . 定义 原电池是将 转变为 的装置。 2 . 原电池的构成条件 化学能 电能 自发进行 石墨 电解质溶液 - 5 - 必备知识 • 自主预诊 关键能力 • 考向突破 3 . 原电池的工作原理 锌 Zn-2e - ═ Zn 2+ 氧化 铜 Cu 2+ +2e - ═ Cu 还原 锌 铜 负极 正极 Zn+Cu 2+ ═ Cu+Zn 2+ - 6 - 必备知识 • 自主预诊 关键能力 • 考向突破 × √ × √ × √ - 7 - 必备知识 • 自主预诊 关键能力 • 考向突破 考查角度一 原电池的工作原理 例 1 控制适合的条件 , 将反应 Fe 3+ +Ag Fe 2+ +Ag + 设计成如图所示的原电池 ( 盐桥装有琼脂 - 硝酸钾溶液 ; 灵敏电流计的 0 刻度居中 , 左右均有刻度 ) 。已知接通后 , 观察到电流计指针向右偏转。下列判断正确的是 ( ) A. 在外电路中 , 电子从石墨电极流向银电极 B. 盐桥中的 K + 移向乙烧杯 C. 一段时间后 , 电流计指针反向偏转 , 越过 0 刻度 , 向左边偏转 D. 电流计指针居中后 , 往甲烧杯中加入一定 量的铁粉 , 电流计指针将向左偏转 答案 解析 解析 关闭 Fe 3+ 发生得电子的还原反应 , 所以石墨电极为正极 , 电子从负极流向正极 , 阳离子从负极移向正极 ,A 、 B 选项错误 ; 达到化学平衡后 , 电流计指针指向 0 刻度 , 不会越过 ,C 选项错误 ;D 选项 , 铁粉与 Fe 3+ 反应生成 Fe 2+ , 溶液中 Fe 3+ 浓度减小 ,Fe 2+ 浓度增大 , 平衡左移 ,Ag + 发生得电子的反应 ,Ag 为正极 , 正确。 答案 解析 关闭 D - 8 - 必备知识 • 自主预诊 关键能力 • 考向突破 互动探究 (1) 把 A 选项改为 “ 在内电路中 , 电子从石墨电极流向银电极 ” 是否正确 ? 改为 “ 电流从石墨电极通过灵敏电流计到银电极 , 然后通过盐桥到石墨电极 ” 是否正确 ? (2) 把 B 选项中的 “K + ” 改为 “ ” 是否正确 ? 撤掉盐桥是否还能构成原电池 ? (3) 开始时 , 乙烧杯中发生的反应是 ( 填 “ 氧化反应 ” 或 “ 还原反应 ”) 。 答案 : (1) 不正确 ; 正确。 (2) 正确 ; 不能。 (3) 氧化反应。 - 9 - 必备知识 • 自主预诊 关键能力 • 考向突破 方法指导 我们在复习原电池的工作原理时要从两个方面进行分析。 (1) 闭合回路。 闭合回路包含两部分 : 导线中电子的流向和电解质溶液中阴、阳离子的流向 , 两部分共同构成一个完整的闭合回路。 ① 注意 : 无论在原电池还是在电解池中 , 电子均不能通过电解质溶液。 ② 导线中的电子 ( 带负电荷 ) 是从负极流向正极 , 而原电池内溶液中阴离子 ( 带负电荷 ) 是从正极流向负极 , 这样才能形成闭合回路。 (2) 氧化还原反应。 ① 负极 : 发生失电子的氧化反应 ; ② 正极 : 发生得电子的还原反应。 (3) 原电池的负极失去电子的总数等于正极得到电子的总数。 - 10 - 必备知识 • 自主预诊 关键能力 • 考向突破 考查角度二 原电池正、负极的判断 例 2 看图回答下列问题。 - 11 - 必备知识 • 自主预诊 关键能力 • 考向突破 (1) 上述四种原电池的装置中正极分别为 、 、 、 。 (2)B 装置中 a 孔通入的气体为 ( 填 “SO 2 ” 或 “O 2 ”) 。 (3)D 装置中发生氧化反应的一极为 ( 填 “a” 或 “b”) 。 答案 解析 解析 关闭 燃料在负极上发生反应 , 所以 A 装置中 a 为正极 ; 电子流出的一极为负极 , 故 B 装置中 b 为正极 , 正极上发生还原反应 , 通入氧化剂 O 2 ;C 装置中 Al 与 NaOH 溶液反应 , 所以 Al 失电子 ,Al 为负极 ,Mg 为正极 ;D 装置由阳离子 H + 的流向可知 b 为正极。 答案 解析 关闭 (1)a b Mg b (2)SO 2 (3)a - 12 - 必备知识 • 自主预诊 关键能力 • 考向突破 互动探究 C 装置中的 NaOH 溶液如果换成稀硫酸 , 则正极为 。 方法指导 判断原电池的正、负极需抓住闭合回路和氧化还原反应进行分析 , 如图 注意 : 原电池的正、负极与电极材料的性质有关 , 也与电解质溶液性质有关 , 不要形成思维定式 —— 活泼金属一定作负极。 Al - 13 - 必备知识 • 自主预诊 关键能力 • 考向突破 跟踪训练 1 .(2018 全国 Ⅱ ) 我国科学家研发了一种室温下 “ 可呼吸 ” 的 Na-CO 2 二次电池。将 NaClO 4 溶于有机溶剂作为电解液 , 钠和负载碳纳米管的镍网分别作为电极材料 , 电池的总反应为 :3CO 2 +4Na 2Na 2 CO 3 +C, 下列说法错误的是 ( ) 答案 解析 解析 关闭 答案 解析 关闭 - 14 - 必备知识 • 自主预诊 关键能力 • 考向突破 2 .(2019 江苏前黄高级中学高三模拟 ) 如图所示的装置属于原电池的是 ( ) 。 答案 解析 解析 关闭 装置 A 中不具备两个活泼性不同的电极 , 装置 C 中酒精是非电解质 , 不能构成原电池 , 装置 D 是电解池。 答案 解析 关闭 B - 15 - 必备知识 • 自主预诊 关键能力 • 考向突破 3 .(2019 江苏苏州大学附属中学模拟 ) 用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是 ( ) 。 A. 电子通过盐桥从乙池流向甲池 B. 铜导线替换盐桥 , 原电池将能继续工作 C. 开始时 , 银片上发生的反应是 Ag-e - ═ Ag + D. 将铜片浸入 AgNO 3 溶液中发生的化学反应与该原电池总反应相同 答案 解析 解析 关闭 原电池负极铜失电子 , 正极银得电子 , 电子从负极沿导线流向正极 , 电解质溶液通过离子的定向移动形成电流 , 所以电子不经过电解质溶液 , 故 A 错误 ; 铜线代替盐桥 , 乙池是原电池 , 甲池是电解池 , 所以不是原来的装置反应原理 , 故 B 错误 ; 银片是原电池的正极 , 溶液中的银离子得到电子发生还原反应 , 电极反应是 Ag + +e - ═ Ag, 故 C 错误 ; 铜片浸入 AgNO 3 溶液中发生的化学反应与该原电池总反应都是发生了 Cu+2Ag + ═ 2Ag+Cu 2+ , 故 D 正确。 答案 解析 关闭 D - 16 - 必备知识 • 自主预诊 关键能力 • 考向突破 4 .(2019 江苏南通中学高三模拟 ) 分析下图所示的四个原电池装置 , 其中结论正确的是 ( ) 。 A. ①② 中 Mg 作负极 , ③④ 中 Fe 作负极 B. ② 中 Mg 作正极 , 电极反应式为 2H 2 O+2e - ═ 2OH - +H 2 ↑ C. ③ 中 Fe 作负极 , 电极反应式为 Fe-3e - ═ Fe 3+ D. ④ 中 Cu 作正极 , 电极反应式为 2H + +2e - ═ H 2 ↑ 答案 解析 解析 关闭 答案 解析 关闭 - 17 - 必备知识 • 自主预诊 关键能力 • 考向突破 5 . 微生物电池是指在微生物的作用下将化学能转化为电能的装置 , 其工作原理如图所示。下列有关微生物电池的说法错误的是 ( ) A. 正极反应中有 CO 2 生成 B. 微生物促进了反应中电子的转移 C. 质子通过交换膜从负极区移向正极区 D. 电池总反应为 C 6 H 12 O 6 +6O 2 ==6CO 2 +6H 2 O 答案 解析 解析 关闭 C 6 H 12 O 6 中 C 的平均化合价为 0 价 , 二氧化碳中 C 的化合价为 +4 价 , 所以生成二氧化碳的反应为氧化反应 , 故 CO 2 在负极生成 ,A 项错误 ; 在微生物的作用下 , 该装置为原电池装置 , 反应速率加快 , 所以微生物促进了反应的发生 ,B 项正确 ; 质子交换膜只允许质子 ( 即 H + ) 通过 , 原电池中阳离子向正极移动 ,C 项正确 ; 电池的总反应实质是 C 6 H 12 O 6 的氧化反应 ,D 项正确。 答案 解析 关闭 A - 18 - 必备知识 • 自主预诊 关键能力 • 考向突破 原电池原理的应用 导学诱思 (1) 用稀硫酸与锌粒反应制取氢气 , 加入少量硫酸铜可以加快化学反应速率的原因 : 。 答案 : Zn 与 CuSO 4 反应生成 Cu, 在稀硫酸中形成铜锌原电池 , 可以增大反应速率 (2)A 、 B 两种金属用导线连接 , 放入稀硫酸中 ,B 的质量逐渐减小 , 则两种金属的活动性 :A ( 填 “>”“<” 或 “=”) B 。 < - 19 - 必备知识 • 自主预诊 关键能力 • 考向突破 落实基础 原电池在化工、农业生产及科学研究中的应用 1 . 加快氧化还原反应速率 一个自发的氧化还原反应 , 设计成原电池时反应速率 , 例如 Zn 与稀硫酸反应时加入少量的 CuSO 4 溶液能使产生氢气的速率增大。 2 . 比较金属活动性强弱 金属分别作原电池的两极时 , 一般作负极的金属活动性比正极的 。 3 . 用于金属的防护 使被保护的金属制品作原电池的 极而得到保护。例如 , 保护铁制输水管或钢铁桥梁 , 可用导线将其和一块锌块相连 , 使 Zn 作原电池的 极。 增大 强 正 负 - 20 - 必备知识 • 自主预诊 关键能力 • 考向突破 考查角度一 原电池原理的应用 例 1 已知电极材料 : 铁、铜、银、石墨、锌、铝 ; 电解质溶液 :CuCl 2 溶液、 NaOH 溶液、盐酸 , 按要求回答下列问题。 (1) 电工经常说的一句口头禅 :“ 铜接铝 , 瞎糊弄 ”, 所以电工操作上规定不能把铜导线与铝导线连接在一起使用 , 说明原因 : 。 (2) 通常说的燃料电池都以铂为电极 , 将燃烧反应的化学能转化为电能 , 在燃料电池中 , 可燃物在 极反应 , 在另一极反应。 (3) 请运用原电池原理设计实验 , 验证 Cu 2+ 、 Fe 3+ 氧化性的强弱。请写出电极反应 , 负极 , 正极 , 并在方框内画出实验装置图。 - 21 - 必备知识 • 自主预诊 关键能力 • 考向突破 - 22 - 必备知识 • 自主预诊 关键能力 • 考向突破 方法指导 设计制作化学电源 (1) 首先将氧化还原反应分成两个半反应。 (2) 根据原电池的反应特点 , 结合两个半反应找出正、负极材料和电解质溶液。电解质溶液一般要能够与负极发生反应 , 或者电解质溶液中溶解的其他物质能与负极发生反应 ( 如溶解于溶液中的氧气 ) 。但如果两个半反应分别在两个容器中进行 ( 中间连接盐桥 ), 则两个容器中的电解质溶液选择含有电极材料金属对应的金属阳离子的电解质溶液。如在 Cu - Zn - 硫酸盐溶液构成的原电池中 , 负极 Zn 浸泡在含有 Zn 2+ 的电解质溶液中 , 而正极 Cu 浸泡在含有 Cu 2+ 的电解质溶液中。 - 23 - 必备知识 • 自主预诊 关键能力 • 考向突破 考查角度二 判断金属活动性 例 2 ①②③④ 四种金属片两两相连浸入稀硫酸中都可组成原电池 : ①② 相连时 , 外电路电流从 ② 流向 ① ; ①③ 相连时 , ③ 为正极 ; ②④ 相连时 , ② 上有气泡逸出 ; ③④ 相连时 , ③ 的质量减少。据此判断这四种金属活动性由强到弱的顺序是 ( ) A. ①③②④ B. ①③④② C. ③④②① D. ③①②④ 答案 解析 解析 关闭 由原电池原理判断金属活动性 , 外电路电流从②流向① , ②为正极 , 金属活动性① > ② ; ①③相连 , ③为正极 , 金属活动性① > ③ ; ②④相连 , ②上有气泡 (H 2 ) 逸出 , ②为正极 , 金属活动性④ > ② ; ③④相连 , ③质量减少 , 则金属活动性③ > ④ , 即金属活动性顺序为① > ③ > ④ > ② ,B 正确。 答案 解析 关闭 B - 24 - 必备知识 • 自主预诊 关键能力 • 考向突破 考查角度三 新型化学电源 例 3 LiFePO 4 电池广泛用于电动车。电池反应 :FePO 4 +Li LiFePO 4 , 电池的正极材料是 LiFePO 4 , 负极材料是石墨 , 含 Li + 导电固体为电解质。下列说法正确的是 ( ) 答案 解析 解析 关闭 A 项 , 充电过程是电能转化为化学能的过程 , 错误 ;B 项 ,Li 属于活泼金属 , 加入磷酸 ,Li 会与磷酸反应 , 错误 ;C 项 , 根据原电池的工作原理 , 电子从负极经外电路流向正极 , 电子不通过电解质 , 错误 ;D 项 , 负极反应式为 Li-e - ==Li + , 迁移 n mol Li + , 说明通过的电子物质的量为 n mol, 即 Li 失去电子 n mol, 充电时 , 电池的负极接电源的负极 , 即阴极反应式为 Li + +e - ==Li, 正确。 答案 解析 关闭 D - 25 - 必备知识 • 自主预诊 关键能力 • 考向突破 方法指导 (1) 原电池反应中 , 两极材料本身不一定发生反应。如氢氧燃料电池中两极本身不参与反应 , 参与反应的是 H 2 和 O 2 。 (2) 可充电电池充电时应将可充电电池的负极接外电源的负极 , 正极接外电源的正极。 (3) 原电池放电时 , 正 、 负极质量有可能均增大 , 如铅蓄电池放电时正极 PbO 2 转化成 PbSO 4 、负极 Pb 转化成 PbSO 4 , 正、负极质量均增大。 - 26 - 必备知识 • 自主预诊 关键能力 • 考向突破 跟踪训练 1 .(2019 江苏如皋高三模拟 ) 等质量的两份锌粉 a 、 b, 分别加入过量的稀硫酸中 , 同时向 a 中滴入少量的 CuSO 4 溶液 , 如图表示产生 H 2 的体积 ( V ) 与时间 ( t ) 的关系 , 其中正确的是 ( ) 。 答案 解析 解析 关闭 等质量的两份锌粉 a 、 b, 分别加入过量的稀硫酸中 , 同时向 a 中放入少量的 CuSO 4 溶液 , 发生反应 :Zn+Cu 2+ ═ Zn 2+ +Cu, 形成原电池 , 反应速率增大 , 反应用时少于 b, 但生成的氢气也少于 b, 图像应为 D 。 答案 解析 关闭 D - 27 - 必备知识 • 自主预诊 关键能力 • 考向突破 2 . 能量之间可相互转化 : 电解食盐水制备 Cl 2 是将电能转化为化学能 , 而原电池可将化学能转化为电能。设计两种类型的原电池 , 探究其能量转化效率。 限选材料 :ZnSO 4 (aq),FeSO 4 (aq),CuSO 4 (aq); 铜片 , 铁片 , 锌片和导线。 (1) 完成原电池甲的装置示意图 ( 如图 ), 并作相应标注。要求 : 在同一烧杯中 , 电极与溶液含相同的金属元素。 - 28 - 必备知识 • 自主预诊 关键能力 • 考向突破 (2) 以铜片为电极之一 ,CuSO 4 (aq) 为电解质溶液 , 只在一个烧杯中组装原电池乙 , 工作一段时间后 , 可观察到负极 。 (3) 甲、乙两种原电池中可更有效地将化学能转化为电能的是 , 其原因是 。 (4) 根据牺牲阳极的阴极保护法原理 , 为减缓电解质溶液中铁片的腐蚀 , 在限选材料中应选 作阳极。 - 29 - 必备知识 • 自主预诊 关键能力 • 考向突破 答案 : (1) (2) 金属逐渐溶解 (3) 甲 甲电池 ( 使用盐桥 ) 可以避免锌和铜离子的接触 , 从而避免能量损失 , 提高电池效率 , 提供稳定的电流 (4)Zn - 30 - 必备知识 • 自主预诊 关键能力 • 考向突破 解析 : (1) 因为题给图中电子流向为从左到右 , 故左 侧为原电池的负极 , 右侧为正极 ; 所以设计原电池 时可以在左侧烧杯内盛放 ZnSO 4 (aq), 电极选用锌 片 , 右侧烧杯内 盛 放 CuSO 4 (aq), 电极选用铜片。 (2) 由所给的电极材料可知 , 当铜片作电极时 , 铜片 一定是正极 , 则负极是活泼的金属 ( 失电子发生氧 化反应 ), 反应的现象是负极 金属 逐渐溶解。 (3) 以 Zn 和 Cu 作电极为例 , 如果不用盐桥 , 则除了发生电化学反应外 , 还会使 Zn 和 CuSO 4 直接反应 , 不能转化为电能 , 而盐桥的使用 , 可以避免 Zn 和 Cu 2+ 的接触 , 从而避免电量损失 , 提高电池效率 , 提供稳定的电流。 (4) 根据牺牲阳极的阴极保护法 , 可知被保护的金属作阴极 , 比其活泼的金属作阳极 , 即应选 Zn 作为阳极。 - 31 - 必备知识 • 自主预诊 关键能力 • 考向突破 常见的化学电源 导学诱思 1 . 氢氧燃料电池以 KOH 溶液作电解质溶液时 , 工作一段时间后 , 电解质溶液的浓度将 ( 填 “ 增大 ”“ 减小 ” 或 “ 不变 ”, 下同 ), 溶液的 pH 。 2 . 氢氧燃料电池以 H 2 SO 4 溶液作电解质溶液时 , 工作一段时间后 , 电解质溶液的浓度将 , 溶液的 pH 。 减小 减小 减小 增大 - 32 - 必备知识 • 自主预诊 关键能力 • 考向突破 落实基础 1 . 一次电池 只能使用 , 不能充电复原继续使用。 一次 Zn-2e - ═ Zn 2+ 2MnO 2 +H 2 ═ Mn 2 O 3 +H 2 O - 33 - 必备知识 • 自主预诊 关键能力 • 考向突破 Zn+2OH - -2e - ═ Zn(OH) 2 2MnO 2 +2H 2 O+2e - ═ 2MnOOH+2OH - - 34 - 必备知识 • 自主预诊 关键能力 • 考向突破 2 . 二次电池 铅蓄电池是最常见的二次电池 , 总反应为 - 35 - 必备知识 • 自主预诊 关键能力 • 考向突破 3 . 燃料电池 将化学能直接转化为电能的装置。 (1) 氢氧燃料电池 ( 总反应式 :2H 2 +O 2 ═ 2H 2 O) H 2 -2e - ═ 2H + O 2 +4e - +4H + ═ 2H 2 O H 2 -2e - +2OH - ═ 2H 2 O O 2 +4e - +2H 2 O ═ 4OH - H 2 -2e - +O 2- ═ H 2 O O 2 +4e - ═ 2O 2- - 36 - 必备知识 • 自主预诊 关键能力 • 考向突破 (2) 乙醇 — 氧气燃料电池 C 2 H 5 OH-12e - +3H 2 O ═ 2CO 2 ↑+12H + C 2 H 5 OH-12e - +6O 2- ═ 2CO 2 ↑+3H 2 O - 37 - 必备知识 • 自主预诊 关键能力 • 考向突破 考查角度一 一次电池 例 1 (2019 江苏海安高级中学高三模拟 ) 普通锌锰干电池的简图如图所示 , 它是用锌皮制成的锌筒作电极兼做容器 , 中央插一根石墨棒 , 石墨棒顶端加一铜帽。在石墨棒周围填满二氧化锰和炭黑的混合物 , 并用离子可以通过的长纤维纸包裹作隔膜 , 隔膜外是用氯化锌、氯化铵和淀粉等调成糊状作电解质溶液 ; 该电池工作时的总反应的离子方程式可表示为 。关于锌锰干电池的下列说法中正确的是 ( ) 。 - 38 - 必备知识 • 自主预诊 关键能力 • 考向突破 干电池示意图 A. 当该电池电压逐渐下降后 , 利用电解原理能重新充电复原 B. 电池正极的电极反应式为 C. 电池工作时 , 电子由正极通过外电路流向负极 D. 外电路中每通过 0.1 mol 电子 , 锌的质量理论上减小 6.5 g 答案 解析 解析 关闭 答案 解析 关闭 - 39 - 必备知识 • 自主预诊 关键能力 • 考向突破 考查角度二 二次电池 例 2 (2019 江苏南京、盐城高三模拟 ) 最近我国科学家发明 “ 可充电钠 — 二氧化碳电池 ”( 如图 ), 放电时电池总反应为 4Na+3CO 2 ═ 2Na 2 CO 3 +C 。下列说法错误的是 ( ) 。 A. 充电时 , 钠箔与外接电源的负极相连 B. 电池工作温度可能在 200 ℃ 以上 C. 放电时 ,Na + 向正极移动 D. 放电时 , 正极的电极反应为 4Na + +3CO 2 +4e - ═ 2Na 2 CO 3 +C 答案 解析 解析 关闭 由放电时的化学方程式可知 , 钠箔作负极 , 故充电时作阴极 , 与电源的负极相连 ,A 正确 ; 四甘醇、二甲醚都易挥发 , 钠的熔点低 , 故电池工作的温度不能太高 ,B 错误 ; 放电时阳离子向正极移动 ,C 正确 ; 放电时正极上 CO 2 得电子生成 C,D 正确。 答案 解析 关闭 B - 40 - 必备知识 • 自主预诊 关键能力 • 考向突破 考查角度三 燃料电池 例 3 (2019 江苏盐城第一中学高三模拟 ) 直接甲醇燃料电池 (DMFC) 有望取代传统电池 , 它主要由阴极极板、阳极极板和膜电极构成 , 其中膜电极包括质子膜、催化剂层和气体扩散层 ( 如图 ) 。下列关于 DMFC 工作原理的叙述正确的是 ( ) 。 A. 通入 O 2 的电极反应式为 O 2 +4e - +2H 2 O ═ 4OH - B. 电池内部 H + 由正极渗过交换膜向负极移动 C. 甲醇在正极发生反应 , 电流经过外电路流向负极 D. 注入 CH 3 OH 的电极反应式为 CH 3 OH+H 2 O-6e - ═ CO 2 ↑+6H + 答案 解析 解析 关闭 电解质溶液显酸性 , 通入氧气的电极反应式为 O 2 +4e - +4H + ═ 2H 2 O, 故 A 错误 ; 原电池工作时阳离子向正极移动 , 故 B 错误 ; 甲醇被氧化 , 应为负极反应 , 故 C 错误 ; 注入甲醇的一极为负极 , 负极电极反应式为 CH 3 OH+H 2 O-6e - ═ CO 2 ↑+6H + , 故 D 正确。 答案 解析 关闭 D - 41 - 必备知识 • 自主预诊 关键能力 • 考向突破 方法指导 (1) 燃料电池的电极不参与反应 , 有很强的催化活性 , 起导电作用。 (2) 书写燃料电池的电极反应时 , 要注意溶液的酸碱性 , 介质的酸碱性对半反应及总反应书写的影响。 - 42 - 必备知识 • 自主预诊 关键能力 • 考向突破 跟踪训练 1 . 被称为 “ 软电池 ” 的纸质电池 , 采用一个薄层纸片 ( 在其一边镀锌 , 在其另一边镀二氧化锰 ) 作为传导体。在纸内的离子 “ 流过 ” 水和氧化锌组成的电解液。电池总反应为 Zn+2MnO 2 +H 2 O ═ ZnO+ 2MnOOH 。下列说法正确的是 ( ) 。 A. 该电池的正极为锌 B. 该电池反应中二氧化锰起催化剂作用 C. 当 0.1 mol Zn 完全溶解时 , 流经电解液的电子个数约为 1.204×10 23 D. 电池正极反应式为 MnO 2 +e - +H 2 O ═ MnOOH+OH - 答案 解析 解析 关闭 A 项 , 由电池反应知 ,Zn 元素化合价由 0 价变为 +2 价 ,Zn 失电子作负极 , 错误 ; B 项 , 该电池中二氧化锰参加反应且作氧化剂 , 错误 ;C 项 , 电子不进入电解质溶液 , 电解质溶液导电是通过离子定向移动形成电流 , 错误 ;D 项 , 正极上二氧化锰得电子发生还原反应 , 电极反应式为 MnO 2 +e - +H 2 O ═ MnOOH +OH - , 正确。 答案 解析 关闭 D - 43 - 必备知识 • 自主预诊 关键能力 • 考向突破 答案 解析 解析 关闭 答案 解析 关闭 - 44 - 原电池电极反应式的书写 原电池电极反应式的书写是近几年高考的重点 , 也是难点 , 出题形式常常给出信息让我们书写一些不常见的电极反应式 , 同学们在复习本部分知识时 , 一定不要死记硬背一些电极反应式 , 而要掌握方法 , 这样才能以不变应万变。 - 45 - 1 . 原电池电极反应式的书写 书写电极反应式时 , 首先要根据原电池的工作原理准确判断正、负极 , 然后结合电解质溶液的环境确定电极产物 , 最后再根据质量守恒和电荷守恒写出反应式。电极反应式书写的一般方法有 : (1) 拆分法 a. 写出原电池的总反应 , 如 2Fe 3+ +Cu ═ 2Fe 2+ +Cu 2+ 。 b. 把总反应按氧化反应和还原反应拆分为两个半反应 , 注明正、负极 , 并依据质量守恒、电荷守恒及电子得失守恒配平两个半反应 : 正极 :2Fe 3+ +2e - ═ 2Fe 2+ 负极 :Cu-2e - ═ Cu 2+ - 46 - (2) 加减法 a. 写出总反应 , 如 Li+LiMn 2 O 4 ═ Li 2 Mn 2 O 4 。 b. 写出其中容易写出的一个半反应 ( 正极或负极 ), 如 Li-e - ═ Li + 。 c. 利用总反应式与上述的一极反应式相减 , 即得另一个电极的反应式 , 即 LiMn 2 O 4 +Li + +e - ═ Li 2 Mn 2 O 4 。 - 47 - 2 . 燃料电池电极反应式的书写 第一步 : 写出燃料电池反应的总反应式。 燃料电池的总反应与燃料的燃烧反应一致 , 若产物能与电解质反应则总反应为加和后的反应。 如甲烷燃料电池 ( 电解质为 NaOH 溶液 ) 的反应式为 CH 4 +2O 2 ═ CO 2 +2H 2 O ① CO 2 +2NaOH ═ Na 2 CO 3 +H 2 O ② ① 式 + ② 式得燃料电池总反应式为 CH 4 +2O 2 +2NaOH ═ Na 2 CO 3 +3H 2 O 。 - 48 - 第二步 : 写出电池的正极反应式。 根据燃料电池的特点 , 一般在正极上发生还原反应的物质是 O 2 , 随着电解质溶液的不同 , 其电极反应式有所不同 , 大致有以下四种情况 : (1) 酸性电解质溶液环境下电极反应式为 O 2 +4H + +4e - ═ 2H 2 O; (2) 碱性电解质溶液环境下电极反应式为 O 2 +2H 2 O+4e - ═ 4OH - ; (3) 固体电解质 ( 高温下能传导 O 2- ) 环境下电极反应式为 O 2 +4e - ═ 2O 2- ; (4) 熔融碳酸盐 ( 如熔融 K 2 CO 3 ) 环境下电极反应式为 - 49 - 第三步 : 根据电池总反应式和正极反应式 , 写出负极反应式。 电池反应的总反应式 - 电池正极反应式 = 电池负极反应式。因为 O 2 不是负极反应物 , 因此两个反应式相减时要彻底消除 O 2 。 - 50 - 3 . 原电池中电极反应式书写的一般步骤 - 51 - 4 . 分析实验现象、判断电极反应式的正误 分析电极及电极区的 pH 及实验现象时 , 要从电极反应式入手 ; 分析电解质溶液的 pH 及实验现象时 , 要从电池反应式入手。 - 52 - 例 1 (1) 铅蓄电池放电时的电池反应为 PbO 2 +Pb+2H 2 SO 4 ═ 2PbSO 4 +2H 2 O, 请写出铅蓄电池的正极反应式 : 。 (2) 某新型铝 — 空气燃料电池以铝为负极 , 在正极通入空气 , 若以 NaCl 溶液或 NaOH 溶液为电解质溶液 , 放电时正极反应式都为 O 2 +2H 2 O+4e - ═ 4OH - 。若以 NaCl 溶液为电解质溶液 , 则总反应为 。 - 53 - 例 2 某新型铝 - 空气燃料电池 , 以铝合金为负极 , 在正极通入空气 , 若以 NaCl 溶液或 NaOH 溶液为电解质溶液。下列说法正确的是 ( ) 答案 解析 解析 关闭 答案 解析 关闭 - 54 - 对点训练 1 . 锂 - 空气电池放电时的工作原理如图所示。下列叙述正确的是 ( ) A. 放电时 Li + 由 B 极向 A 极移动 B. 电池放电反应为 4Li+O 2 +2H 2 O==4LiOH C. 正极反应式为 O 2 +4H + +4e - ==2H 2 O D. 电解液 a 可以为 LiCl 溶液 答案 解析 解析 关闭 A 项 , 在原电池中 ,A 是负极 ,B 是正极 , 阳离子由 A 极向 B 极移动 ,A 错误 ;B 项 , 原电池放电反应为自发氧化还原反应 , 即 4Li+O 2 +2H 2 O==4LiOH,B 正确 ;C 项 , 正极上是氧气得电子的还原反应 , 由于从电解液 b 中可回收 LiOH, 故电解液 b 不能是酸性溶液 ,C 错误 ;D 项 , 金属锂可以和水发生反应 , 电解液 a 中不能含有水 ,D 错误。 答案 解析 关闭 B - 55 - 2. 某实验小组同学对电化学原理进行了一系列探究活动。 (1) 如图为某实验小组依据氧化还原反应 :( 用离子方程式表示 ) 设计的原电池装置 , 反应前电极质量相等 , 一段时间后 , 两电极质量相差 12 g, 导线中通过 mol 电子。 - 56 - (2) 其他条件不变 , 若将 CuCl 2 溶液换为 NH 4 Cl 溶液 , 石墨电极反应式为 , 这是由于 NH 4 Cl 溶液显 ( 填 “ 酸性 ”“ 碱性 ” 或 “ 中性 ”), 用离子方程式表示溶液显此性质的原因 , 用吸管吸出铁片附近溶液少许置于试管中 , 向其中滴加少量新制饱和氯水 , 写出发生反应的离子方程式 , 然后滴加几滴硫氰化钾溶液 , 溶液变红 , 继续滴加过量新制饱和氯水 , 颜色褪去 , 同学们对此做了多种假设 , 某同学的假设是 “ 溶液中的 +3 价铁被氧化为更高的价态。 ” 如果 +3 价铁被氧化为 , 试写出该反应的离子方程式 。 - 57 - (3) 如图其他条件不变 , 若将盐桥换成弯铜导线与石墨相连成 n 型 , 如图所示。 一段时间后 , 在甲装置铜丝附近滴加酚酞溶液 , 现象是 , 电极反应式为 ; 乙装置中石墨 (1) 为 ( 填 “ 正 ”“ 负 ”“ 阴 ” 或 “ 阳 ”) 极 , 乙装置中与铜丝相连石墨电极上发生的反应式为 , 产物常用 检验 , 反应的离子方程式为 。 - 58 - - 59 -查看更多