- 2021-07-08 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版高二化学第二节 化学平衡 第二课时 (图像问题)课件
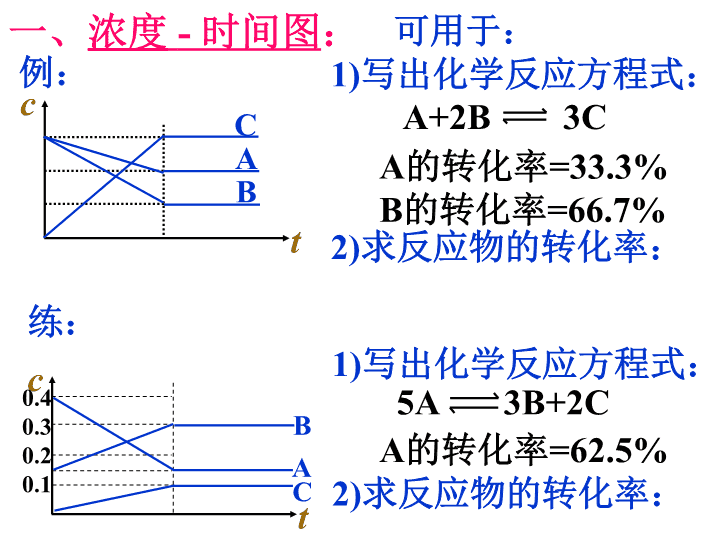
第二节 化学平衡 第二课时 ( 图像问题 ) 二、化学平衡的定量特征 可逆反应达到化学平衡状态时有哪些 定性特征? 化学平衡状态的定性特征能否用定量形式表达出来呢?或者有无定量特征? 自学课本 p38~39 相关内容。同学间相互讨论解决这个问题。 一、 浓度 - 时间图 : t c C A B 可用于: 1) 写出化学反应方程式: 2) 求反应物的转化率: A+2B 3C A 的转化率 =33.3% B 的转化率 =66.7% A B C t c 0.4 0.3 0.2 0.1 1) 写出化学反应方程式: 2) 求反应物的转化率: 例: 练: 5A 3B+2C A 的转化率 =62.5% 二、速度 - 时间图: 可用于: 1) 已知引起平衡移动的因素,判断反应是吸热或放热,反应前后气体体积的变化。 2) ( 已知反应 ) 判断引起平衡移动的因素。 t v v 正 v 逆 t 1 t 2 • 引起平衡移动的因素是 ,平衡 将向 方向移动。 增大反应物浓度 正 t v v 正 v 逆 t 1 t 2 • 引起平衡移动的因素是 ,平衡 将向 方向移动。 减小生成物浓度 正 二、速度 - 时间图: • 已知对 某一 平衡改变温度时有如下图变化,则温度的变化是 ( 升高或降低 ) ,平衡向 反应方向移动,正反应是 热反应。 t 1 t 2 t v v 正 v 逆 升高 正 吸 • 若 对一正 反应吸热的可逆反应平衡后降低温度,画出平衡移动过程中的 v - t 图。 t 1 t 2 t v v 逆 v 正 二、速度 - 时间图: • 对于 mA (g) +nB (g ) pC (g) +qD (g ) , 改变压强时有如下图变化,则压强变化是 ( 增大或减小 ) ,平衡向 反应方向移动, m+n (> 、 < 、 =)p+q 。 v 逆 t 1 t 2 t v v 正 增大 逆 < • 若对以上反应已知 m+n>p+q , 平衡后降低压强时,画出相关的 v – t 图。 t 1 t 2 t v v 逆 v 正 二、速度 - 时间图: v 逆 t 1 t 2 t v v 正 • 对于反应 A (g) +3B (g) 2C (g) +D (g) ( 正 反应放热 ) 有如下图所示的变化,请分析引起平衡移动的因素可能是什么?并说明理由。 由于 v 正 、 v 逆 均有不同程 度的增大,引起平衡移动 的因素可能是 a . 升高温度 b. 增大压强 。根据反应方 程式,升高温度平衡向逆反应方向移动,与图示相符;增大压强平衡向正反应方向移动,与图示不相符。故此题中引起平衡移动的因素是升高温度。 • 对于反应 mA (g) +nB (g ) pC (g) +qD (g ) 有如下图所示的变化,请分析 t 1 时的改变因素可能是什么?并说明理由。 二、速度 - 时间图: v 逆 t 1 t v v 正 由于 v 正 、 v 逆 相同程 度的增大, t 1 时的改变因素可能是 a . 加入 ( 正 ) 催化剂 b. 当 m+n = p+q 时增大压强 。平衡没有移动。 三、某物质的转化率 ( 或百分含量 )- 时间 - 温度 ( 或压强 ) 图: t A 的转化率 T 1 T 2 • 对于反应 mA (g) +nB (g ) pC (g) +qD (g ) • 正反应吸热 t B 的转化率 P 1 P 2 • m+n查看更多
相关文章
- 当前文档收益归属上传用户