- 2021-07-08 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
西藏拉萨中学2019-2020学年高一下学期期中考试化学试题
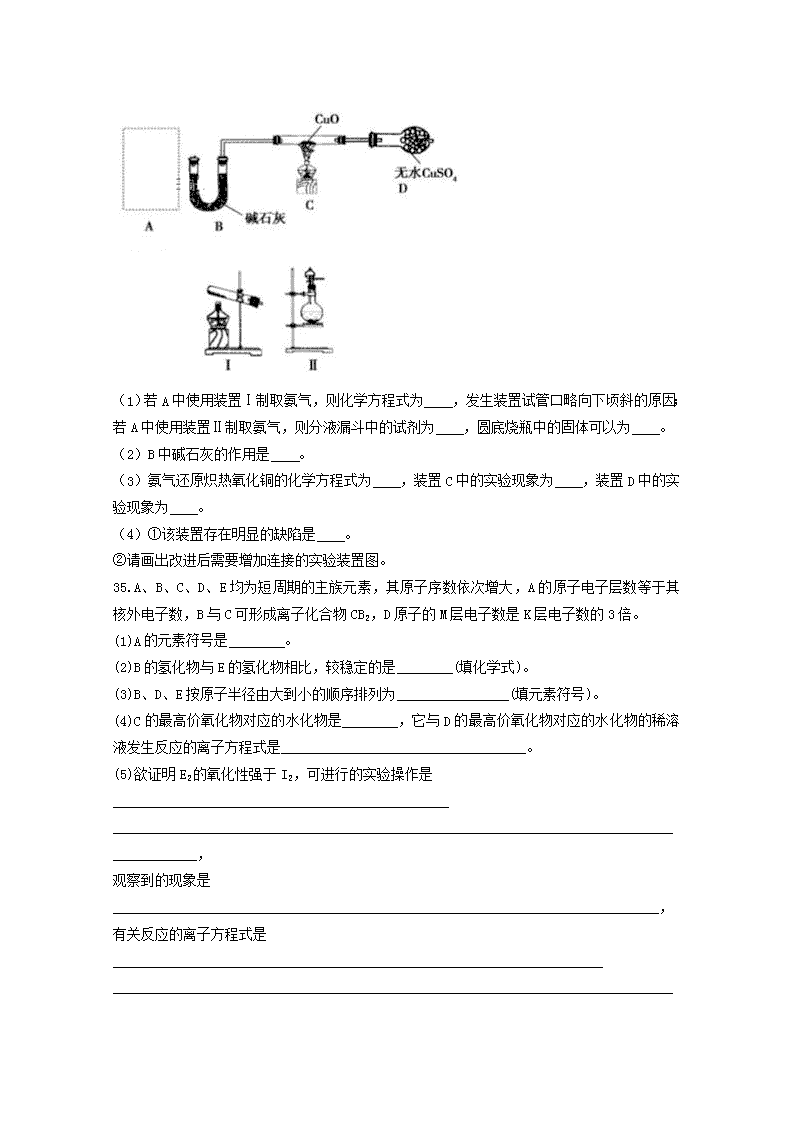
www.ks5u.com 理科综合试卷 (满分:300分,考试时间:150分钟。请将答案填写在答题卡上) 注意事项: 1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。 2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。 3.考试结束后,将本试卷和答题卡一并交回。 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Fe 56 I 127 Ag 108 K 39 Cr 52 Ba 137 Cu 64 Br 80 Zn 65 一、选择题 9.化学与环境密切相关,下列有关说法错误的是( ) A. NO2、NO含氮氧化物是光化学烟雾的主要污染物 B. 对酸性物质的排放加以控制,开发新清洁能源是减少酸雨的有效措施 C. CO2、NO2或SO2都会导致酸雨的形成 D. 大气中CO2含量的增加会导致温室效应加剧 10.下列关于硅及其化合物的叙述正确的是( ) A. 硅晶体可用于制造光导纤维 B. 陶瓷、玻璃、水泥都是硅酸盐产品 C. 二氧化硅在电子工业中是重要的半导体材料 D. 二氧化硅与氢氟酸和氢氧化钠均能反应,属于两性氧化物 11.用氯气消毒的自来水配制下列溶液时,会使配得的溶液变质的是( ) ①NaOH ②AgNO3 ③Na2CO3 ④NaBr ⑤FeCl2 A. 只有②④ B. 只有④⑤ C. 只有②④⑤ D. 全部 12.下列关于卤族元素的叙述正确的是(用X表示卤素原子)( ) A. 随核电荷数的增加,X-的半径逐渐增大,还原性逐渐减弱 B. 随核电荷数的增加,氢化物的稳定性逐渐增强 C. 单质与水反应均可表示为X2+H2O===HX+HXO D. 随核电荷数的增加,单质的颜色逐渐加深 13.短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( ) A. Be、Na、Al B. C、Al、P C. B、Mg、Si D. O、P、Cl 14.下列4种微粒中,半径按由大到小的顺序排列的是( ) ① ② ③ ④ A.①>②>③>④ B.③>④>①>② C.③>①>②>④ D.①>②>④>③ 15.下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( ) A.答案A B.答案B C.答案C D.答案D 16.短周期元素X、Y、Z、W的原子序数依次增大。X的原子半径比Y的小,且X与Y的最外层电子数之和等于Z的最外层电子数。X与W同主族,Z是地壳中含量最高的元素。下列说法不正确的是( ) A. 原子半径的大小顺序:r(W)>r(Y)>r(Z)>r(X) B. 元素Z、W的简单离子的电子层结构相同 C. 元素Y的简单气态氢化物的热稳定性比Z的强 D. X、Y两种元素可形成分别含有10e-和18e-的化合物 二、选择题:本题共8小题,每小题5分,共40分。在每小题给出的四个选项中,第17~21 34.某课外小组同学设计如图实验装置(部分夹持仪器未画出)探究氨气的还原性并检验部分产物。 (1)若A中使用装置Ⅰ制取氨气,则化学方程式为 ,发生装置试管口略向下顷斜的原因;若A中使用装置Ⅱ制取氨气,则分液漏斗中的试剂为 ,圆底烧瓶中的固体可以为 。 (2)B中碱石灰的作用是 。 (3)氨气还原炽热氧化铜的化学方程式为 ,装置C中的实验现象为 ,装置D中的实验现象为 。 (4)①该装置存在明显的缺陷是 。 ②请画出改进后需要增加连接的实验装置图。 35.A、B、C、D、E均为短周期的主族元素,其原子序数依次增大,A的原子电子层数等于其核外电子数,B与C可形成离子化合物CB2,D原子的M层电子数是K层电子数的3倍。 (1)A的元素符号是________。 (2)B的氢化物与E的氢化物相比,较稳定的是________(填化学式)。 (3)B、D、E按原子半径由大到小的顺序排列为________________(填元素符号)。 (4)C的最高价氧化物对应的水化物是________,它与D的最高价氧化物对应的水化物的稀溶液发生反应的离子方程式是___________________________________。 (5)欲证明E2的氧化性强于I2,可进行的实验操作是________________________________________________ ____________________________________________________________________________________________, 观察到的现象是______________________________________________________________________________, 有关反应的离子方程式是______________________________________________________________________ ____________________________________________________________________________________________。 36.现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三分子中含相同数目的质子数,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图所示: (1)写出B+乙―→甲+C的化学反应方程式_____________________________________________________ _________________________________________________________。 (2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是________。(填序号) ①A ②B ③C ④D (3)依据下列条件可以进一步确定上述第四种元素: ①甲与丙以及乙与丙均能够发生反应,②甲、丙都是无色、有刺激性气味的物质。 据此,请回答下列问题: 写出上述第四种元素在周期表中的位置________。 写出C+丙―→乙+丁的化学反应方程式________________________________________________________。 37. 某课外活动小组利用下列化学反应在实验室中制备氯气,并进行有关氯气性质的研究。 MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (1)该小组同学欲用图1所示仪器及试剂(不一定全用)制备并收集纯净、干燥的氯气。 ①应该选择的仪器是________(填字母)。 ②将各仪器按先后顺序连接起来,应该是:a接________,________接________,________接________,________接h(用导管口处的字母表示)。 ③浓盐酸与二氧化锰反应的离子方程式为_______________________________________________________ ________________________________________________________________________。 (2)该小组同学设计并分别利用图2和图3所示装置探究氯气的氧化性。 ①G中的现象是________,原因是__________________(用化学方程式表示)。 ②H中的现象是__________________。 38.(每空2分,共18分)细胞的一生通常要经历生长、分裂、分化、衰老和凋亡过程,有时也发生癌变和坏死。回答下列与细胞生命历程有关的问题: (1)在探究细胞大小与物质运输关系的模拟实验中,单位时间内,NaOH扩散的深度模拟_______________,NaOH扩散的体积与总体积的比值模拟_________________________________________________________。 (2)在有丝分裂过程中,中心体的倍增和核内DNA数目的加倍 (填“是”或“否”)发生在同一时期。 (3)细胞分化使多细胞生物体中的细胞趋向于____________,有利于提高各种生理功能的效率。同一植株的叶肉细胞、表皮细胞和贮藏细胞的功能各不相同,根本原因是________________________________。 (4)老年人的头发会发白与衰老细胞的哪一特征有关____________。细胞凋亡又被称为细胞__________,是由基因决定的细胞自动结束生命的过程。 (5)环境中的致癌因子会损伤细胞中的DNA分子,使_______________和_______________发生突变,导致正常细胞的生长和分裂失控而变成癌细胞。 39.(每空2分,共20分)图甲是真核细胞中能够进行的某些代谢过程简图,图乙是在CO2浓度一定、环境温度为25 ℃、不同光照强度下测得的小麦叶片的光合作用强度。请据图分析回答问题: (1)图甲中①②③生理过程在细胞内进行的场所分别是_____________________、_____________________、______________________。 (2)图甲中过程④__________(填“能”或“不能”)发生在人体细胞中。 (3)在图乙中B点时,叶肉细胞中产生ATP的场所有_______________。C点时,该植物的总光合速率为_______________mg·dm-2叶·h-1(用CO2吸收量表示)。 (4)当植物缺镁时(其他外界条件不变),图乙中的B点将__________(填“左移”或“右移”)。 (5)此实验中小麦植株进行光合作用和呼吸作用的最适温度分别为25 ℃和30 ℃,C点影响光合速率的外界因素是______________________________;可能的内部因素是_______________(答一种即可)。若将实验中的温度25 ℃改为30 ℃,图乙中的B点将______(填“左移”或“右移”)。 40.(每空1分,共8分)如图是某种生物细胞的亚显微结构示意图,据图回答: (1)图中[2]的主要成分是_______________,与其形成有关的细胞器是[ ]______________。 (2)若该细胞是西瓜的红色果肉细胞,则色素主要存在于[ ]_____________。 (3)细胞进行生命活动所需的能量主要由[ ]_______________供给。 (4)如果该细胞是低等植物细胞,则图中还应该有的细胞器是______________。 41.(每空2分,共14分)图1表示细胞分裂的不同时期每条染色体上DNA含量的变化;图2表示处于有丝分裂不同时期的细胞图像;图3表示有丝分裂过程中某一时期染色体、染色单体和DNA的关系。据图回答问题: (1)图1中,AB段形成的原因是______________________________,CD段形成的原因_______________。 (2)图2中_______________细胞处于图1中的BC段。请用文字和箭头对图2中的细胞图像进行正确的时间排序______________________________。 (3)图3对应图1中___________段的某一时期,观察染色体的最佳时期是图2中的___________图。观察有丝分裂过程的实验不能选择高度分化的体细胞为实验材料,因为_________________________________。 生物 答案 一、 选择题(每题6分,共40分) 1.B 2. D 3. C 4. D 5. C 6. C 7. B 8.D 二.非选择题(共60分) 1. (每空2分,共18分) (1)物质运输(扩散) 物质运输(扩散)效率 (2) 是 (3) 专门化 基因选择性表达 (4)多种酶(酪氨酸酶)的活性降低 编程性死亡 (5) 原癌基因 抑癌基因 2. (每空2分,共20分) (1) 叶绿体 细胞质基质和线粒体 细胞质基质 (2) 不能 (3) 细胞质基质和线粒体、叶绿体 20 (4) 右移 CO2浓度 (5) 酶的数量或叶绿体的数量或光合色素含量或C5 数量等 右移 3. (每空1分,共8分) (1) 纤维素和果胶 (2) 5 高尔基体 (3) 14 (中央大)液泡 (4) 11 线粒体 (5) 中心体 4. (每空2分,共14分) (1) DNA复制 着丝粒分裂 (2) 乙、丙 丙→乙→甲→丁 (3) BC 乙 (4) 高度分化的体细胞不再分裂 化学答案解析 1.【答案】C 【解析】NO2、NO含氮氧化物是光化学烟雾的主要污染物,A正确;二氧化硫可导致酸雨发生,为减少酸雨发生,对酸性物质的排放应加以控制及开发新清洁能源,B正确;溶解CO2的雨水为正常雨水,而NO2或SO2都会导致酸雨的形成,C错误;二氧化碳过量排放可导致全球温度升高,CO2含量的增加会导致温室效应加剧,D正确。 2.【答案】B 【解析】二氧化硅晶体可用于制造光导纤维,故A错误; 玻璃的主要原料是纯碱、石灰石、石英,水泥的主要原料是黏土、石灰石,陶瓷主要原料是黏土,石英主要成分是二氧化硅、黏土属于硅酸盐,故都属于硅酸盐产品,故B正确; 晶体硅是半导体的材料,而不是二氧化硅,故C错误; 二氧化硅既能与氢氟酸反应,又能与烧碱反应,但二氧化硅和HF反应生成四氟化硅而不是盐,所以它是酸性氧化物而不是两性氧化物,故D错误; 故选B。 3.【答案】D 【解析】氯气消毒的自来水相当于新制氯水,因此配制溶液时,可能会使配得的溶液变质。 4.【答案】D 【解析】随核电荷数的增加,X-的电子层数逐渐增多,离子半径逐渐增大,离子的还原性逐渐增强,故A项错误;卤族元素由上到下,非金属性逐渐减弱,气态氢化物的稳定性逐渐减弱,故B项错误;氯、溴、碘单质与水反应可表示为X2+H2O===HX+HXO,氟单质和水反应生成的是HF和O2,故C项错误;卤族元素由上到下,单质的颜色逐渐加深,故D项正确。 5.【答案】C 【解析】①~④依次为S、Cl、S2-、F。①②比半径:①>②;①③比半径:①<③;②④比半径:②>④;故有③>①>②>④。 6.【答案】D 【解析】根据短周期元素在周期表中的相对位置可知,A是第二周期元素。设A的原子序数是x,则B和C的原子序数分别为x+7、x+9,则x+7+x+9=4x,解得x=8,因此A、B、C分别为氧、磷、氯三种元素,答案选D。 7.【答案】B 【解析】A项,MgCl2仅含离子键;C项,HCl含有共价键,是共价化合物;D项,NaOH含有离子键、共价键,是离子化合物。 8.【答案】C 【解析】根据题意可以推断,Z为O,所以X为H,Y为N,W为Na。C项,稳定性:H2O>NH3;D项,NH3为10e-微粒,而N2H4为18e-微粒。 9.【答案】(1)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O 防止水倒流使试管炸裂 NaOH或CaO或碱石灰 (2)吸收氨气中的水蒸气 (3)2NH3+3CuO3Cu+3H2O+N2黑色CuO变为红色,白色无水CuSO4粉末变为蓝色 (4)①没有尾气吸收装置,NH3排入大气,污染环境 ② 【解析】(1)装置A中制备氨气,若A中使用装置Ⅰ,为固体加热制取气体的装置,为实验室制备氨气的反应,用氯化铵和氢氧化钙加热反应生成氨气、氯化钙和水,化学方程式:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;试管口略向下倾斜的原因:防止冷凝水在加热的过程中倒流回试管,炸裂试管;若A中使用装置Ⅱ制取氨气,为液体和固体无需加热制取气体,氨水中存在电离平衡:NH3+H2ONH3•H2O+OH﹣,浓氨水易挥发,CaO固体与水反应放出大量的热,导致温度升高,使得氨气在水中的溶解度进一步减少,以气体的形式逸出,氧化钙与水反应生成的碱使电离平衡逆向移动,制得氨气,或选择NaOH或碱石灰,原理类似。 (2)碱石灰是碱性干燥剂,能吸收水蒸气,防止干扰氨气与氧化铜反应产物水的测定。 (3)氨气与氧化铜反应生成铜、氮气和水,化学方程式:2NH3+3CuO3Cu+3H2O+N2;CuO为黑色,Cu为红色,无水CuSO4粉末为白色,CuSO4•5H2O为蓝色,因此看到的实验现象:黑色CuO变为红色,白色无水CuSO4粉末变为蓝色。 (4)①氨气是刺激性气体,排入大气,污染环境,所以应有尾气处理装置。 ②氨气极易溶于水,可以用水吸收,注意防止倒吸的发生,可用如下装置吸收。 10.【答案】(1)H (2)HF (3)S>Cl>F (4)Mg(OH)2 Mg(OH)2+2H+===Mg2++2H2O (5)将Cl2通入KI溶液中 溶液由无色变为棕色 Cl2+2I-===2Cl-+I2 【解析】 (1)A、B、C、D、E均为短周期的主族元素,其原子序数依次增大,A的原子电子层数等于其核外电子数,则A为H元素;D原子的M层电子数是K层电子数的3倍,则其M层电子数为6,故D为S元素;E的原子序数最大,故E为Cl;B与C可形成离子化合物CB2,则C表现+2价、B表现-1价,二者原子序数小于硫,故B为F、C为Mg。(2)非金属性:F>Cl,故氢化物稳定性:HF>HCl。(3)C、E组成的化合物为MgCl2,其中所含化学键的类型是离子键。(4)同周期元素自左而右原子半径逐渐减小,同主族元素自上而下原子半径逐渐增大,故原子半径:S>Cl>F。(5)C的最高价氧化物的水化物是Mg(OH)2,D的最高价氧化物对应的水化物为H2SO4。(6)欲证明Cl2的氧化性强于I2,可利用“氧化剂的氧化性大于氧化产物”的原理。 11.【答案】(1)2F2+2H2O===4HF+O2 (2)④ (3)第二周期第ⅤA族 4NH3+5O24NO+6H2O 【解析】甲、乙、丙三分子中的质子数相同,通常从10e-、18e-微粒入手,分析知A为H、B为F、C为O、D为N或C,其中甲为HF、乙为H2O、丙为NH3或CH4。利用CH4不与 H2O、HF反应且无刺激性气味可完成回答。 12.【答案】 (1)①ACDBE ②d e f g b c ③MnO2+4H++2Cl-△,Mn2++Cl2↑+2H2O (2)①溶液由无色变为蓝色 Cl2+2KI===I2+2KCl ②产生白色沉淀 【解析】 (1)①MnO2与浓盐酸的反应属于“固液加热型”。应选择A作为反应装置。②生成的Cl2中含有HCl气体和水蒸气,将该Cl2依次通过仪器C(d口进气,e口出气)、D(f口进气,g口出气)可获得纯净、干燥的Cl2。Cl2密度比空气大,应选择仪器B(b口进气,c口出气)用向上排空气法收集Cl2。Cl2有毒,易与NaOH溶液发生化学反应,故选择仪器E吸收尾气。③浓盐酸与二氧化锰反应的离子方程式为MnO2+4H++2Cl-△,Mn2++Cl2↑+2H2O。(2)①Cl2有强氧化性,I-有较强的还原性,在G中,Cl2与溶液中的KI发生反应:Cl2+2KI===I2+2KCl,淀粉遇I2显蓝色。②Cl2有强氧化性,SO2有较强的还原性,在H中,Cl2将SO2氧化为SO,SO与Ba2+反应生成BaSO4白色沉淀。 物理答案 一、选择题(全对5分,不全3分,共40分) 题号 1 2 3 4 5 6 7 8 答案 C B B A A BC ABD ABC 二、填空实验题:(第11题2分,每空2分,计24分) 11、 画图 12、 8倍 2倍。 13.∶∶ = 2:2:1 aA∶aB∶aC = 4:2:1 。 14. 2V0 ; 加速运动 15.1:256 1/4 16. ___ABD___ _。 V0= 1.0 m/s,抛出点的坐标为 (-10,-5) 。 三、计算题:(共36分) 17. 18(12分) 解:(1)在A点处:FA-mg=mVA2/R 得:FA=mg+ mVA2/R=60N 方向竖直向下 (2)恰好过C点,则有VC= =3m/s 由平抛运动:H=2R=gt2/2 ;X=Vct 可得:X=1.8m (2) 19(12分) 解:(1)当FT=Fn=mV2/R=2N 得:V=2m/s (2) 由平抛运动:H=gt2/2 ;X=Vt 得X=1m d=Xsin30o=0.5m查看更多