- 2021-07-08 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年河北省邢台市第八中学高一下学期期中考试化学试题
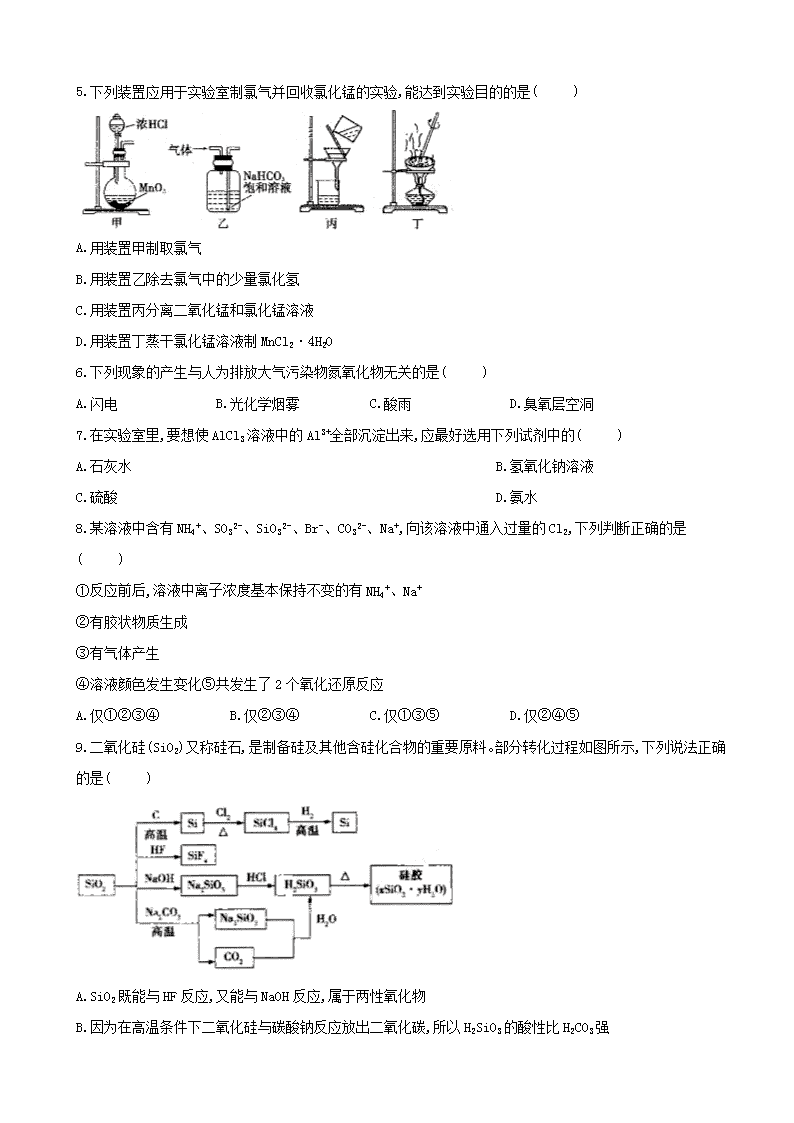
邢台市第八中学2018-2019年度第二学期期中考试试卷 高一 化学 学校:___________姓名:___________班级:___________考号:___________ 一、单选题(16题,每小题3分,共48分) 1.下列物质能使品红溶液褪色,且褪色原理基本相同的是( ) ①活性炭 ②新制氯水③二氧化硫 ④臭氧 ⑤过氧化钠 ⑥双氧水 A.①②④ B.②③⑤ C.②④⑤⑥ D.③④⑥ 2.发射卫星的运载火箭,其推进剂引燃后发生剧烈反应,产生大量的高温气体从火箭尾部喷出。引燃后产生的高温气体主要是、、、,这些气体均无色,但在卫星发射现场却看到火箭喷出大量红烟。 产生红烟的原因是( ) A.高温下遇空气生成 B. 遇空气生成 C. 与反应生成与 D. 和反应生成和 3.下列实验室保存试剂的方法正确的是( ) A.氢氟酸存放在带有橡胶塞的棕色玻璃瓶中 B.碳酸钠溶液或氢氧化钙溶液存放在配有磨口玻璃塞的棕色玻璃瓶中 C.氯化铁溶液存放在铜制容器中 D.氢氧化钠溶液盛放在带有橡胶塞的玻璃瓶中 4.下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( ) ①氯气 ②液氯 ③新制氯水 ④氯气的四氯化碳溶液 ⑤盐酸 ⑥盐酸与少量漂白粉的混合溶液 A.①②③ B.①②③⑥ C.③⑥ D.③④⑥ 5.下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是( ) A.用装置甲制取氯气 B.用装置乙除去氯气中的少量氯化氢 C.用装置丙分离二氧化锰和氯化锰溶液 D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O 6.下列现象的产生与人为排放大气污染物氮氧化物无关的是( ) A.闪电 B.光化学烟雾 C.酸雨 D.臭氧层空洞 7.在实验室里,要想使AlCl3溶液中的Al3+全部沉淀出来,应最好选用下列试剂中的( ) A.石灰水 B.氢氧化钠溶液 C.硫酸 D.氨水 8.某溶液中含有NH4+、SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,下列判断正确的是( ) ①反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+ ②有胶状物质生成 ③有气体产生 ④溶液颜色发生变化⑤共发生了2个氧化还原反应 A.仅①②③④ B.仅②③④ C.仅①③⑤ D.仅②④⑤ 9.二氧化硅(SiO2)又称硅石,是制备硅及其他含硅化合物的重要原料。部分转化过程如图所示,下列说法正确的是( ) A.SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物 B.因为在高温条件下二氧化硅与碳酸钠反应放出二氧化碳,所以H2SiO3的酸性比H2CO3 强 C.SiO2在高温条件下能与过量的碳反应生成SiC,体现了二氧化硅的氧化性 D.除Si的制取过程中涉及的反应外,图中所示其他反应都是非氧化还原反应 10.二氧化硫是引起酸雨的一种物质,二氧化硫属于( ) A.电解质 B.酸性氧化物 C.含氧酸 D.混合物 11.工业上通过氮气和氢气反应合成氨,氨经一系列反应可以得到硝酸。反应历程如下图所示,下列说法不正确的是( ) A.氨可用作制冷剂 B.铵态氮肥一般不能与碱性化肥共同使用 C.硝酸可用于制化肥、农药、炸药、染料、盐类等 D.某浓硝酸中含有溶质2,标准状况下,该浓硝酸与足量的铜完全反应能生成1 12.按图进行实验,试管中装有12mL NO,然后间歇而又缓慢地通入8mL O2,下列是有关最终状态的描述: ①试管内气体呈红棕色 ②试管内气体呈无色 ③试管内液面不变④试管内液面上升 ⑤试管内气体是O2 ⑥试管内气体是NO。其中正确的是( ) A.①③ B.②④⑤ C.②④⑥ D.②③⑤ 13.下列反应既属于离子反应又属于氧化还原反应的是( ) A.2Fe+3Cl22FeCl3 B.Fe+2HCl=FeCl2+H2↑ C.Fe2O3+6HCl=2FeCl3+3H2O D.Fe(OH)2+2HCl=FeCl2+2H2O 14.把过量CO2气体通入下列溶液中,溶液始终保持澄清的是( ) A.Na2SiO3溶液 B.澄清石灰水 C.CaCl2溶液 D.Ca(ClO)2溶液 15.硅在地壳和岩石中的主要存在形式是( ) A.硅单质 B.二氧化硅和硅酸盐 C.硅酸 D.无定形硅 16.下列反应对应的离子方程式书写正确的是( ) A.澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2CaCO3↓+H2O B.硅酸钠溶液中加入盐酸:Na2SiO3+2H+H2SiO3↓+ 2Na+ C.石英溶于烧碱溶液:Si4++2O2-+2OH-SiO32-+H2O D.硅酸与烧碱溶液反应:H2SiO3+2OH-SiO32-+ 2H2O 二、填空题(3小题,共) 17.(10分,每空两分)铜在自然界存在于多种矿石中,如 矿石名称 黄铜矿 斑铜矿 辉铜矿 孔雀石 主要成分 请回答下列问题: 1.上述所列铜化合物中,铜的质量百分数最高的是__________。 2.工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生,反应:,反应的氧化剂是__________。 3. 尾气直接排放到大气中造成环境污染的后果是__________;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称:__________. 4.下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是__________(填字母)。 选项 陈述Ⅰ 陈述Ⅱ 判断 A 铜绿的主要成分是碱式 碳酸铜 可用稀盐酸除铜器表面的 铜绿 Ⅰ对;Ⅱ对;有 B 铜表面易形成致密的氧化 膜 铜容器可以盛放浓硫酸 Ⅰ对;Ⅱ对;有 C 铁比铜活泼 铆在铜板上的铁钉在潮湿 空气中不易生锈 Ⅰ对;Ⅱ对;有 D 蓝色硫酸铜晶体受热转化为 白色硫酸铜粉末是物理变化 硫酸铜溶液可用作游泳池 的消毒剂 Ⅰ错;Ⅱ对;无 18.(14分,每空2分)净水剂能够改善水质,给人们的生活、健康带来很大的益处。 1.明矾[KAl(SO4)2·12H2O]是常见的净水剂。其在水中的电离方程式为__________;明矾可净水是因为在天然水中生成胶状Al(OH)3,Al(OH)3具有__________的作用。 2.碱式氯化铝(简称BAC)是高效净水剂的主要成分。实验室模拟利用铝土矿(主要含Al2O3,还含少量Fe2O3及其他不溶杂质)制取碱式氯化铝[Al2(OH)nCl6-n]的过程如下: ①盐酸溶解铝土矿过程中,发生反应的离子方程式为__________、__________;溶解过程中需不断搅拌,目的是__________。 ②加适量铝粉的主要作用是__________。 ③蒸发浓缩所需玻璃仪器为__________ 19.(6分,每空2分)下面是两位同学设计的证明碳酸钠样品中含有氯化钠的实验方案。 甲:取样品少许加入试管中,加入适量的蒸馏水使之溶解, 配成溶液,然后加入AgNO3溶液,看是否有白色沉淀生成。 乙:取样品少许加入试管中,加入适量的自来水使之溶解,配成溶液,然后滴加稀硝酸酸化的AgNO3溶液, 看是否有白色沉淀生成。 1.两个方案均有不合理之处,请指出: 甲__________. 乙__________. 2.合理的实验方案为__________ 三、推断题 20.(10分)在下图各物质的转化关系中, 、、是单质,其中、是常见的两种气体, 是一种常见金属,其他物质均为化合物, 是一种沉淀(部分生成物已略去). 填写下列空白。 1. 的化学式为__________,的化学式为__________。 2. 溶液与反应的离子方程式为 . 3.的化学方程式为 . 四、实验题(12分,每空2分) 21.某化学兴趣小组利用如下图进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题: 1.A装置的作用是__________;B中反应的化学方程式为__________。 2.D的作用是__________。 3.E中的现象是__________。 4.A、B两个装置中应先点燃处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是__________。 化学参考答案 一、单选题 1.答案:C 解析:新制氯水、臭氧、过氧化钠、双氧水都有强氧化性,都可以使品红溶液褪色,褪色原理基本相同。 2.答案:B 解析:在空气中能被氧气氧化为,是红棕色气体。本题选B。 3.答案:D 解析:A项,氢氟酸能腐蚀玻璃,A项错误;B项,碳酸钠溶液和氢氧化钙溶液呈减性,B项错误;C项,氯化铁溶液会溶解铜,C项错误;D项,氢氧化钠溶液盛放在带有橡胶塞的玻璃瓶中,D项正确。 4.答案:C 解析:能使干燥的石蕊试纸先变红后褪色,要求该物质具有酸性和漂白性。酸性需有较多的,漂白性要有。①和②中只有分子,④中分子与溶剂之间不反应,不能产生和。⑤中盐酸只有酸性无漂白性,③中和水反应生成和 ,⑥中发生反应: ,且与少量漂白粉反应盐酸过量。 5.答案:C 解析:本题考查氯气的制备和二氯化锰的回收。浓盐酸与二氧化锰反应制氯气时需要加热,故A项错误;除去氯气中少量的氯化氢,应用饱和食盐水,且导气管应长进短出,故B项错误;二氧化锰不溶于水,二氯化锰溶于水,可用过滤的方法分离,故C项正确;加热过程中二氯化锰水解,最终得不到所要产物,故D项错误。 6.答案:A 解析:氮氧化合物产生的污染为:光化学烟雾、空气中形成酸雨、高空破坏臭氧层,故B、C、D均与氮氧化合物有关;闪电是一种自然现象,与氮氧化合物污染无关,故A项正确。 考点:环境保护。 7.答案:D 解析:Al(OH)3是两性氢氧化物,能与强酸和强碱反应,Ca(OH)2、NaOH为强碱,H2SO4为强酸,都能与Al(OH)3反应,氨水为弱碱的溶液,可使AlCl3溶液中的Al3+全部沉淀,故D项正确。 考点:本题考查物质的性质及应用。 8.答案: A 解析: 某溶液中含有、、、、、,向该溶液中通入过量的,可以被氯气氧化为硫酸根离子;和氯水中的盐酸反应生成硅酸沉淀;被氯气氧化为溴单质;和氯水中的盐酸反应生成二氧化碳气体;反应前后,溶液中离子浓度基本保持不变的有、,①正确;有胶状物质桂酸生成,②正确;有二氧化碳气体产生,③正确;氯气氧化溴离子为溴单质,溶液颜色发生变化,由无色变化为橙红色,④正确;溶液中发生了氯气氧化、及氯气和水的反应都属于氧化还原反应,共3个,⑤错误。选项A符合题意。 9.答案:D 解析:A项,两性氧化物是指与酸、碱反应均生成盐和水的氧化物,SiO2与HF反应生成的SiF4不是盐,所以A项错误;B项,该反应是在非溶液状态下进行的反应,所以二氧化硅在高温条件下与碳酸钠的反应不能作为判断H2SiO3与H2CO3 酸性强弱的依据,B项错误;C项,Si02在髙温条件下能与过量碳反应生成SiC,在该反应中碳既是氧化剂也是还原剂,C项错误;D项,其他反应都是非氧化还原反应,D项正确。 10.答案:B 解析:A.二氧化硫在水溶液中和水反应生成了电解质亚硫酸,二氧化硫本身不能电离出离子属于非电解质,故A错误; B.酸性氧化物是指氧化物与碱溶液反应生成盐和水的化合物,二氧化硫和碱溶液反应生成盐和水属于酸性氧化物,故B正确; C.二氧化硫本身不能电离,组成分析属于氧化物,不是含氧酸,故C错误; D.二氧化硫是一种物质组成属于纯净物,故D错误. 11.答案:D 解析:A项,氨气沸点较低,易液化,液态氨挥发时可吸收热量,因此液氨可作制冷剂,正确; B项,铵态化肥与碱性化肥如草木灰(主要成分为)等混用,会发生反应,从而导致氮元素的流失,正确; C项,硝酸可用于制氮肥(硝酸铵),以及硝基苯和 (炸药)等,正确; D项, (浓) ,由于随着反应的进行,生成的水增多、硝酸减少,使溶液的浓度降低,当浓硝酸变成稀硝酸时,与铜反应生成,故生成的物质的量小于1。 12.答案:C 解析:由反应4NO+3O2+2H2O=4HNO3可得,剩余的气体应为NO,体积为4/3mL,试管内液面上升 13.答案:B 解析: 14.答案:C 解析:Na2SiO3溶液与CO2气体反应生成H2SiO3胶体;澄清石灰水与CO2气体反应先生成白色沉淀,然后白色沉淀又溶解;CaCl2溶液与CO2气体不反应;Ca(ClO)2溶液与CO2气体反应先生成白色沉淀,然后沉淀又溶解。 15.答案:B 解析:硅主要以二氧化硅和硅酸盐的形式存在于地壳和岩石中。 16.答案:D 解析:A项,澄清石灰水中通入过量CO2时生成Ca(HCO3)2,错误;B项,Na2SiO3易溶于水,且为强电解质,在离子方程式中应写成离子形式,错误;C项,氧化物在离子方程式中一般不拆开写,SiO2不能写成Si4++2O2-错误;D项,H2SiO3为弱酸,且为难溶物,在离子方程式中用其化学式表示, 正确。 二、填空题 17.答案:1. Cu2S; 2. Cu2S和Cu2O 3.形成酸雨,会对植物和建筑物等造成严重危害; 硫酸、硫酸铵 4.AD 解析:1.根据矿石的主要成分分析可知:每1 中含有的其他元素的质量中最小,因此中铜的质量分数最高。 2.分析化学方程式中化合价的变化, 元素的化合价降低,被还原,故、为氧化剂。 3. 排放到大气中会造成酸雨,尾气可以再生产硫酸,若用碱液吸收,可以得到等。 4.铜绿的成分为,能与盐酸反应而除去,而与盐酸不反应,A正确;铜在常温下和浓硫酸不反应,因此B中前后无因果关系,B错误;在潮湿的空气中铁和铜形成原电池,铁作负极,铜作正极,铁易生锈,因此C也不正确;D中Ⅰ的说法不对,应该是化学变化,Ⅱ的说法正确,前后无因果关系,故D正确。 18.答案:1.KAl(SO4)2=K++Al3++2SO42-, 凝聚水中的悬浮物,并能吸附色素 2.①Al2O3+6H+=2Al3++3H2O, Fe2O3+6H+=2Fe3++3H2O, 加快反应速率 ②除去浊液中的H+和Fe3+ ③酒精灯、玻璃棒 解析:1.KAl(SO4)2·12H2O]在水中的电离方程式为KAl(SO4)2=K++A13++2SO42-;明矾可净水是因为在天然水中生成胶状Al(OH) 3,Al(OH)3具有凝聚水中的悬浮物,并能吸附色素的作用。 2.①盐酸溶解铝土矿过程中,氧化铝、氧化铁与盐酸均反应,反应的离子方程式为Al2O3+6H+=2A13++3H2O、Fe2O3+6H+=2Fe3++3H2O;溶解过程中需不断搅拌,目的是增大反应物的接触面积,加快反应速率。 ②要得到氯化铝溶液,就需要除去溶液中的铁离子以及氢离子,因此加适量铝粉的主要作用是除去浊液中的H+和Fe3+。 ③蒸发浓缩所需玻璃仪器为酒精灯、玻璃棒。 19.答案:1.AgNO3溶液没有用稀硝酸酸化,不能排除CO32-的干扰; 用自来水配制溶液会引入Cl-,影响Cl-检验 2.取少许样品加入试管中,加入适量的蒸馏水配成溶液,然后加入稀硝酸酸化的AgNO3溶液,看是否有白色沉淀生成 解析:甲方案中没有用稀硝酸排除CO32-的干扰,Ag2CO3也是白色沉淀。乙方案中用自来水配制溶液,自来水中含有Cl-影响Cl-的检验。 三、推断题 20.答案:1.Cl2; Fe(OH)2 2. 3. 解析:按题图转化关系分析,气体与气体反应生成,金属与反应生成,而与反应生成,且与反应也生成,这表明在、中所含的化合价是不同的,可推知为, 结合为沉淀及转化关系可知为,为含的物质, 为含的物质,则可得出为,为,为,为,为,则只能是,推出了所有的物质,则问题就能迎刃而解了。但在写的化学方程式时应注意有强氧化性,其生成物应为,不然容易出错。 四、实验题 21.答案:1.产生水蒸气 3Fe+4H2O(g) Fe3O4+4H2 2.除去未反应的水蒸气,干燥H2 3.黑色固体变为红色,右端管壁有水珠生成; 4.A收集H2,并检验其纯度 解析:1.B中发生的反应是 3Fe+4H2O(g) Fe3O4+4H2,故A为提供水蒸气的装置。 2.由D中试剂为碱石灰可知,其作用是除去未反应的水蒸气,干燥H2。 3.E中反应为,故黑色粉末变红,问时硬质坂璃営石端会有水珠生成。 4.应先点A处,若先点燃B处,B中的Fe会与空气中的O2反应生成Fe2O3,点燃E处酒精灯前要收集H2,检验纯度。查看更多