- 2021-07-08 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】河北省邢台市第二中学2019-2020学年高二上学期期中考试
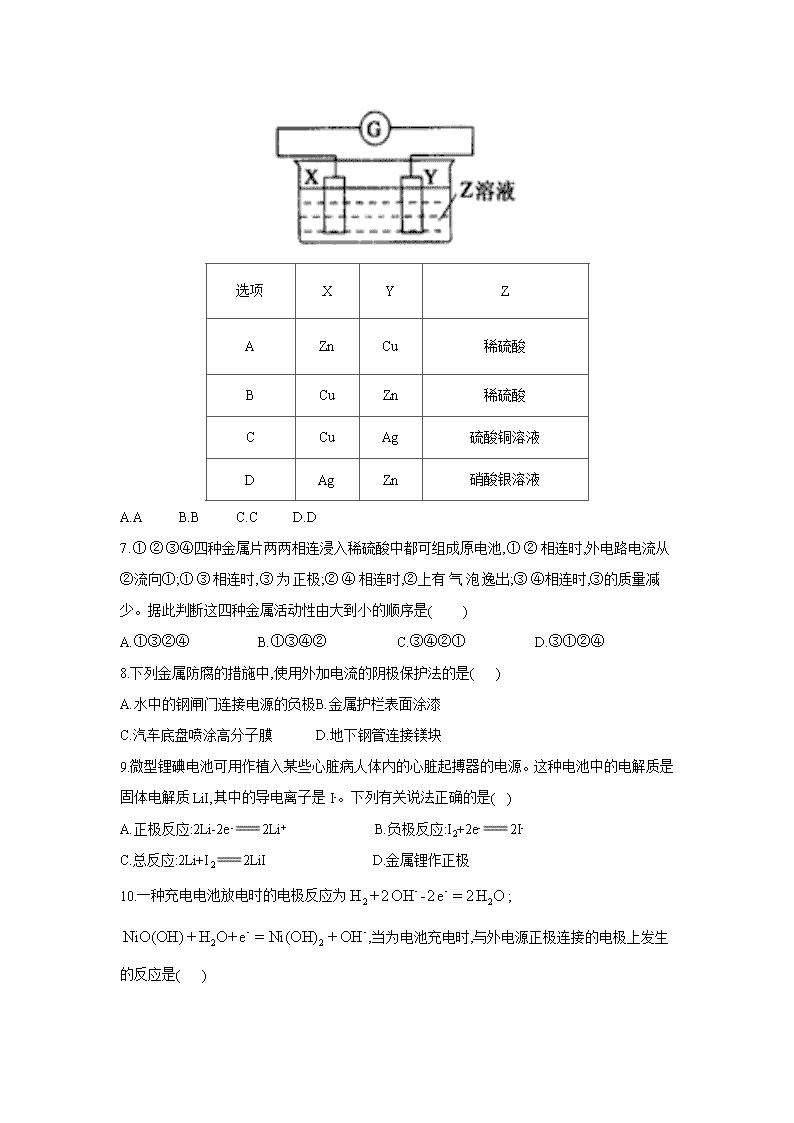
河北省邢台市第二中学2019-2020学年高二上学期期中考试 一、单选题(每小题3分,共66分) 1.下列反应不可用于设计原电池的是( ) A.NaOH+HClNaCl+H2O B.2CH3OH+3O22CO2+4H2O C.Zn+2HClZnCl2+H2↑ D.4Al+3O2+6H2O4Al(OH)3 2.下列装置可以构成原电池的是( ) A. B. C. D. 3随着人们生活质量的日益提高,废旧电池已成为一个亟待解决的问题,对废旧电池的处理 体现了对资源和环境的可持续发展。人们对废旧电池的处理的主要目的是( ) A.回收电池外壳的金属材料 B.回收电池中的二氧化锰 C.回收电池中的石墨电极 D.防止电池中的重金属汞、镉、铅对土壤、水源的污染 4.有关原电池的下列说法中正确的是( ) A.在外电路中电子由正极流向负极 B.在原电池中负极发生还原反应 C.阳离子向正极方向移动 D.原电池中正极一定是不活泼金属 5.下列叙述不正确的是( ) A.锌跟稀硫酸反应制取氢气,加入少量的硫酸铜能加快反应速率 B.镀层破损后,白铁(镀锌铁)比马口铁(镀锡铁)更易被腐蚀 C.钢铁表面常易被锈蚀生成Fe2O3·nH2O D.钢铁在发生析氢腐蚀和吸氧腐蚀时,完全相同的反应是负极反应 6.X、Y两根金属棒插入Z溶液中构成如图的装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是( ) 选项 X Y Z A Zn Cu 稀硫酸 B Cu Zn 稀硫酸 C Cu Ag 硫酸铜溶液 D Ag Zn 硝酸银溶液 A.A B.B C.C D.D 7.①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由大到小的顺序是( ) A.①③②④ B.①③④② C.③④②① D.③①②④ 8.下列金属防腐的措施中,使用外加电流的阴极保护法的是( ) A.水中的钢闸门连接电源的负极 B.金属护栏表面涂漆 C.汽车底盘喷涂高分子膜 D.地下钢管连接镁块 9.微型锂碘电池可用作植入某些心脏病人体内的心脏起搏器的电源。这种电池中的电解质是固体电解质LiI,其中的导电离子是I-。下列有关说法正确的是( ) A.正极反应:2Li-2e-2Li+ B.负极反应:I2+2e-2I- C.总反应:2Li+I22LiI D.金属锂作正极 10.一种充电电池放电时的电极反应为;,当为电池充电时,与外电源正极连接的电极上发生的反应是( ) A.的还原 B.的氧化 C.的氧化 D.的氧化 11.纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液。放电时两个电极反应分别为: Zn+2OH--2e-Zn(OH)2 Ag2O+H2O+2e-2Ag+2OH- 下列说法中,正确的是( ) A.锌是负极,氧化银是正极 B.锌发生还原反应,氧化银发生氧化反应 C.溶液中OH-向正极移动,K+、H+向负极移动 D.在电池放电过程中,电解质溶液的酸碱性基本保持不变 12.用电解法提取氯化铜废液中的铜,方案正确的是( ) A.用铜片连接电源的正极,另一电极用铂片 B.用碳棒连接电源的正极,另一电极用铜片 C.用氢氧化钠溶液吸收阴极产物 D.用带火星的木条检验阳极产物 13.如图所示是探究铁发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法中不正确的是( ) A.开始时发生的是析氢腐蚀 B.一段时间后发生的是吸氧腐蚀 C.两种腐蚀负极的电极反应式均为:Fe-2e-=Fe2+ D.析氢腐蚀的总反应式为:2Fe+O2+2H2O=2Fe(OH)2 14.铜锌原电池(如下图)工作时,下列叙述正确的是( ) A.正极反应为: B.电池反应为: C.在外电路中,电子从流向Zn D.盐桥中的移向溶液 15.关于下列各装置图的叙述中,不正确的是( ) A.用装置①精炼钢,则a极为粗铜,电解质溶液为溶液 B.装置②的总反应是: C.装置③中钢闸门应与外接电源的负极相连 D.装置④中的铁钉几乎没被腐蚀 16.锂电池是新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池。某种锂电池的总反应为:Li+MnO2LiMnO2,下列说法正确的是( ) A.锂是正极,电极反应为:Li-e-Li+ B.锂是负极,电极反应为:Li-e-Li+ C.锂是负极,电极反应为:MnO2+e-MnO2- D.锂是负极,电极反应为:Li-2e-Li2+ 17.将两个铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流,称为燃料电池,下列叙述正确的是( ) ①通入CH4的电极为正极; ②正极的电极反应式是O2+2H2O+4e-=4OH-; ③通入CH4的电极反应式是CH4+2O2+4e-=CO2+2H2O; ④负极的电极反应式是CH4+10OH--8e-= +7H2O; ⑤放电时溶液中的阳离子向负极移动; ⑥放电时溶液中的阴离子向负极移动 A.①③⑤ B.②④⑥ C.④⑤⑥ D.①②③ 18.下列说法中正确的是( ) A.碱性锌锰电池是二次电池 B.铅蓄电池是一次电池 C.二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生 D.燃料电池的活性物质储存在电池内 19.下列图示中关于铜电极的连接错误的是( ) A. B. C. D. 20.全钒液流电池以惰性材料作电极,在电解质溶液中发生的电池总反应为VO2++H2O+V3+VO2++V2++2H+。在电池放电过程中,正极附近溶液的pH( ) A.增大 B.减小 C.不变 D.无法判断 21.如图所示装置中,U形管内装有红墨水且左右液面用相平,a、b试管内分别盛有食盐水和氯化铵溶液,各加入相同的生铁块,放置一段时间。下列有关描述错误的是( ) A.生铁块中的碳是原电池的正极 B.红墨水柱两边的液面变为左低右高 C.两试管中相同的电极反应式是 D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 22.热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl—KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为下列有关说法正确的是( ) A.正极反应式: B.放电过程中,向负极移动 C.每转移0.1mol电子,理论上生成20.7g Pb(铅的相对原子质量:207) D.常温时,在正负极间接上电流表或检流计,指针不偏转 二、非选择题(共34分) 23(12分).已知铅蓄电池的工作原理为Pb+PbO2+2H2SO42PbSO4+2H2O。现用如图装置进行电解实验,测得当铅蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g. (铁的相对原子质量:56) 请回答下列问题: 1.A是铅蓄电池的__________极, 2.Ag电极的电极反应式是__________,该电极的电极产物有__________g. 3.Cu电极的电极反应式是__________,CuSO4溶液的浓度__________(填“减小”“增大”或“不变”)。 4.如图表示电解进行过程中某个物理量x随时间t的变化曲线,其中曲线Ⅰ表示左侧U形管中的变化.曲线Ⅱ表示右侧U形管中的变化,则x表示( ) A.U形管中产生的气体的体积 B.U形管中阳极质量的减少量 C.U形管中阴极质量的增加量 24(10分).氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。 完成下列填空: 1.写出电解饱和食盐水的离子方程式______________________________________。 2.离子交换膜的作用为________________________、________________________。 3.精制饱和食盐水从图中___________位置补充,氢氧化钠溶液从图中____________位置流出(填”a””b””c”或”d”)。 25(12分).由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用如图所示实验装置则可制得纯净的Fe(OH)2沉淀, 两极材料分别为石墨和铁。 1.a电极材料为__________,该电极的电极反应式为__________. 2.若白色沉淀在电极周围生成,则电解液d是__________(填序号,下同);若白色沉淀在两极之间的溶液中生成,则电解液d是__________。 A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液 3.液体c为苯,其作用是__________ 4.要想尽早在两极之间的溶液中看到白色沉淀, 可以采取的措施是( ) A.改用稀硫酸作电解 B.适当增大电源电压 C.适当降低电解液温度 参考答案 一、单选题 1.答案:A 解析:A、氢氧化钠和盐酸的反应不是氧化还原反应,所以不能设计成原电池,故A正确; B、甲醇的燃烧属于自发的氧化还原反应且该反应放热,所以能设计成原电池,故B错误; C、锌和盐酸的反应属于自发的氧化还原反应且该反应放热,所以能设计成原电池,故C错误; D、铝和氧气的反应属于自发的氧化还原反应且该反应放热,所以能设计成原电池,故D错误. 故选A. 2.答案:C 解析:A项,两个电极的材料均为锌,活动性相同,无法构成原电池;B项,蔗糖溶液为非电解质溶液,无法构成原电池;D项,没有形成通路,无法构成原电池。 3.答案: D 4.答案:C 解析:在外电路中,电子从负极流向正极;原电池中负极发生氧化反应;随着反应的进行,阳离子在正极被还原,所以电解质溶液中的阳离子向正极移动;原电池中一般正极金属比负极金属活泼性差,但不一定是不活泼金属,故选C 5.答案:B 解析:选B 锌与CuSO4溶液发生置换反应后,铜附着在锌的表面上形成锌铜原电池,负极锌被氧化速率加快,A项正确。B项中白铁,锌为负极、铁为正极,铁被保护;马口铁,铁作负极、锡作正极,加快铁的腐蚀,故B项错误。钢铁的腐蚀主要是吸氧腐蚀,其电极反应为:负极(Fe):2Fe-4e-=2Fe2+正极(C):2H2O+O2+4e-=4OH-,Fe(OH)2在空气中发生4Fe(OH)2+O2+2H2O=4Fe(OH)3,久置后2Fe(OH)3=Fe2O3·nH2O+(3-n)H2O,所以铁锈的成分是Fe2O3·nH2O,C项正确。钢铁在发生析氢腐蚀和吸氧腐蚀时,负极反应相同,都是Fe-2e-=Fe2+,但正极反应不同,分别析出氢气和吸收氧气,D项正确。 6.答案:D 解析:原电池中负极的活泼性大于正极的活泼性,负极上金属失电子变成离子进入溶液,质量减少,正极上得电子发生还原反应,正极上析出物质,若析出的物质是金属,则正极质量增加,据此分析。 该原电池中,X极逐渐变粗,Y极逐渐变细,所以Y作负极,X作正极,Y的活泼性大于X的活泼性,所以排除AC选项;X极逐渐变粗,说明有金属析出,B选项析出氢气不是金属,D选项析出金属,所以D符合题意。 故选D。 7.答案:B 解析:金属活动性具体判断如下:①②相连时,可判断①大于②;①③相连时,可判断①大于③;②④相连时,可判断④大于②;③④相连时,可判断③大于④;综上所述金属活动性由大到小的顺序是①③④②。 8.答案:A 解析:形成电解池,被保护的金属作阴极,与电源的负极相连,A选项正确。 9.答案:C 10.答案:D 解析:放电时,正极反应为:,充电时与外电源正极相连的即阳极被氧化。 11.答案:A 解析:试题分析:该电池的正极是氧化银,发生还原反应,发生的反应是Ag2O+ H2O+ 2e-= 2Ag +2OH-,锌是负极,发生氧化反应,发生的反应是Zn +2OH--2e-= Zn(OH)2 ,在放电过程中,由于负极消耗了OH-,所以OH-向负极移动,K+、H+向正极移动,在电池放电过程中,由于消耗了水,所以PH值会升高,故BCD错误,A正确。答案为A。 点评: 本题考查了原电池的基础知识,本题比较容易,但是最后一个选项有一定的难度,虽然负极消耗的氢氧根在正极得到补充,但是还有明白放电过程中消耗了水,PH值是变化的。 12.答案:B 解析:在阴极上析出,阳极材料必须用惰性电极。 13.答案:D 解析:A、PH=3的雨水说明该雨水是酸雨,溶液中溶有二氧化硫,酸性条件下,钢铁能发生析氢腐蚀,所以开始时,发生的是析氢腐蚀,故A正确; B、一段时间后,亚硫酸根离子能被氧气氧化生成硫酸根离子,发生的是吸氧腐蚀,故B正确; C、无论是析氢腐蚀还是吸氧腐蚀,铁都作负极,负极上发生的电极反应式都为Fe-2e-═Fe2+ ,故C正确; D、析氢腐蚀的总反应为:Fe+2H+=Fe 2++H2↑,故D错误; 故选D 14.答案:B 解析:铜锌原电池依据反应:设计而成,故B对;正极反应:;负极反应:,A错;外电路中,电子由Zn失去流向铜,C错;整个原电池形成的闭合回路电流方向外电路从Cu到Zn,则内电路中向移动,D错,故选B。 15.答案:B 解析:装置②中总反应是。 16.答案:B 解析:在原电池中负极失去电子,被氧化,因此锂作为负极;锂位于ⅠA族,只能生成Li+。 17.答案:B 解析:据题意知,发生的反应为CH4+2O2=CO2+2H2O,反应产生的CO2处于KOH溶液中,又会转化为,故④是正确的O2得e-被还原,作正极,①错误,②正确。溶液中离子移动情况受溶液(原电池内电路)中电流方向影响,内电路电流方向是由负极流向正极,阳离子的移动方向与电流方向相同,故在溶液(原电池内电路)中阳离子向正极移动,阴离子向负极移动,⑤错误,⑥正确 18.答案:C 解析:碱性锌锰电池是一次电池,铅蓄电池是二次电池。燃料电池的活性物质没有储存在电池内而是从外界不断输入电池。 19.答案:C 解析:铜锌原电池中锌作负极,铜作正极,A正确;电解精炼铜时,粗铜作阳极,精铜作阴极,B正确;镀件上镀铜时,铜作阳极,镀件作阴极,C错误;电解氯化铜溶液时,石墨作阳极,铜作阴极,D正确。 20.答案:A 解析:根据电池总反应可知,放电时负极的电极反应式为V2+-e-=V3+,正极的电极反应式为VO2++2H++e-=VO2++H2O,由此可知,在电池放电过程中正极附近溶液的pH逐渐增大。 21.答案:B 解析:Fe与C及电解质溶液可形成原电池,Fe作负极,发生反应:,C作正极,则a试管中发生吸氧腐蚀,a试管中压强减小,b试管中发生析氢腐蚀,b是试管中压强增大,U形管两端液面变为左高右低。 22.答案:D 解析:该电池放电时正极反应:,A项错误;放电过程中向正极移动,B项错误;每转移0.2mol电子,理论上生成20.7g Pb,C项错误;常温时无水LiCl-KCl为固体,不能电离出自由移动的、和,导致不能形成闭合回路,所以电流表或检流计指针不偏转,D项正确。 二、填空题 23.答案:1.负 2.2H++2e-H2↑ ;0.4 3.Cu-2e-Cu2+ ;不变 4.B 24.答案:1. 2.能得到纯度更高的氢氧化钠溶液; 避免和反应 3. a d 25.答案:1.Fe; Fe-2e-Fe2+ 2.C; B; 3.隔绝空气,防止白色沉淀被氧化; 4.B查看更多