- 2021-07-08 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年高中化学课时作业11化学能转化为电能含解析苏教版必修2
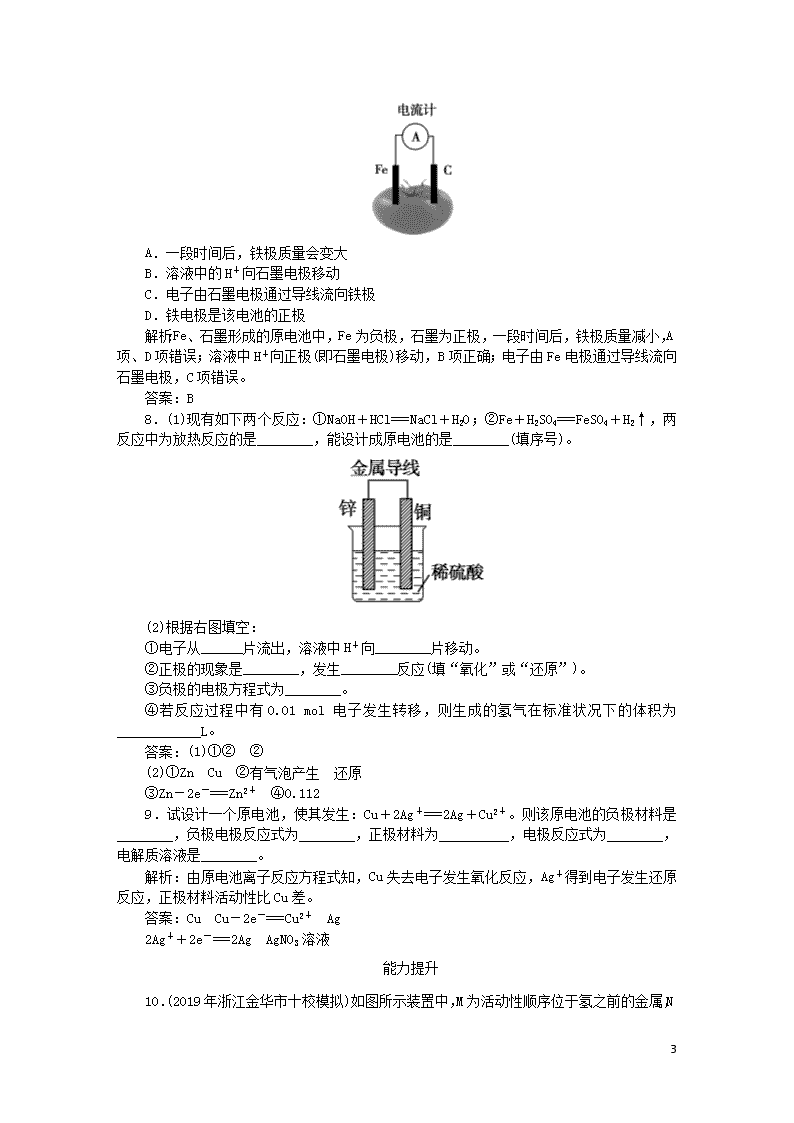
课时作业11 化学能转化为电能 7 基础巩固 1.下列有关原电池的叙述中不正确的是( ) A.原电池是将化学能转化为电能的装置 B.在原电池中,电子流出的一极是负极,发生氧化反应 C.锌、铜、硫酸组成的原电池中,溶液中的 Zn2+、 H+均向正极移动 D.构成原电池的两个电极必须是活泼性不同的两种金属 解析:A.原电池可将化学能转化为电能,在外电路中形成电流,故A正确;B.在原电池中,负极是电子流出的一极,发生氧化反应,故B正确;C.原电池工作时,溶液中的阳离子均向正极移动,故C正确;D.构成原电池的两极可以是两种活泼性不同的金属或金属与非金属导体,如石墨等,故D错误;答案为D。 答案:D 2.目前,我市电能的主要来源是火力发电。下列关于火力发电过程中能量转化关系的描述,正确的是( ) A.化学能转化成机械能再转化成电能 B.化学能转化成热能再转化成电能 C.化学能转化成机械能再转化成热能再到机械能 D.化学能转化成热能再转化成机械能再到电能 解析:本题考查常见的能量转化形式。火力发电是通过煤、石油等燃料的燃烧,将燃料的化学能转化为水的内能,水蒸气膨胀做功转化为汽轮机的机械能,汽轮机带动发电机转动将机械能转化为电能。故选D。 答案:D 3.下列装置能形成原电池且灵敏电流计发生偏转的是( ) A.氯化铁溶液 B.稀硫酸 C.硫酸铜溶液 D.乙醇 解析:本题考查原电池和电解池的工作原理。A.符合原电池的构成条件,而铁与氯化铁能发生自发的氧化还原反应,故A正确;B.能形成原电池,但上端灵敏电流计不发生偏转,故B错误;C.电极相同,不能构成原电池,故C错误;D.乙醇是非电解质,故D错误;故选A。 答案:A 4.(2019年娄底模拟)有A、B、C、D、E五块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应;⑤用惰性电极电解含B离子和E离子的溶液,E先析出。据此,判断五种金属的活动性顺序是( ) A.A>B>C>D>E B.A>C>D>B>E C.C>A>B>D>E D.B>D>C>A>E 解析:金属与稀H2SO4溶液组成原电池,活泼金属失去电子发生氧化反应,作负极,较不活泼的金属作正极。H+在正极电极表面得到电子生成H2,电子运动方向由负极→正极,电流方向则由正极→负极。在题述原电池中,A→B原电池,A为负极; C→D原电池,C为负极;A→C原电池,A为负极;B→D原电池,D为负极;E先析出,E不活泼。综上可知, 7 金属活动性A>C>D>B>E。 答案:B 5.(2019年河南省洛阳市高一期中)如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( ) 实验后的记录: ①Zn为正极,Cu为负极 ②Cu极上有气泡产生,发生还原反应 ③SO42-向Zn极移动 ④若有0.5 mol电子流经导线,则产生5.6 L气体 ⑤电流的流向是:Cu→Zn ⑥负极反应式:Cu-2e-===Cu2+,发生氧化反应 A.②④⑤ B.②③⑤ C.①④⑥ D.③④⑤⑥ 解析:本题考查原电池和电解池的工作原理。①Zn为负极,Cu为正极,故错误;②Cu电极上发生2H++2e-===H2↑,所以有气泡产生,发生还原反应,故正确;③SO42-向负极Zn移动,故正确;④由2H++2e-===H2↑可知,有0.5 mol电子流向导线,产生氢气0.25 mol,无标况无法计算体积,故错误;⑤电流的流向是正极到负极:Cu→Zn,故正确;⑥负极反应式:Zn-2e-===Zn2+,发生氧化反应,故错误;故选B。 答案:B 6.(2019年吉林模拟)原电池中,B极逐渐变粗,A极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( ) A.A是Zn,B是Cu,C为稀硫酸 B.A是Cu,B是Zn,C为稀硫酸 C.A是Fe,B是Ag,C为稀AgNO3溶液 D.A是Ag,B是Fe,C为稀AgNO3溶液 解析:在原电池中,一般活泼金属作负极,失去电子发生氧化反应(金属被氧化)而逐渐溶解(或质量减轻);不活泼金属(或导电的非金属)作正极,发生还原反应有金属析出(质量增加)或有气体放出;依据题意可知A为负极、B为正极,即活泼性A大于B,且A能从电解质溶液中置换出金属单质。所以,只有C选项符合题意。 答案:C 7.下图为番茄电池,下列说法正确的是 ( ) 7 A.一段时间后,铁极质量会变大 B.溶液中的H+向石墨电极移动 C.电子由石墨电极通过导线流向铁极 D.铁电极是该电池的正极 解析:Fe、石墨形成的原电池中,Fe为负极,石墨为正极,一段时间后,铁极质量减小,A项、D项错误;溶液中H+向正极(即石墨电极)移动,B项正确;电子由Fe电极通过导线流向石墨电极,C项错误。 答案:B 8.(1)现有如下两个反应:①NaOH+HCl===NaCl+H2O;②Fe+H2SO4===FeSO4+H2↑,两反应中为放热反应的是________,能设计成原电池的是________(填序号)。 (2)根据右图填空: ①电子从______片流出,溶液中H+向________片移动。 ②正极的现象是________,发生________反应(填“氧化”或“还原”)。 ③负极的电极方程式为________。 ④若反应过程中有0.01 mol电子发生转移,则生成的氢气在标准状况下的体积为____________L。 答案:(1)①② ② (2)①Zn Cu ②有气泡产生 还原 ③Zn-2e-===Zn2+ ④0.112 9.试设计一个原电池,使其发生:Cu+2Ag+===2Ag+Cu2+。则该原电池的负极材料是________,负极电极反应式为________,正极材料为__________,电极反应式为________,电解质溶液是________。 解析:由原电池离子反应方程式知,Cu失去电子发生氧化反应,Ag+得到电子发生还原反应,正极材料活动性比Cu差。 答案:Cu Cu-2e-===Cu2+ Ag 2Ag++2e-===2Ag AgNO3溶液 能力提升 10.(2019年浙江金华市十校模拟)如图所示装置中,M为活动性顺序位于氢之前的金属 7 ,N为石墨棒。关于此装置的下列叙述中,不正确的是( ) A.N上有气体放出 B.M为负极,N为正极 C.导线中有电流通过,电流方向是由M到N D.该装置是化学能转变为电能的装置 解析:由题知M、N、稀硫酸构成原电池,M为活泼性顺序位于氢之前的金属,N为石墨棒,在原电池中,M为负极,N为正极,N上H+得电子产生H2,A、B项正确;导线中电流方向由N到M,C项错误;该装置为原电池,将化学能转变为电能,D项正确。 答案:C 11.将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( ) A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,乙中铜片是负极 C.两烧杯中溶液的pH均增大 D.产生气泡的速率甲比乙慢 解析:因乙杯中锌片和铜片没有接触,故不能构成原电池,故A、B皆错;因甲烧杯中Zn、Cu用导线连接后构成原电池,加快了Zn的溶解,故D错;因两烧杯中的Zn都能与稀H2SO4反应产生H2而消耗H+,故C正确。 答案:C 12.某原电池反应的离子方程式为Fe+2H+===Fe2++H2↑,则下列说法正确的是( ) A.硝酸可能为电解质溶液 B.锌可能为原电池正极 C.铁的质量不变 D.铜可能为原电池正极 解析:若HNO3为电解质溶液,则Fe与HNO3反应不产生H2,A项错误;该原电池中Fe作负极,正极材料活泼性弱于Fe,故B项错误,D项正确;原电池工作时铁的质量不断减少,C项错误。 答案:D 13.(2019年江西铜鼓中学月考)原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是( ) 7 A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为Al-3e-===Al3+ B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为Al-3e-+4OH-===AlO2-+2H2O C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为Cu-2e-===Cu2+ D.由Al、Cu、浓硝酸组成原电池,其负极反应式为 Cu-2e-===Cu2+ 解析:由Al、Cu、稀H2SO4组成原电池,铝和稀硫酸反应而失电子,铜和稀硫酸不反应,所以铝作负极,铜作正极,其负极反应式为Al-3e-===Al3+,A项正确;Mg、Al、NaOH溶液组成原电池,铝和氢氧化钠溶液反应而失去电子发生氧化反应,镁和氢氧化钠溶液不反应,所以铝是负极,镁是正极,其负极反应式为Al-3e-+4OH-===AlO2-+2H2O,B项正确;由Fe、Cu、FeCl3溶液组成原电池,铁和铜都与氯化铁反应,但铁的金属性比铜强,所以铁作负极,铜作正极,其负极反应式为Fe-2e-===Fe2+,C项错误;Al、Cu、浓硝酸组成原电池,铝和浓硝酸发生钝化现象,铜和浓硝酸能自发的进行反应,所以铜作负极,铝作正极,其负极反应式为Cu-2e-===Cu2+,D项正确。 答案:C 14.(2019年兰州模拟)完成原电池问题。 Ⅰ.有甲、乙两位同学均想利用原电池反应检测金属的活动性,两人均使用相同镁片与铝片作电极,甲同学将电极放入2 mol·L-1 H2SO4溶液中,乙同学将电极放入2 mol·L-1的NaOH溶液中,如图所示。 请回答: (1)写出甲池中正极的电极反应式:____________。 (2)写出乙池中负极的电极反应式和总反应的离子方程式: 负极:__________________________________________; 总反应:______________________________________________。 (3)如果甲、乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。 (4)由此实验,可得到如下哪些正确结论?________(填写字母)。 a.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 b.镁的金属性不一定比铝的金属性强 c.该实验说明金属活动性顺序已过时,已没有实用价值 d.上述实验反过来证明了“直接利用金属活动性顺序判断原电池中的正负极”的做法是“不可靠”的 Ⅱ.市场上出售的“热敷袋”其主要成分是铁屑、炭粉、木屑和少量氯化钠、水等。“热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈存在。“热敷袋”放出的热量是利用了________而放出热量。 解析:Ⅰ.(1)甲中镁易失电子作负极,Al作正极,负极上镁发生氧化反应,正极上氢离子发生还原反应,负极反应为Mg-2e-===Mg2+,正极反应为2H++2e-===H2↑。 (2)乙池中铝易失电子作负极,负极上铝失电子发生氧化反应,电极反应式为Al+4OH- 7 -3e-===AlO2-+2H2O,镁作正极,正极发生还原反应,总反应为2Al+2OH-+2H2O===2AlO2-+3H2↑。 (3)甲中镁作负极,乙中铝作负极,根据作负极的金属活泼性强判断,甲中镁活动性强,乙中铝活动性强。 (4)a.根据甲、乙中电极反应式知,原电池正负极与电解质溶液有关,正确;b.镁的金属性强于铝,但失电子难易程度还与电解质溶液有关,错误;c.该实验说明电解质溶液性质影响电极的正负极,不能说明金属活动性顺序没有使用价值,错误;d.该实验说明化学研究对象复杂,反应与条件有关,电极材料相同其反应条件不同导致其产物不同,应具体问题具体分析,正确。 Ⅱ.该装置符合原电池构成条件,所以能构成原电池。其中炭粉作正极,正极上氧气得电子发生还原反应,NaCl溶液起电解质溶液作用,加速Fe的氧化。放电时将化学能转化为电能,所以热敷袋放出的热量来自于原电池中的氧化还原反应。 答案:Ⅰ.(1)2H++2e-===H2↑ (2)Al+4OH--3e-===AlO2-+2H2O 2Al+2OH-+2H2O===2AlO2-+3H2↑ (3)Mg Al (4)ad Ⅱ.铁屑、炭粉、空气(氧气)、NaCl溶液构成原电池,铁被氧化(合理即可) 探究创新 15.糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是( ) A.脱氧过程是吸热反应,可降低温度,延长糕点保质期 B.脱氧过程中铁作原电池正极,电极反应为Fe-3e-―→Fe3+ C.脱氧过程中碳做原电池负极,电极反应为2H2O+O2+4e-―→4OH- D.含有1.12 g铁粉的脱氧剂,理论上最多能吸收氧气336 mL(标准状况) 解析:在脱氧过程中,由铁、碳作电极,氯化钠溶液作电解质溶液形成原电池,发生吸氧腐蚀,该过程为放热反应;在脱氧过程中,碳作正极,铁作负极,失电子发生氧化反应生成Fe2+;在脱氧过程中,Fe失电子氧化为Fe2+,Fe2+最终还是被氧气氧化为Fe3+,由电子得失守恒知消耗氧化剂氧气的体积(标况下)V(O2)=22.4 L·mol-1×(3×1.12 g/56 g·mol-1)/4=336 mL。 答案:D 16.(2019年河北省邯郸市四县联考)按图1的装置进行试验,若图2中X轴表示阴极的电子的物质的量,则Y轴可能表示为( ) A.Cu2+物质的量浓度 B.C棒的质量 C.Fe棒的质量 D.Cl-物质的量浓度 解析:本题考查原电池和电解池的工作原理。A.Cu2+被还原,在阴极析出铜,则Cu2+ 7 物质的量浓度降低,故A错误;B.C为惰性电极,质量不变,故B正确;C.铁为阴极,在电极上析出铜,则质量增加,故C错误;D.阳极为氯离子放电,被氧化生成氯气,则Cl-物质的量浓度减小,故D错误。故选B。 答案:B 17.某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目。 (1)方案Ⅰ:有人提出将大小相等的铁片和铜片同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为__________________。 (2)方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式。 (3)方案Ⅲ:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案Ⅰ、Ⅱ不能雷同):________________;用离子方程式表示其反应原理:__________________________________。 解析:方案Ⅰ:金属的金属性越强,与酸反应越剧烈,产生H2的速率越快,Fe能与H+反应生成H2:Fe+2H+===Fe2++H2↑,Cu不与H+反应,无明显现象,所以Fe的活泼性大于Cu。 方案Ⅱ:利用原电池中相对活泼金属失去电子为原电池负极,相对不活泼的金属为原电池的正极来判断金属活动性的相对强弱,所以将Cu片、Fe片用导线连接起来浸入稀硫酸中,产生气泡的电极为正极,也就是活动性较差的Cu,金属溶解的电极为电池负极,也就是活动性较强的Fe。 方案Ⅲ:可根据活动性强的金属能将活动性弱的金属从其金属盐溶液中置换出来设计实验。 答案:(1)Fe+2H+===Fe2++H2↑ (2)原电池装置图如右图所示;电极材料为铜片和铁片;电解质溶液为稀硫酸;正极反应:2H++2e-===H2↑;负极反应:Fe-2e-===Fe2+ (3)把铁片插入CuSO4溶液中,一段时间后,观察铁片表面是否生成红色物质 Fe+Cu2+===Fe2++Cu 7 8查看更多