- 2021-07-08 发布 |
- 37.5 KB |
- 16页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习第2章化学物质及其变化第6讲离子共存与离子推断教学案新人教版
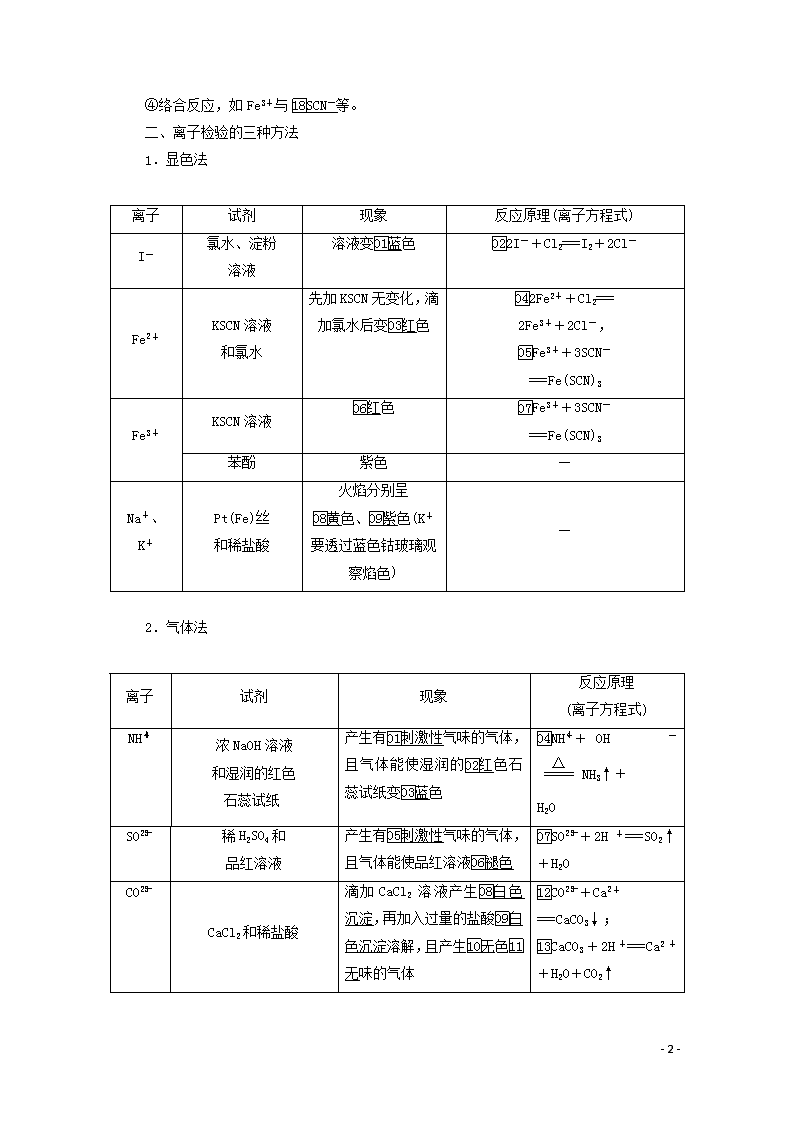
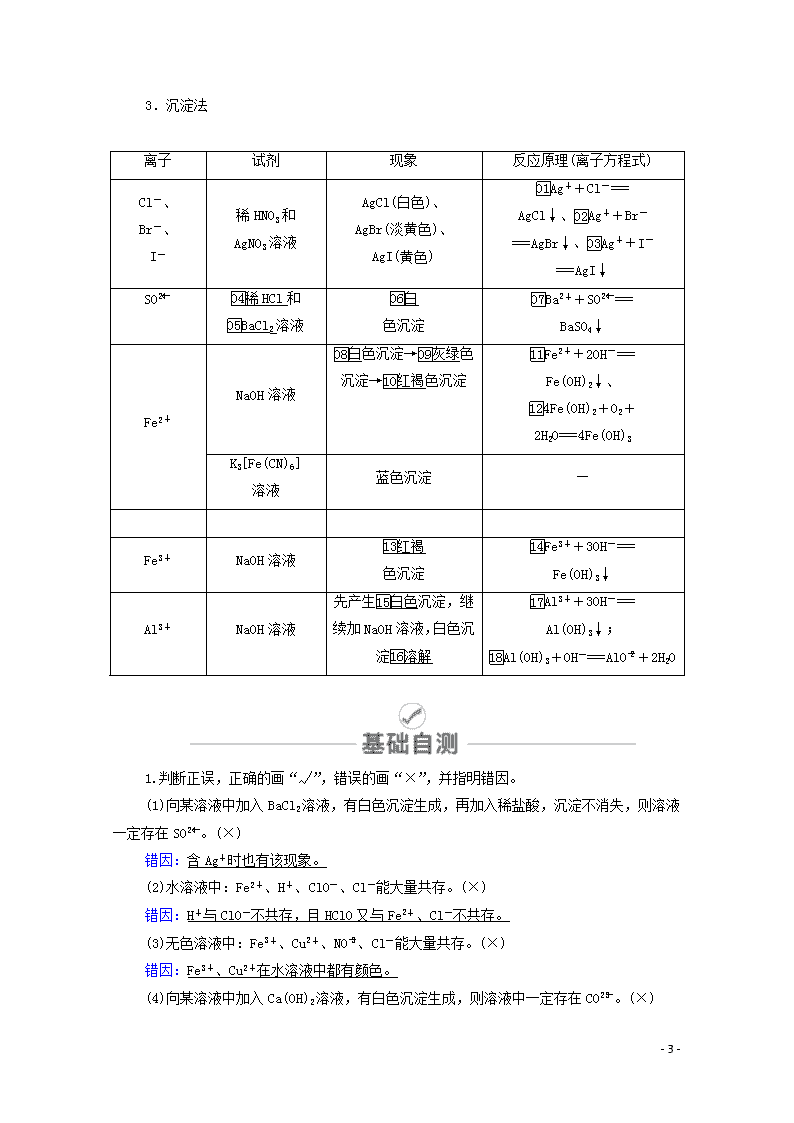
第6讲 离子共存与离子推断 一、离子共存 1.离子共存问题是离子反应条件和本质的最直接应用。所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生反应;若离子之间能发生反应,则不能大量共存。 2.离子共存判断 判断多种离子能否大量共存于同一溶液中,归纳起来就是:一色、二性、三特殊、四反应。 (1)一色——溶液颜色 几种常见离子的颜色: 离子 Cu2+ Fe3+ Fe2+ MnO 溶液颜色 蓝色 棕黄色 浅绿色 紫色 (2)二性——溶液的酸碱性 ①在强酸性溶液中,OH-及弱酸根离子(如CO、SO、S2-、CH3COO-等)均不能大量存在。 ②在强碱性溶液中,H+及弱碱阳离子(如NH、Al3+、Fe3+等)均不能大量存在。 ③酸式弱酸根离子(如HCO、HSO、HS-等)在强酸性或强碱性溶液中均不能大量存在。 (3)三特殊——三种特殊情况 ①AlO与HCO不能大量共存,反应的离子方程式为:AlO+HCO+H2O===Al(OH)3↓+CO。 ②“NO+H+”组合具有强氧化性,能与S2-、Fe2+、I-、SO等还原性的离子因发生氧化还原反应而不能大量共存。 ③NH与CH3COO-、CO,Mg2+与HCO等组合中,虽然两种离子都能水解且水解相互促进,但总的水解程度仍很小,它们在溶液中能大量共存。 (4)四反应——四种反应类型 指离子间通常能发生的四种类型的反应,能相互反应的离子显然不能大量共存。 ①复分解反应,如Ba2+与SO,NH与OH-,H+与CH3COO-等。 ②氧化还原反应,如Fe3+与I-、S2-,NO(H+)与Fe2+,MnO(H+)与Cl-等。 ③相互促进的水解反应,如Al3+与HCO、AlO等。 - 16 - ④络合反应,如Fe3+与SCN-等。 二、离子检验的三种方法 1.显色法 离子 试剂 现象 反应原理(离子方程式) I- 氯水、淀粉 溶液 溶液变蓝色 2I-+Cl2===I2+2Cl- Fe2+ KSCN溶液 和氯水 先加KSCN无变化,滴加氯水后变红色 2Fe2++Cl2=== 2Fe3++2Cl-, Fe3++3SCN- ===Fe(SCN)3 Fe3+ KSCN溶液 红色 Fe3++3SCN- ===Fe(SCN)3 苯酚 紫色 — Na+、 K+ Pt(Fe)丝 和稀盐酸 火焰分别呈 黄色、紫色(K+要透过蓝色钴玻璃观察焰色) — 2.气体法 离子 试剂 现象 反应原理 (离子方程式) NH 浓NaOH溶液 和湿润的红色 石蕊试纸 产生有刺激性气味的气体,且气体能使湿润的红色石蕊试纸变蓝色 NH+OH-NH3↑+ H2O SO 稀H2SO4和 品红溶液 产生有刺激性气味的气体,且气体能使品红溶液褪色 SO+2H+===SO2↑+H2O CO CaCl2和稀盐酸 滴加CaCl2溶液产生白色沉淀,再加入过量的盐酸白色沉淀溶解,且产生无色无味的气体 CO+Ca2+ ===CaCO3↓; CaCO3+2H+===Ca2++H2O+CO2↑ - 16 - 3.沉淀法 离子 试剂 现象 反应原理(离子方程式) Cl-、 Br-、 I- 稀HNO3和 AgNO3溶液 AgCl(白色)、 AgBr(淡黄色)、 AgI(黄色) Ag++Cl-=== AgCl↓、Ag++Br-===AgBr↓、Ag++I-===AgI↓ SO 稀HCl和 BaCl2溶液 白 色沉淀 Ba2++SO=== BaSO4↓ Fe2+ NaOH溶液 白色沉淀→灰绿色沉淀→红褐色沉淀 Fe2++2OH-=== Fe(OH)2↓、 4Fe(OH)2+O2+2H2O===4Fe(OH)3 K3[Fe(CN)6] 溶液 蓝色沉淀 — Fe3+ NaOH溶液 红褐 色沉淀 Fe3++3OH-=== Fe(OH)3↓ Al3+ NaOH溶液 先产生白色沉淀,继续加NaOH溶液,白色沉淀溶解 Al3++3OH-=== Al(OH)3↓; Al(OH)3+OH-===AlO+2H2O 1.判断正误,正确的画“√”,错误的画“×”,并指明错因。 (1)向某溶液中加入BaCl2溶液,有白色沉淀生成,再加入稀盐酸,沉淀不消失,则溶液一定存在SO。(×) 错因:含Ag+时也有该现象。 (2)水溶液中:Fe2+、H+、ClO-、Cl-能大量共存。(×) 错因:H+与ClO-不共存,且HClO又与Fe2+、Cl-不共存。 (3)无色溶液中:Fe3+、Cu2+、NO、Cl-能大量共存。(×) 错因:Fe3+、Cu2+在水溶液中都有颜色。 (4)向某溶液中加入Ca(OH)2溶液,有白色沉淀生成,则溶液中一定存在CO。(×) - 16 - 错因:溶液中有HCO时也能与Ca(OH)2反应生成白色沉淀CaCO3,有Mg2+或Al3+时也会生成Mg(OH)2或Al(OH)3白色沉淀。 (5)加入CaCl2溶液,有白色沉淀生成,溶液中一定存在CO。(×) 错因:含SO或Ag+的溶液中加入CaCl2溶液也有白色沉淀生成。 (6)滴入硝酸酸化的BaCl2溶液,产生白色沉淀,溶液中一定存在SO。(×) 错因:含SO、Ag+的溶液滴加HNO3酸化的BaCl2溶液,也能生成白色沉淀。 (7)在1.0 mol·L-1的KNO3溶液中:H+、Fe2+、Cl-、SO能大量共存。(×) 错因:NO在H+作用下能氧化Fe2+。 2.教材改编题 (据人教必修一P34T7)下列各组离子,在溶液中能大量共存的是( ) A.Na+、H+、Cl-、OH- B.K+、Mg2+、Cl-、SO C.Na+、OH-、NO、HCO D.K+、Cl-、H+、HCO 答案 B 3.(2019·唐山模拟)下列能大量共存的离子组是( ) A.K+、AlO、NO、Ba2+ B.Na+、NH、Cl-、OH- C.K+、Mg2+、SO、CO D.H+、Na+、HCO、SO 答案 A 考点一 离子共存 [解析] 0.1 mol·L-1NaOH溶液显碱性,四种离子可以大量共存,A正确;0.1 mol·L-1FeCl2溶液中含有Fe2+,能与MnO发生氧化还原反应,不能大量共存,B错误;0.1 mol·L-1K2CO3溶液中含有CO,能与Ba2+发生反应,不能大量共存,C错误;0.1 mol·L-1H2SO4溶液显酸性,此条件下,NO和HSO能发生氧化还原反应,不能大量共存,H+与HSO也不大量共存,D - 16 - 错误。 [答案] A 离子共存判断题干中的常见“陷阱” 条件类型 高考中的常见表述 误点点悟 常见的 限制条件 “无色” 有色离子不能大量存在 “pH=1”或 “pH=13” 溶液显酸性或碱性 “因发生氧化还原反应而不能大量共存” 只能是氧化性离子和还原性离子不能大量共存,不包括其他类型反应的离子 常见的 易错点 “透明” “透明”也可“有色” 常见的 隐含条件 “与Al反应放出H2” 溶液既可能显酸性也可能显碱性,但不能是氧化性酸,如HNO3 “由水电离出的c(H+) =1×10-12mol·L-1 或c(OH-)=1×10-12 mol·L-1” 溶液既可能显酸性也可能显碱性 “通入足量的NH3” 与NH3·H2O反应的离子不能大量存在 NO 在酸性条件下具有强氧化性 常见题 干要求 (1)“一定大量共存” (2)“可能大量共存” (3)“不能大量共存” 审清关键字 1.(2019·河南汝州实验中学高三期末)下列体系中,离子能大量共存的是( ) A.含1.2 mol·L-1 NO的溶液:H+、Fe2+、Mg2+、Br- - 16 - B.使酚酞变红的溶液:K+、Na+、NO、Cl- C.滴加KSCN显红色的溶液:NH、K+、Cl-、I- D.0.1 mol·L-1 NaHCO3溶液:Na+、Ba2+、NO、AlO 答案 B 解析 酸性溶液中NO能够氧化Fe2+,在溶液中不能大量共存,A错误;使酚酞变红的溶液呈碱性,碱性条件下B中离子之间不发生任何反应,可大量共存,B正确;滴加KSCN显红色的溶液中含有Fe3+,能够与I-发生氧化还原反应,不能大量共存,C错误;含有AlO的溶液显碱性,促进HCO的电离,电离出的碳酸根离子与钡离子能够反应生成沉淀,不能大量共存,D错误。 2.有下列各组离子: ①Na+、H+、CH3COO-、Cl- ②Ba2+、Na+、CO、NO ③H3O+、Na+、Fe2+、NO ④Na+、Fe3+、Cl-、I- ⑤Al3+、K+、Cl-、HCO ⑥Fe3+、NH、 SO、CO ⑦Na+、H+、NO、HCO ⑧Na+、H+、Cl-、SiO ⑨K+、H+、I-、ClO- ⑩Na+、H+、MnO、Cl- ⑪Al3+、Fe3+、SCN-、Cl- ⑫Na+、Al3+、NO、AlO (1)因发生复分解反应而不能大量共存的是________。 (2)因发生氧化还原反应而不能大量共存的是________。 (3)因离子间相互促进水解而不能大量共存的是________。 (4)因离子间发生络合反应而不能大量共存的是________。 答案 (1)①②⑦⑧ (2)③④⑨⑩ (3)⑤⑥⑫ (4)⑪ 解析 ①H++CH3COO-CH3COOH;②Ba2++CO===BaCO3↓;⑦H++HCO===H2O+CO2↑;⑧2H++SiO===H2SiO3↓是由于发生复分解反应不能共存。③3Fe2++NO+4H3O+===3Fe3++NO↑+6H2O;④2Fe3++2I-===2Fe2++I2;⑨2H++2I-+ClO-===Cl-+I2+H2O;⑩2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O因发生氧化还原反应不能共存。⑤Al3++3HCO===Al(OH)3↓+CO2↑;⑥2Fe3++3CO+3H2O===2Fe(OH)3↓+3CO2↑;⑫Al3++3AlO+6H2O===4Al(OH)3↓因发生双水解不能共存。⑪Fe3+与SCN-因发生络合反应不共存。 考点二 离子推断 - 16 - [解析] 根据加入过量NaOH溶液,加热,得到0.02 mol气体,说明有NH,而且为0.02 mol,同时产生红褐色沉淀,说明有Fe3+,而且为0.02 mol,则没有CO,根据不溶于盐酸的4.66 g沉淀,说明有SO,且为0.02 mol,再根据电荷守恒可知一定有Cl-,至少有0.02×3+0.02×1-0.02×2=0.04 mol,B正确。 [答案] B - 16 - 1.离子推断的“四项基本原则” 2.电荷守恒在定量型离子推断试题中的应用 离子定量推断试题常根据离子的物质的量(或浓度)定量推断最后一种离子的存在:如果多种离子共存,且只有一种离子的物质的量未知,可以用电荷守恒来确定最后一种离子是否存在,即阳离子所带的正电荷总数等于阴离子所带的负电荷总数。 3.某溶液中大量存在五种离子:NO、SO、Fe3+、H+、X,其物质的量之比为n(NO)∶n(SO)∶n(Fe3+)∶n(H+)∶n(X)=2∶3∶1∶3∶1,则X可能为( ) A.Fe2+ B.Mg2+ C.Cl- D.Ba2+ 答案 B 解析 五种离子的物质的量之比为n(NO)∶n(SO)∶n(Fe3+)∶n(H+)∶n(X)=2∶3∶1∶3∶1。由电荷守恒可知,X带2个正电荷。SO与Ba2+反应生成硫酸钡沉淀,在酸性溶液中硝酸根能氧化亚铁离子,所以X可能为Mg2+,答案选B。 4.有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO、SO、Cl-、I-、HCO,取该溶液进行如表所示实验: 实验步骤 实验现象 ①取少量该溶液,加几滴甲基橙 溶液变红色 ②取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 有无色气体产生,气体遇空气可以变成红棕色 - 16 - ③取少量该溶液,加BaCl2溶液 有白色沉淀生成 ④取③中上层清液,加AgNO3溶液 有稳定的白色沉淀生成,且不溶于HNO3 ⑤取少量该溶液,加NaOH溶液 有白色沉淀生成,当NaOH过量时沉淀部分溶解 由此判断: (1)溶液中肯定存在的离子是_______________________________________________________, 溶液中肯定不存在的离子是_________________________________________________________。 (2)为进一步确定其他离子,应该补充的实验及对应欲检离子的名称(说明使用试剂的名称,不必写详细操作步骤)________________________________________________________________________ ________________________________________________________________________。 答案 (1)Al3+、Mg2+、NO、SO Fe2+、Ba2+、I-、HCO (2)焰色反应,检验K+;稀HNO3溶液、AgNO3溶液,检验Cl- 解析 利用肯定性原则,溶液无色,表明溶液中不存在Fe2+;由实验①确定溶液呈酸性;由实验②确定溶液中存在NO;由实验③确定溶液中存在SO;由实验⑤确定溶液中存在Mg2+和Al3+。再根据互斥性原则,溶液呈酸性,H+与HCO不共存,故溶液中不存在HCO;NO(H+)具有强氧化性,与I-不共存,故溶液中不存在I-;Ba2+与SO不共存,故溶液中不存在Ba2+。最后根据进出性原则,实验③向溶液中带入了Cl-,故实验④不能确定溶液中是否存在Cl-。 建议用时:40分钟 满分:100分 一、选择题(每题6分,共72分) 1.水溶液中能大量共存的一组离子是( ) A.Na+、Al3+、Cl-、CO B.H+、Na+、Fe2+、MnO C.K+、Ca2+、Cl-、NO D.K+、NH、OH-、SO 答案 C - 16 - 解析 A项,Al3+、CO相互促进水解,不能大量共存;B项,Fe2+与MnO(H+)发生氧化还原反应,不能大量共存;D项,NH与OH-发生反应生成弱电解质,不能大量共存。 2.能大量共存于同一溶液中,且当改变条件使溶液呈强酸性或强碱性时,一定能发生反应的离子组是( ) A.Fe3+、Na+、SCN-、Cl- B.Ca2+、NH、SO、SO C.Na+、Ba2+、Cl-、HCO D.Al3+、Na+、SO、NO 答案 C 解析 A项,Fe3+与SCN-不能大量共存;B项,Ca2+与SO、SO不能大量共存;C项,四种离子能大量共存,HCO与H+、OH-都能反应;D项,四种离子能大量共存,在酸性条件下四种离子及H+间均不发生反应,在碱性条件下Al3+与OH-反应。 3.向某无色溶液中分别进行下列操作,所得现象和结论正确的是( ) A.加入氨水,产生白色沉淀,证明原溶液中存在Al3+ B.加入AgNO3溶液,产生白色沉淀,证明原溶液中存在Cl- C.加入盐酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中存在SO D.加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,证明原溶液中存在NH 答案 D 解析 A项,加入氨水,产生白色沉淀,该白色沉淀可能为氢氧化镁,原溶液中可能存在镁离子,不一定含有Al3+,错误;B项,加入AgNO3溶液,产生白色沉淀,该白色沉淀可能为碳酸银,原溶液中可能含有碳酸根离子,不一定含有Cl-,错误;C项,加入盐酸酸化的BaCl2溶液,生成白色沉淀,该白色沉淀可能为氯化银,原溶液中可能含有银离子,不一定含有SO,错误;D项,加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,该气体为氨气,证明原溶液中一定存在NH,正确。 4.(2019·泉州模拟)在溶液中加入过量Na2O2后仍能大量共存的是( ) A.NH、Ba2+、Cl-、NO B.K+、SiO、AlO、SO C.Fe2+、Mg2+、SCN-、Cl- D.Na+、HCO、SO、I- 答案 B 解析 在溶液中加入过量Na2O2,发生反应2Na2O2+2H2O===4Na++4OH-+O2↑。NH、OH-发生反应,不能大量共存,A错误;K+、SiO、AlO、SO、OH-之间不反应,能大量共存,B正确;Na2O2可氧化Fe2+,且Fe2+、Mg2+均与OH-发生反应,氧化生成的Fe3+还可与SCN- - 16 - 发生络合反应,不能大量共存,C错误;HCO、OH-发生反应,Na2O2会氧化SO、I-,不能大量共存,D错误。 5.某溶液中含有大量的K+、Cl-及X与Y两种离子,现向该溶液中加入W试剂,根据实验现象得到的关于X、Y的推断能成立的是( ) W试剂 实验现象 X、Y的推断 A KI淀粉溶液 溶液变蓝 Fe3+、SO B 用pH试纸检测 pH=7(常温) CH3COO-、Na+ C 硝酸酸化的 AgNO3溶液 白色沉淀 CO、NH D 过量NaOH溶液 无明显现象 Al3+、Mg2+ 答案 A 解析 加入KI淀粉溶液,溶液变蓝,说明原溶液中含有氧化性离子,该离子可以为Fe3+,且K+、Cl-、Fe3+、SO在该溶液中可以大量共存,A符合题意;pH=7说明溶液呈中性,若含有CH3COO-,则该溶液显碱性,B不符合题意;若含有CO,则加入硝酸酸化的AgNO3溶液还会产生气体,与实验现象不符,C不符合题意;若含有Mg2+,则加入过量NaOH溶液会产生Mg(OH)2沉淀,D不符合题意。 6.(2019·南开中学月考)下列各组离子能大量共存,当溶液中c(H+)=10-1 mol·L-1时,有气体产生;而当溶液中c(H+)=10-13 mol·L-1时,又能生成沉淀。该组离子可能是( ) A.Na+、Mg2+、NO、HCO、SO B.Pb2+、Ba2+、K+、Cl-、S2- C.Pb2+、Fe2+、Na+、SO、NO D.Al3+、NH、SO、Cl-、CO 答案 A 解析 在酸性溶液中HCO与H+反应放出二氧化碳,在碱性溶液中,Mg2+与OH-反应生成氢氧化镁沉淀,A正确;Pb2+与S2-能够反应生成沉淀,不能大量共存,B错误;Pb2+、SO能够反应生成沉淀,不能大量共存,C错误;Al3+与CO发生相互促进的水解反应而不能大量共存,与题意不符,D错误。 7.某同学为检验溶液中是否含有常见的几种无机离子,进行了如下图所示的实验操作,其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是( ) - 16 - A.原溶液中一定含有SO B.原溶液中一定含有NH C.原溶液中一定含有Cl- D.原溶液中一定含有Fe3+ 答案 B 解析 原溶液中加入硝酸钡和盐酸生成白色沉淀,原溶液中可能存在SO、SO或Ag+,A错误;加硝酸银溶液产生白色沉淀,可能是加入盐酸引起的,C错误;因检验过程中产生的气体能使湿润的红色石蕊试纸变蓝,说明原溶液中一定含有NH,B正确;加入KSCN溶液得到红色溶液,Fe3+可能是由原溶液中的Fe2+被NO、H+氧化而来的,故原溶液中不一定含有Fe3+,D错误。 8.下列有关NaHSO3溶液的说法正确的是( ) A.在NaHSO3溶液中,Al3+、NH、HCO、Cl-能大量共存 B.在NaHSO3溶液中,Na+、K+、ClO-、SO能大量共存 C.向NaHSO3溶液中滴加少量的Ba(OH)2溶液,发生反应的离子方程式为Ba2++2OH-+2HSO===BaSO3↓+SO+2H2O D.向NaHSO3溶液中滴加HNO3溶液,发生反应的离子方程式为HSO+H+===SO2↑+H2O 答案 C 解析 Al3+和HCO、HSO均能发生相互促进的水解反应,不能大量共存,A错误;NaHSO3溶液显酸性,H+与ClO-不能大量共存,且能发生反应HSO+ClO-===H++SO+Cl-,B错误;HNO3是强氧化剂,能与NaHSO3发生氧化还原反应,D错误。 9.(2019·北京师大附中高三期中)下列离子或分子能够在指定的分散系中大量共存的是( ) A.空气中:CO2、NO、N2、NH3 B.明矾溶液中:H+、Mg2+、Na+、Cl- C.过量铁与稀硝酸反应后的溶液中:H+、Cl-、I-、Na+ D.常温下,水电离出的c(H+)=1×10-12 mol/L的溶液中:NH、Na+、Cl-、CO 答案 B 解析 NO与氧气反应,不能在空气中大量共存,故A错误;明矾溶液中离子之间不发生反应,可大量共存,故B正确;酸性条件下硝酸根离子具有强氧化性,可氧化亚铁离子和I-,故C错误;常温下,水电离出的c(H+)=1×10-12 mol/L的溶液可能呈酸性或碱性,碱性条件下NH不能大量共存,酸性条件下CO不能大量共存,故D错误。 - 16 - 10.甲、乙、丙、丁由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO中的两种组成,可以发生如图转化,下列说法正确的是( ) A.甲为AlCl3,乙为NaHCO3 B.溶液丙中还可以大量共存的离子有Fe2+、NO、SO C.在甲中滴加丁开始反应的离子方程式:HCO+Ba2++OH-===BaCO3↓+H2O D.白色沉淀A可能溶解在溶液D中 答案 D 解析 根据离子共存可确定甲、乙、丙、丁中的两种为HCl、AlCl3。且甲与乙、丙均能生成NaCl和无色气体B。则甲为NaHCO3,丙为HCl。甲和乙除生成NaCl、CO2外,还有沉淀A,则乙为AlCl3,丁为Ba(OH)2,A错误;Fe2+、NO在酸性条件下发生氧化还原反应不能共存,B错误;在甲中滴加丁开始反应的离子方程式为2HCO+Ba2++2OH-===BaCO3↓+CO+2H2O,C错误;无色溶液D可能为NaOH溶液,白色沉淀A为Al(OH)3,Al(OH)3能溶解在NaOH溶液中,D正确。 11.下列说法中不正确的是( ) A.常温下pH=7的溶液中:Fe3+、Mg2+、SO、Cl-能大量共存 B.在含有0.1 mol·L-1 Fe3+的溶液中:SCN-、Cl-、K+不能大量共存 C.在含有HCO、SO、S2-、CH3COO-四种阴离子的溶液中加入足量的Na2O2固体后,CH3COO-浓度变化最小 D.常温下,水电离出的c(H+)=10-10 mol·L-1的溶液中:Na+、ClO-、S2-、NH不能大量共存 答案 A 解析 常温下pH=7的溶液是中性溶液,Fe3+在中性溶液中不能大量共存,A项错误;在含有0.1 mol·L-1 Fe3+的溶液中,Fe3+与SCN-发生络合反应而不能大量共存,B项正确;加入足量的Na2O2固体后,Na2O2与水反应生成NaOH和O2,OH-与HCO反应生成CO和H2O,且过氧化钠具有强氧化性,能将S2-、SO氧化,所以CH3COO-浓度变化最小,C项正确;ClO-、S2-之间发生氧化还原反应而不能大量共存,且在常温下,水电离出的c(H+)=10-10 mol·L-1的溶液可能是酸性溶液或碱性溶液,在碱性溶液中,NH与OH-反应而不能大量存在,在酸性溶液中,H+与S2-、ClO-都不能大量共存,D正确。 12.某溶液中含K+、Fe3+、Fe2+、Cl-、CO、NO、SO、SiO、I- - 16 - 中的若干种,某同学欲探究该溶液的组成,进行如下实验: Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰。 Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成。 Ⅲ.取Ⅱ反应后的溶液分别置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色。 下列说法正确的是( ) A.原溶液中肯定不含Fe2+、NO、SiO、I- B.原溶液中肯定含有K+、Fe3+、Fe2+、NO、SO C.步骤Ⅱ中无色气体是NO气体,无CO2气体产生 D.为确定是否含有Cl-,可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀 答案 C 解析 由实验Ⅰ,透过蓝色钴玻璃观察到紫色火焰,说明溶液中有K+;由实验Ⅱ,说明溶液中有NO,且有还原性的离子,故至少有Fe2+、I-中的一种,无沉淀生成,说明溶液中无SiO;由实验Ⅲ,第二支试管加CCl4振荡后,下层为无色,说明溶液中不含I-,一定含有Fe2+,A错误;由实验Ⅲ,说明实验Ⅱ所得溶液中有Fe3+,但该离子可能是原溶液就有,或者是由Fe2+被氧化生成的,B错误;溶液中含有Fe2+,故溶液中不存在CO,C正确;由实验Ⅲ可知,原溶液中含有SO,向原溶液中滴加硝酸银溶液,会生成Ag2SO4白色沉淀,不能确定溶液中是否含Cl-,D错误。 二、非选择题(共28分) 13.(14分)某工业废水中可能含有Na+、Mg2+、Al3+、Fe3+、NH、CO、SO、NO中的几种,为确定其成分,设计如下实验: a.取该废水进行焰色反应实验,火焰为黄色; b.另取10 mL该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,充分反应后过滤得到4.66 g白色沉淀; c.另取10 mL该废水于试管中,滴加NaOH溶液,产生沉淀的质量随所加NaOH溶液体积的变化关系如下图所示(不考虑沉淀的溶解和损失)。 根据上述实验和图表数据回答下列问题: - 16 - (1)该工业废水中一定不存在的离子有_________________________________________________ (写离子符号)。 (2)c(NaOH)=________。 (3)NO是否存在?________(填“存在”“不存在”或“不确定”),理由是________________ ________________________________________________________________________。 答案 (1)Mg2+、Fe3+、CO (2)1.0 mol·L-1 (3)存在 由题意得,溶液中n(SO)=0.02 mol,n(Al3+)=0.01 mol,n(NH)=0.01 mol,且含有Na+,根据电荷守恒可知,溶液中一定含有NO 解析 由a知一定含有Na+;由b知沉淀一定是硫酸钡,因此一定存在SO,物质的量是4.66 g÷233 g·mol-1=0.02 mol;根据c的图像可知开始即产生沉淀,达到最大值后沉淀不变化,这说明还含有铵根离子,最后沉淀完全消失,所以沉淀一定是氢氧化铝,即一定存在铝离子,不存在镁离子、铁离子和碳酸根离子。氢氧化铝是0.78 g,物质的量是0.01 mol,消耗氢氧化钠是0.03 mol,沉淀铝离子消耗氢氧化钠溶液是30 mL,则氢氧化钠的物质的量浓度是0.03 mol÷0.03 L=1.0 mol·L-1;与铵根离子反应消耗氢氧化钠溶液10 mL,物质的量是0.01 mol,则铵根离子是0.01 mol。 14.(14分)在Na+浓度为0.5 mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子。 阳离子 K+、Ag+、Mg2+、Ba2+ 阴离子 NO、CO、SiO、SO 现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定): 序号 实验内容 实验结果 Ⅰ 向该溶液中加入足量稀盐酸 产生白色沉淀并放出0.56 L(标准状况下)气体 Ⅱ 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 固体质量为2.4 g Ⅲ 向Ⅱ的滤液中滴加BaCl2溶液 无明显现象 请回答下列问题: (1)实验Ⅰ能确定一定不存在的离子是____________。 - 16 - (2)实验Ⅰ中生成沉淀的离子方程式为__________________________。 (3)通过实验Ⅰ、Ⅱ、Ⅲ和必要的计算,填写下表中阴离子的浓度(能计算出的填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)。 阴离子 NO CO SiO SO c/(mol·L-1) (4)判断K+是否存在________(填“存在”或“不存在”),若存在其最小浓度为________mol·L-1,若不存在说明理由:______________________________。 答案 (1)Ag+、Mg2+、Ba2+ (2)SiO+2H+===H2SiO3↓ (3) 阴离子 NO CO SiO SO c/(mol·L-1) ? 0.25 0.4 0 (4)存在 0.8 解析 由实验Ⅰ、Ⅱ可知,加入稀盐酸产生气体,则原溶液中一定含有CO,其浓度为0.56 L÷22.4 L·mol-1÷0.1 L=0.25 mol·L-1,则溶液中一定无Ag+、Mg2+、Ba2+;且由生成白色沉淀知原溶液中一定含有SiO,发生的反应为SiO+2H+===H2SiO3↓,且SiO的浓度为2.4 g÷60 g·mol-1÷0.1 L=0.4 mol·L-1;由实验Ⅲ可知溶液中不含SO;由电荷守恒知,2c(CO)+2c(SiO)=2×0.25 mol·L-1+2×0.4 mol·L-1=1.3 mol·L-1>0.5 mol·L-1,因此原溶液中一定含有K+,且其浓度至少为1.3 mol·L-1-0.5 mol·L-1=0.8 mol·L-1,不能确定是否含有NO。 - 16 -查看更多