- 2021-07-08 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习化学常用计量学案(全国通用)(4)
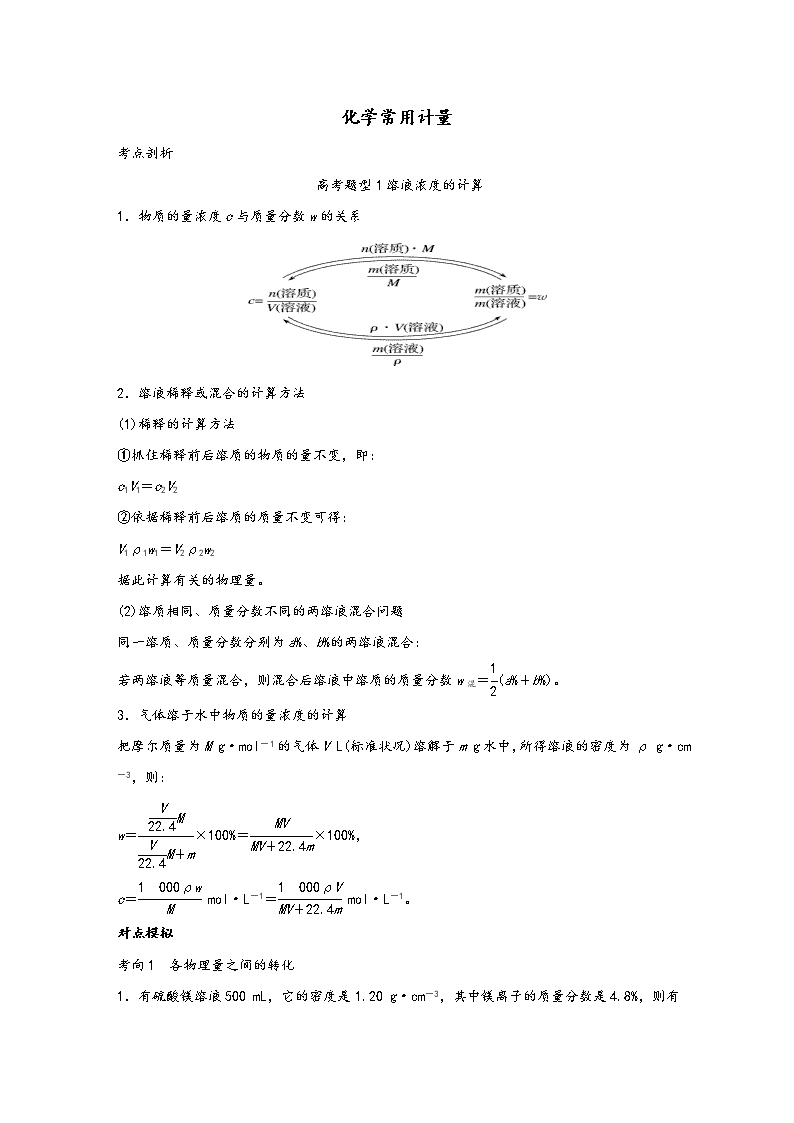
化学常用计量 考点剖析 高考题型1溶液浓度的计算 1.物质的量浓度c与质量分数w的关系 2.溶液稀释或混合的计算方法 (1)稀释的计算方法 ①抓住稀释前后溶质的物质的量不变,即: c1V1=c2V2 ②依据稀释前后溶质的质量不变可得: V1ρ1w1=V2ρ2w2 据此计算有关的物理量。 (2)溶质相同、质量分数不同的两溶液混合问题 同一溶质、质量分数分别为a%、b%的两溶液混合: 若两溶液等质量混合,则混合后溶液中溶质的质量分数w混=(a%+b%)。 3.气体溶于水中物质的量浓度的计算 把摩尔质量为M g·mol-1的气体V L(标准状况)溶解于m g水中,所得溶液的密度为ρ g·cm-3,则: w=×100%=×100%, c= mol·L-1= mol·L-1。 对点模拟 考向1 各物理量之间的转化 1.有硫酸镁溶液500 mL,它的密度是1.20 g·cm-3 ,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是( ) A.溶质的质量分数是24.0% B.溶质的物质的量浓度是2.4 mol·L-1 C.溶质和溶剂的物质的量之比是1∶40 D.硫酸根离子的质量分数是19.2% 答案 C 解析 由Mg2+的质量分数知MgSO4的质量分数为×4.8%=24.0%;则该溶液中溶质的物质的量浓度为c==2.4 mol·L-1;溶质与溶剂的物质的量之比为∶≈1∶21;SO的质量分数为×4.8%=19.2%。 2.在t ℃时,将a g NH3完全溶于水得到V mL溶液,假设该溶液的密度为ρ g·cm-3,质量分数为w,其中含有NH的物质的量是b mol,下列叙述正确的是( ) A.溶质的质量分数w=×100% B.溶质的物质的量浓度c= mol·L-1 C.溶液中c(OH-)= mol·L-1+c(H+) D.向上述溶液中加入V mL水,所得溶液的质量分数大于0.5w 答案 C 解析 溶质的质量分数w=×100%,A错误;在计算时氨水中的溶质是NH3,而不是NH3·H2O,将w=×100%代入公式c=,化简可得c= mol·L-1,B错误;氨水中含有的阳离子为H+和NH,含有的阴离子只有OH-,根据电荷守恒可得:c(OH-)=c(NH)+c(H+)=mol·L-1+c(H+),C正确;由于氨水的密度小于水的密度,与水等体积混合所得稀氨水的质量大于原氨水质量的2倍,故其质量分数小于0.5w,D错误。 易错点睛 溶质的物质的量浓度=,V L氨气溶解在1 L水中,溶液的体积不是溶剂(水)的体积,而是需要用 V(溶液)=来计算。 3.下列有关物质的质量分数和物质的量浓度的叙述正确的是( ) A.等体积的硫酸铁、硫酸铜、硫酸钾溶液分别与足量氯化钡溶液反应,若生成硫酸钡沉淀的质量相等,则三种硫酸盐溶液的物质的量浓度之比为1∶1∶1 B.将物质的量均为0.1 mol的Na2O2和Na2O分别投入100 g水中,所得溶液的物质的量浓度不等 C.将质量分数分别为5%和15%的氨水等体积混合后所得溶液的质量分数为10% D.20 ℃时,饱和KCl溶液的密度为1.174 g·cm-3,物质的量浓度为4.0 mol·L-1,则此溶液中KCl的质量分数为×100% 答案 D 解析 A项,生成硫酸钡沉淀的质量相等,说明各溶液中含有相同物质的量的SO,设溶液中SO的物质的量均为1 mol,则Fe2(SO4)3为 mol、CuSO4为1 mol、K2SO4为1 mol,故浓度之比为∶1∶1=1∶3∶3,A项错误;B项,将物质的量均为0.1 mol的Na2O2和Na2O分别投入100 g水中,所得溶液的体积相等,则物质的量浓度相等,B项错误;C项,由于ρ(氨水)<1 g·cm-3,若将两种氨水等体积混合,所得溶液的质量分数小于10%,C项错误;D项,20 ℃时,饱和KCl溶液的密度为1.174 g·cm-3,物质的量浓度为4.0 mol·L-1,根据c=可知,质量分数为w=×100%,故D项正确。 考向2 配制溶液浓度误差分析 4.下列说法正确的是( ) A.欲配制1.00 L 1.00 mol·L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 B.在50 mL量筒中配制0.100 0 mol·L-1碳酸钠溶液 C.只有100 mL容量瓶、烧杯、玻璃棒、胶头滴管(非玻璃仪器任选),用pH=1的盐酸无法配制100 mL pH=2的盐酸 D.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 答案 C 解析 忽略了NaCl固体溶于水后引起溶液体积的改变,A项错误;量筒不能用于配制溶液,B项错误;由于没有量筒来量取盐酸,所以无法配制,C项正确;定容时俯视刻度线,会造成所加水的体积偏小,使所配溶液浓度偏大,D项错误。 5.某学生配制了100 mL 1 mol·L-1的硫酸溶液。然后对溶液浓度做精确测定,且测定过程中一切操作都正确,结果测得溶液的物质的量浓度低于1 mol·L-1。那么,在配制过程中,下列操作可能导致溶液浓度偏低的是( ) ①量筒用蒸馏水洗净后立即用来量取浓硫酸 ②将浓硫酸在烧杯中稀释,转移到容积为100 mL的容量瓶中后,没有洗涤烧杯 ③在转移过程中用玻璃棒引流,因操作不慎有少量溶液流到了容量瓶外面 ④最后定容时,加水超过了刻度线,马上用胶头滴管吸去多余的水,使溶液凹液面刚好与刻度线相切 A.②④ B.③④ C.①②③ D.①②③④ 答案 D 解析 ①量筒用蒸馏水洗净后立即量取浓H2SO4,浓H2SO4会被稀释,所取溶质H2SO4偏少,会导致浓度偏低;②转移溶液时未洗涤烧杯,溶质H2SO4会损失,导致浓度偏低;③少量溶液流到容量瓶外面,溶质H2SO4会损失,导致浓度偏低;④加水超过了刻度线,马上用胶头滴管吸去多余的水,会损失H2SO4,导致溶液浓度偏低。 高考题型2有关化学式和化合价的判断 真题调研 1.下表为元素周期表的一部分 碳 氮 Y X 硫 Z (5)碳与镁形成的1 mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为 。Q与水反应的化学方程式为 。 (6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L 2.2 mol·L-1 NaOH溶液和1 mol O2,则两种气体的分子式及物质的量分别为 ,生成硫酸铜物质的量为 。 答案 (5) Mg2C3+4H2O===2Mg(OH)2+C3H4↑ (6)NO:0.9 mol;NO2:1.3 mol 2 mol 解析 (5)该烃分子中碳氢质量比为9∶1,物质的量之比为∶=,结合碳与镁形成的1 mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,Q的化学式为Mg2C3,烃的化学式为C3H4,结构简式为HC≡C—CH3,电子式为,Q与水反应的化学方程式为Mg2C3+4H2O===2Mg(OH)2+C3H4↑。(6)铜与一定浓度的硝酸和硫酸的混合酸反应可能生成NO和NO2,相对分子质量都小于50,符合题意,1 mol O2参与反应转移电子的物质的量为4 mol。设NO2的物质的量为x,NO的物质的量为y,则x+y=2.2 mol,x+3y=4 mol,解得x=1.3 mol,y=0.9 mol。根据转移电子守恒知,参与反应的铜的物质的量为 mol=2 mol,因此生成硫酸铜物质的量为2 mol。 2.]NaClO2中氯的化合价为 。 答案 +3价 解析 Na为+1价,O为-2价,根据化合价的代数和等于零即可计算出氯的化合价为+3价。 对点模拟 1.四种多硼酸根离子的结构示意图如下,有关叙述正确的是( ) A.x=2 B.y=3 C.z=4 D.图(d)的化学式为BO2 答案 C 解析 A项,B是+3价、O是-2价、H是+1价,原子团“B3O6”带的负电荷数x=2×6-3×3=3,故A错误;B项,原子团“H4B4O9”带的负电荷数y=2×9-3×4-1×4=2,故B错误;C项,原子团“B2O5”带的负电荷数z=2×5-2×3=4,故C正确;D项,图(d)中最小重复结构单元为“BO2”,所带负电荷为2×2-1×3=1,化学式为(BO2)或BO,故D错误。 2.将胆矾与生石灰、水按质量比为1∶0.56∶100混合配成无机铜杀菌剂波尔多液,其成分的化学式可表示为CuSO4·xCaSO4·xCu(OH)2·yCa(OH)2,当x=3时,y为( ) A.1 B.3 C.5 D.7 答案 D 解析 先依据胆矾与生石灰、水按质量比依次为1∶0.56∶100混合液中质量计算出Cu2+离子和Ca2+离子的物质的量比;然后依据化学式CuSO4·xCaSO4·xCu(OH)2·yCa(OH)2,求出当x=3时,y的值。 3.处理污水的絮凝剂聚合硫酸铁的化学式是[Fe2(OH)n(SO4)]m,下列有关该物质说法不合理的是( ) A.铁元素的化合价为+3价 B.n取值范围是:0查看更多
相关文章
- 当前文档收益归属上传用户