- 2021-07-08 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年广东省汕头市金山中学高一上学期10月月考试题 化学
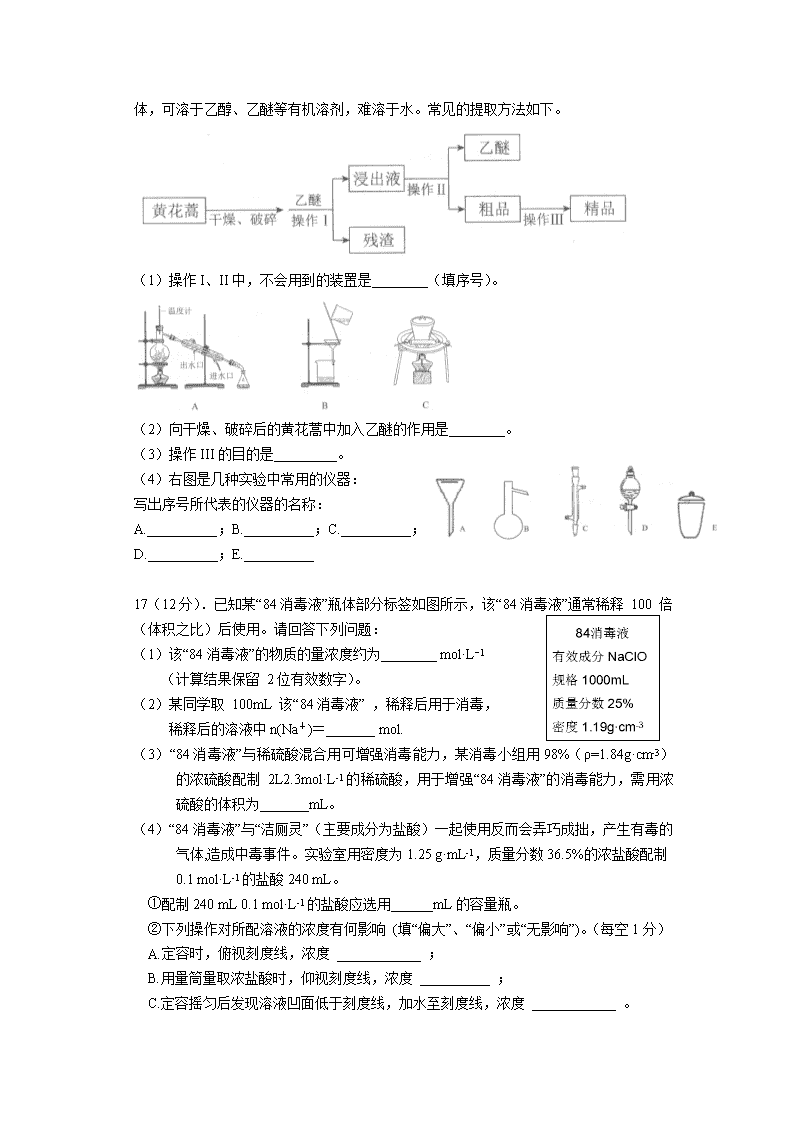
2018-2019 学年广东省汕头市金山中学高一上学期 10 月月考 试题 化学 可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 Cl-35.5 Cu-64 一.选择题共 15 道,每道 4 分。 1. 东晋葛供《肘后备急方》中“青蒿一握,以水升渍,绞取汁,尽服之”。 下列操作与“渍”和“绞”原理相近的是( ) A.煮沸 研碎 B.浸泡 过滤 C.萃取 剪断 D.蒸馏 捣碎 2.如果你家里的食用花生油混有水分,你将采用下列何种方法分离( ) A.过滤 B.蒸馏 C.分液 D.萃取 3.正确的实验操作是实验成功的基本保证。下列实验操作正确的是( ) A.检查装置气密性 B.蒸发 C.加热液体 D.量取液体体积 4.关于粗盐提纯的下列说法中正确的是( ) A.溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解 B.将制得的食盐晶体转移到新制过滤器中用大量水进行洗涤 C.当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干 D.为除去粗盐中的 Ca2+、 Mg2+、SO42-,可依次向溶液中加入足量的碳酸钠溶液、氢 氧化钠溶液、氯化钡溶液、稀盐酸 5.草酸(分子式为 H2C2O4,沸点:150℃)是生物体的一种代谢产物,广泛分布于植物、 动物和真菌体中.下列有关判断不正确的是( ) A.45g 草酸中约含有 1.204×1024 个氧原子 B.1mol 草酸中约含有 6.02×1023 个分子 C.草酸的摩尔质量是 90g·mol-1 D.1mol 草酸在标准状况下的体积约为 22.4L 6.下列做法能达到目的的是( ) A.将 58.5 g NaCl 溶于 1 L 水中,可得 1 mol/L 的 NaCl 溶液 B.可使用 250 mL 容量瓶分两次完成 490 mL 某浓度的 BaCl2 溶液的配制 C.将 25.0 g 胆矾溶于水后配成 100 mL 溶液所得溶液浓度为 1 mol/L D.将碘的四氯化碳溶液通过分液方法分离二者 7.下列各组数据中,前者刚好是后者两倍的是( ) A.2 mol 水的摩尔质量和 1 mol 水的摩尔质量 B.200mL1 mol/L 氯化钙溶液中 c(Cl-)和 100 mL 2mol/L 氯化钾溶液中 c(Cl-) 石棉网 C.64 g 二氧化硫中氧原子数和标准状况下 22.4 L 一氧化碳中氧原子数 D.20%NaOH 溶液中溶质的量浓度和 10% NaOH 溶液中溶质的量浓度 8.用 NA 表示阿伏加德罗常数的值,下列关于 0.2mol/LK2SO4 溶液说法正确的是( ) A.1L 溶液中 K+浓度是 0.4mol/L B.500mL 溶液中含有 0.1NA 个 K+ C.1L 溶液中所含 K+、SO42-总数为 0.3NA D.2L 溶液中 SO42-浓度是 0.4mol/L 9.用 NA 表示阿伏加德罗常数的值,下列说法正确的是( ) A.标准状况下 0.1NA 个水分子所占的体积约为 2.24L B. 11.2 L CO2 的物质的量为 0.5 mol C.NH3 的摩尔质量等于 NA 个氨分子的质量之和 D.101 kPa、4℃时,(ρ水=1g/mL)18 mL 水和 202 kPa、27℃时 32 g O2 所含分子数均为 NA 10.最初化学家对氧化锆的分子式有争议,经测定,锆(Zr)的相对原子质量约为 91, 其氯化物蒸气的密度是同温同压下 H2 密度 116~117 倍,试判断与氯化物价态相同的 氧化锆的分子式( ) A.ZrO B.Zr2O C.Zr2O3 D.ZrO2 11.1 克 O2 与 1 克 X 气体在相同容积的密闭容器中压强(p)与温度(T)的关系如右图表示, 则 X 气体可能是( ) A. CO B. CH4 C. NO D. CO2 12.如果我们规定 12C 的相对原子质量为 24,且 0.024kg12C 中所含的原子个数为阿伏加 德罗常数(NA),那么下列几个量的数值和原来的比,没有发生变化的是( ) A.气体摩尔体积 B.阿伏加德罗常数(NA) C.摩尔质量 D.一个 12C 原子的质量 13.若 1 g CO2 中含有 x 个原子,则阿伏加德罗常数可表示为( ) A. mol-1 B. mol-1 C. mol-1 D. mol-1 14.用单位质量的溶剂中所含溶质的物质的量来表示的溶液浓度叫做质量摩尔浓度,单位 为 mol·kg-1,若 5 mol·kg-1 的硫酸溶液其密度为 1.3 g·mL-1,则它的物质的量浓度为 ( ) A.3.85 mol·L-1 B.4.36 mol·L-1 C.5.25 mol·L-1 D. 6.50mol·L-1 15.在一个密闭容器中,中间有一个可自由滑动的隔板,将容器分成两部分。当左边充入 1molN2,右边充入 8gCO 和 CO2 的混合气体时,隔板处于如下图所示位置,V 甲:V 乙=4:1(两侧温度、压强均相同)。则混合气体中 CO 和 CO2 的物质的量比为( ) A. 1:1 B. 1:3 C. 3:1 D. 2:1 二.综合题(共 40 分,除特殊表明,其余每空均 2 分) 16(16 分).青蒿素是最好的抵抗疟疾的药物,可从黄花蒿茎叶中提取,它是无色针状晶 体,可溶于乙醇、乙醚等有机溶剂,难溶于水。常见的提取方法如下。 (1)操作 I、II 中,不会..用到的装置是________(填序号)。 (2)向干燥、破碎后的黄花蒿中加入乙醚的作用是________。 (3)操作 III 的目的是_________。 (4)右图是几种实验中常用的仪器: 写出序号所代表的仪器的名称: A.__________;B.__________;C.__________; D.__________;E.__________ 17(12 分).已知某“84 消毒液”瓶体部分标签如图所示,该“84 消毒液”通常稀释 100 倍 (体积之比)后使用。请回答下列问题: (1)该“84 消毒液”的物质的量浓度约为________ mol·L−1 (计算结果保留 2 位有效数字)。 (2)某同学取 100mL 该“84 消毒液” ,稀释后用于消毒, 稀释后的溶液中 n(Na+)=_______ mol. (3)“84 消毒液”与稀硫酸混合用可增强消毒能力,某消毒小组用 98%(ρ=1.84g·cm-3) 的浓硫酸配制 2L2.3mol·L-1 的稀硫酸,用于增强“84 消毒液”的消毒能力,需用浓 硫酸的体积为_______mL。 (4)“84 消毒液”与“洁厕灵”(主要成分为盐酸)一起使用反而会弄巧成拙,产生有毒的 气体,造成中毒事件。实验室用密度为 1.25 g·mL-1,质量分数 36.5%的浓盐酸配制 0.1 mol·L-1 的盐酸 240 mL。 ①配制 240 mL 0.1 mol·L-1 的盐酸应选用______mL 的容量瓶。 ②下列操作对所配溶液的浓度有何影响 (填“偏大”、“偏小”或“无影响”)。(每空 1 分) A.定容时,俯视刻度线,浓度 ____________ ; B.用量筒量取浓盐酸时,仰视刻度线,浓度 __________ ; C.定容摇匀后发现溶液凹面低于刻度线,加水至刻度线,浓度 ____________ 。 D.容量瓶在使用前未干燥,里面有少量蒸馏水, 浓度 ____________ 。 18(12 分).在花瓶中加入“鲜花保鲜剂”可延长 鲜花的寿命。右表是 1 L“鲜花保鲜剂”的成分(其 中阿司匹林不含 K+ ,其存在也不会干扰成分中 其他离子的检验),回答下列问题: (1)“鲜花保鲜剂”中物质的量浓度最大的成分 是 _____________(填写名称)。 (2)“鲜花保鲜剂”中 K+的物质的量浓度为 ________________ mol·L-1。 (只要求写表达式,不用化简,不需计算)。 (3)下图所示的仪器中,在配制一定量浓度的“鲜花保鲜剂”溶液时肯定不需要的是 ________(填字母),还缺少的玻璃仪器有_______________(填仪器名称)。 (4)市面上,有一种营养液可用于无土栽培,该营养液中有 KCl 和 K2SO4,其中 K+的浓 度为 0.5mol/L,Cl-的浓度为 0.1mol/L,则 100mL 该营养液中 n(SO42-)=_______ mol。 (5)欲检验“鲜花保鲜剂”中的硫酸根离子,步骤是:取少量鲜花保鲜剂于试管中,滴加 足量的盐酸后,再滴加 溶液,看到 ,证明有硫酸根离 子。 (每空 1 分) 汕头市金山中学高一第 1 学期月考化学卷 参考答案和评分标准 一.选择题(每道 4 分,共 60 分) 序号 1 2 3 4 5 6 7 8 答案 B C C C D C C A 序号 9 10 11 12 13 14 15 成分 质量/g 摩尔质量 /(g·mol-1) 蔗糖 50.00 342 硫酸钾 0.50 174 阿司匹林 0.35 180 高锰酸钾 0.50 158 答案 D D D D D B C 二.综合题(共 40 分) 16(16 分,每空 2 分). (1)C (2)浸取青蒿素 (3)提纯青蒿素 (4)A.普通漏斗;B.蒸馏烧瓶;C.(直形)冷凝管;D.分液漏斗;E.坩埚; 17(共 12 分,除特殊标明,其余每空 2 分). (1)4.0; (2)0.4; (3)250; (4)①250; ②A.偏大;B.偏大;C.偏小;D.无影响(每空 1 分) 18(共 12 分,除特殊标明,其余每空 2 分). (1)蔗糖 (2) (或 或 或 ) (3)ac 玻璃棒、烧杯 (4)0.02 (5)BaCl2 有白色沉淀生成 (每空 1 分)查看更多