- 2021-07-08 发布 |
- 37.5 KB |
- 72页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学:3-1《醇酚》(1)课件(人教版选修5)
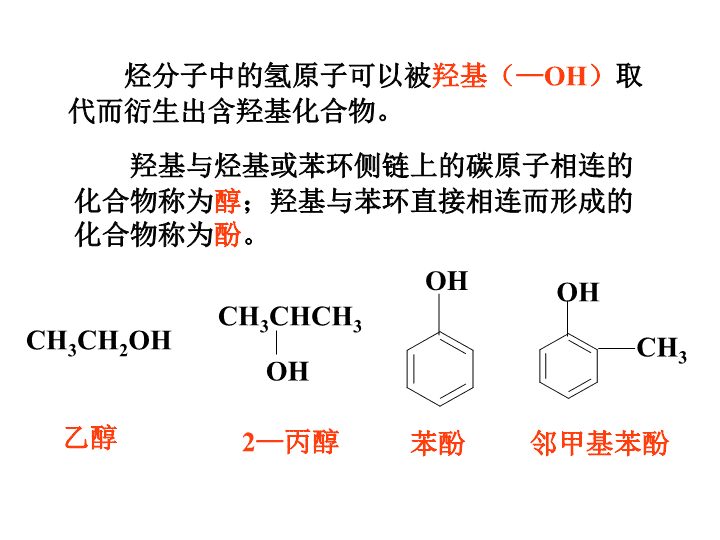
第一节 醇 酚 第三章 烃的含氧衍生物 据我国《周礼》记载,早在周朝就有酿酒 和制醋作坊,可见人类制造和使用有机物有很 长的历史。 从结构上看,酒、醋、苹果酸、柠檬酸等 有机物,可以看作是烃分子里的氢原子被含有 氧原子的原子团取代而衍生成的,它们被称为 烃的含氧衍生物。 烃的含氧衍生物种类很多,可分为醇、酚、 醛、羧酸和酯等。烃的含氧衍生物的性质由所含 官能团决定。利用有机物的性质,可以合成具有 特定性质而自然界并不存在的有机物,以满足我 们的需要。 烃分子中的氢原子可以被羟基(—OH)取 代而衍生出含羟基化合物。 羟基与烃基或苯环侧链上的碳原子相连的 化合物称为醇;羟基与苯环直接相连而形成的 化合物称为酚。 CH3CH2OH CH3CHCH3 OH 乙醇 2—丙醇 OH 苯酚 OH CH3 邻甲基苯酚 饱和一元醇的命名 (2)编号 (1)选主链 (3)写名称 选最长碳链,且含—OH 从离—OH最近的一端起编 取代基位置— 取代基名称 — 羟基位置— 母 体名称(羟基位置用阿拉伯数字表示;羟基 的个数用“二”、“三”等表示。) 资料卡片 CH2OH 苯甲醇 CH2OH CH2OH 乙二醇 CH2OH CH2OH CHOH 1,2,3—丙三醇 (或甘油、丙三醇) CH3—CH2—CH—CH3 OH CH3—CH—C—OH CH3 CH2—CH3 CH3 ② ③ [练习] 写出下列醇的名称 CH3—CH—CH2—OH CH3① 2—甲基—1—丙醇 2—丁醇 2,3—二甲基—3—戊醇 一、醇 1.醇的分类 1)根据羟基所连烃基的种类 脂肪醇 脂环醇 芳香醇 饱和 不饱和 CH3CH2OH CH2=CHCH2OH OH CH2OH 2) 根据醇分子结构中羟基的数目,醇可分为一 元醇、二元醇、三元醇…… CH3CH2CH2OH 丙醇(一元醇) CH2-OH CH2OH 乙二醇(二元醇) CH2-OH CH-OH CH2OH 丙三醇(三元醇) 乙二醇和丙三醇都是无色、黏稠、有甜味的液 体,都易溶于水和乙醇,是重要的化工原料。 饱和一元醇通式:CnH2n+1OH或CnH2n+2O 乙二醇可用于汽车作防冻剂,丙三醇可用于配 制化妆品。 思考与交流 结论:相对分子质量相近的醇和烷烃相比,醇的沸 点远远高于烷烃。 原因:由于醇分子中羟基的氧原子与另一醇分子羟 基的氢原子间存在着相互吸引作用,这种吸引作用 叫氢键。 甲醇、乙醇、丙醇均可与水以任意比例混溶, 这是因为甲醇、乙醇、丙醇与水形成了氢键。 学与问 乙二醇的沸点高于乙醇,1,2,3—丙三醇的 沸点高于1,2—丙二醇, 1,2—丙二醇的沸点高 于1—丙醇,其原因是:由于羟基数目增多,使得 分子间形成的氢键增多增强。 思考与交流 处理反应釜中金属钠的最安全、合理的方法是 第(3)种方案,向反应釜中慢慢加入乙醇,由于 乙醇与金属钠的反应比水与钠的反应缓和,热效应 小,因此是比较安全,可行的处理方法。 2. 乙醇的结构 从乙烷分子中的 1 个 H 原 子 被 — O H (羟基)取代衍变成 乙醇 分子式 结构式 结构简式 官能团 C2H6O H—C—C—O—H H H H H CH3CH2OH 或C2H5OH —OH (羟基) 3. 乙醇的物理性质 1)无色、透明、有特殊香味的液体; 2)沸点78℃; 3)易挥发; 4)密度比水小; 5)能跟水以任意比互溶; 6)能溶解多种无机物和有机物。 4. 乙醇的化学性质 1)与金属钠反应(取代反应) 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ 2)消去反应 脱去—OH和与—OH相邻的碳原子上的1个H 断键位置: 浓硫酸的作用:催化剂和脱水剂 制乙烯实验装置 为何使液体温度迅 速升到170℃? 酒精与浓硫酸 体积比为何 要 为1∶ 3? 放入几片碎 瓷片作用是 什么? 用排水集 气法收集 浓硫酸的作 用是什么? 温度计的 位置? 混合液颜色如何 变化?为什么? 有何杂质气体? 如何除去? 1. 放入几片碎瓷片作用是什么? 防止暴沸 2. 浓硫酸的作用是什么? 催化剂和脱水剂 3. 酒精与浓硫酸体积比为何要为1∶ 3? 因为浓硫酸是催化剂和脱水剂,为了保证有足够 的脱水性,硫酸要用98%的浓硫酸,酒精要用无 水酒精,酒精与浓硫酸体积比以1∶ 3为宜。 4. 温度计的位置? 温度计感温泡要置于反应物的 中央位置因为需要测量的是反应物的温度。 5. 为何使液体温度迅速升到170℃? 因为无水酒精和浓硫酸混合物在170℃的温度下 主要生成乙烯和水,而在140℃时乙醇将以另一 种方式脱水,即分子间脱水,生成乙醚。 6. 混合液颜色如何变化?为什么? 烧瓶中的液体逐渐变黑。因为浓硫酸有多种特性。 在加热的条件下,无水酒精和浓硫酸混合物的反 应除可生成乙烯等物质以外,浓硫酸还能将无水 酒精氧化生成碳的单质等多种物质,碳的单质使 烧瓶内的液体带上了黑色。 7. 有何杂质气体?如何除去? 由于无水酒精和浓硫酸发生的氧化还原反应,反 应制得的乙烯中往往混有H2O、CO2、SO2等气 体。可将气体通过碱石灰。 8、为何可用排水集气法收集? 因为乙烯难溶于水,密度比空气密度略小。 学与问 CH3CH2OHCH3CH2Br 反应条件 化学键的断裂 化学键的生成 反应产物 NaOH、乙醇溶液、 加热 C—Br、C—H C—O、C—H C==C C==C CH2==CH2、HBr CH2==CH2、H2O 浓硫酸、加热到 170℃ 3)取代反应 C2H5OH + HBr C2H5Br + H2O △ 4)氧化反应 2CH3CH2OH+O2 2CH3CHO+2H2O催化剂 有机物分子中加入氧原子或失去氢原子 的反应叫做氧化反应。 CH3CH2OH CH3CHO CH3COOH氧化 氧化 乙醇 乙醛 乙酸 ② ① ⑤ ③ ④ H―C―C―O―H H H H H 反应 断键位置 分子间脱水 与HX反应 ②④ ② ①③ ①② 与金属反应(酯化反应) 消去反应 催化氧化 ① 燃烧 ⑤ 二、酚 1. 定义:羟基跟苯环直接相连的化合物。 2. 结构: 苯环和羟基会相互影响,将决定苯酚的化学性质 OH 3. 物理性质 无色晶体;具有特殊气味;常温下难溶 于水,易溶于乙醇等有机溶剂。650C以上时, 能与水混溶 ;有毒,可用酒精洗涤。 医院常用的“来苏水”消毒剂便是苯酚钠盐的稀溶液。 放置时间长的苯酚往往是粉红 色,因为空气中的氧气就能使 苯酚慢慢地氧化成对-苯醌。 小资料 实验 现象 (1)向盛有少量苯酚晶体的试 管中加入2mL蒸馏水,振荡试 管 (2)向试管中逐滴加入5%的 NaOH溶液,并振荡试管 (3)再向试管中加入稀盐酸 形成浑浊的液体 浑浊的液体变为 澄清透明的液体 澄清透明的液体又 变浑浊 实验3—3 4. 化学性质 1)弱酸性 苯酚能与碱反应,体现出它的弱酸性。因此, 苯酚俗称石炭酸。 ONa +CO2+H2O OH +NaHCO3 说明:苯酚酸性很弱,比碳酸还弱。 2)与溴反应 OH + 3Br2 OH BrBr Br ↓+3HBr (可用于苯酚定性检验与定量测定) ①浓溴水与苯酚在苯环上发生取代反应。这说明 羟基对苯环产生了影响,使取代更易进行。 ②溴取代苯环上羟基的邻、对位。(与甲苯相似) ③该反应很灵敏,可用于苯酚的定性检验 ④不能用该反应来分离苯和苯酚 *3)苯酚的显色反应 遇FeCl3溶液显紫色。这一反应可用于检验 苯酚或Fe3+的存在。 苯酚 苯 反应物 反应条件 取代苯环上 氢原子数 反应速率 结论 原因 溴 水与苯酚反应 液溴与纯苯 不用催化剂 FeBr3作催化剂 一次取代苯环上三个氢原子 一次取代苯环 上一个氢原子 瞬时完成 初始缓慢,后加快 苯酚与溴取代反应比苯容易 酚羟基对苯环影响,使苯环上氢原子变得活泼 苯酚与苯取代反应的比较 学与问 苯酚分子中苯环上连有一羟基,由于羟基对 苯环的影响,使得苯酚分子中苯环上的氢原子比 苯分子中的氢原子更活泼,因此苯酚比苯更易发 生取代反应。 乙醇分子中—OH与乙基相连,—OH上H原 子比水分子中H原子还难电离,因此乙醇不显酸性。 而苯酚分子中的—OH与苯环相连,受苯环影 响,—OH上H原子易电离,使苯酚显示一定酸性。 由此可见:不同的烃基与羟基相连,可以影响物 质的化学性质。 5. 苯酚的用途 苯酚是一种重要的化工原料,可用来制造酚 醛塑料(俗称电木)、合成纤维(如锦纶)、医 药、染料、农药等。粗制的苯酚可用于环境消毒。 纯净的苯酚可配成洗剂和软膏,有杀菌和止痛效 用。药皂中也掺入少量的苯酚。 酚醛树脂的合成 1. 怎样分离苯酚和苯的混合物 加入NaOH溶液→分液→在苯酚钠溶液中加酸或 通入CO2 2. 如何鉴别苯酚 B 利用与浓溴水生成三溴苯酚白色沉淀 A利用与三价铁离子的显色反应 巩固练习 1. 醛基 2. 醛的定义: : : ·C:H O:: 结构式 结构简式 不能写成 电子式 分子里由烃基跟醛基相连而构成的化合物。 饱和一元醛的通式: CnH2n+1CHO 或CnH2nO —CHO —COH —C — H O 一、醛基和醛 3. 常见的醛: 甲醛:无色有刺激性气味的气体,它的水溶液 (又称福尔马林)具有杀菌、防腐性能。 苯甲醛肉桂醛 CH2=CH—CHO CHO 1. 物理性质 2. 分子结构: HC O H H H C 结构简式 HC O CH3 CH3CHO 甲基+醛基=乙醛 二、乙醛 (课本P56 ) 学 与 问 乙醛分子结构中含有两类不同位置的 氢原子,因此在核磁共振氢谱中有两组峰, 峰的面积与氢原子数成正比。因此峰面积 较大或峰高较高的是甲基氢原子,反之, 是醛基上的氢原子。 3. 乙醛的化学性质 (1)氧化反应 a. 银镜反应 CH3CHO+2Ag(NH3)2OH →CH3COONH4+2Ag↓+3NH3+H2O △ 资料卡片 银氨溶液的配制 AgOH+2NH3·H2O=Ag(NH3)2 OH+2H2O AgNO3 + NH3·H2O=AgOH↓+NH4NO3 CH3CHO+2Cu(OH)2 △ CH3COOH+Cu2O↓+2H2O b. 与新制氢氧化铜反应 c. 与氧气反应 O + O22CH3 —C — H O 2CH3 —C — OH△ 催化剂 Ag++NH3·H2O=AgOH↓+NH4+ AgOH+2NH3·H2O=Ag(NH3)2++OH-+2H2O (2)加成反应 O + H2CH3 —C — H CH3 —CH2— OH△ 催化剂 同时也是还原反应 还原反应:加氢或失氧 氧化反应:加氧或失氢 有机的氧化 还原反应 学与问 (1) (2) 在有机化学反应里,通常还可以从加氢或 去氢来分析氧化还原反应,即加氢就是还原反 应去氢就是氧化反应。 HCHO+4Ag(NH3)2OH →(NH4)2CO3+4Ag↓+6NH3+2H2O △ HCHO+4Cu(OH)2 → CO2↑+2Cu2O↓+5H2O △ 总结:CH3CH2OH CH3CHO CH3COOH 氧化 还原 氧化 CnH2n+2O CnH2n O CnH2nO2 (3) 乙醛能发生氧化反应是由于醛基上的H原 子受C=O的影响,活性增强,能被氧化剂所氧 化;能发生还原反应是由于醛基上的C=O与 C=C类似,可以与H2发生加成反应。 科学视野 一、羧酸 1. 定义:由烃基与羧基相连构成的有机化合物。 2. 分类: 烃基不同 羧基数目 芳香酸 脂肪酸 一元羧酸 二元羧酸 多元羧酸 3. 乙酸(冰醋酸) 1)物理性质 2)结构 C HO O C H H H ∶O H∶ C∶ C∶ O∶ H H H ∷ ∶ ∶ ∶ ∶ ∶ 乙酸又叫醋酸,无色冰状晶体(所以又称冰 醋酸),溶点16.6℃,沸点117.9℃。有刺激性气 味,易溶于水。 科 学 探 究 碳酸钠固体 乙酸溶液 苯 酚 钠 溶 液 乙酸与碳酸钠反应,放出 CO2气体,根据强酸制弱酸的 原理,说明乙酸的酸性比碳酸 强;将产生的CO2气体通入苯 酚钠溶液中,生成苯酚,溶液 变浑浊,说明碳酸酸性比苯酚 强。 Na2CO3+2CH3COOH 2CH3COONa+CO2↑+H2O 3)化学性质 a.乙酸的酸性 b.乙酸的酯化反应 乙酸乙酯 18 O CH3—C—OH +H—O—C2H5 18 O CH3—C—O—C2H5+H2O 浓H2SO4 自然界中的有机酸资料卡片 蚁酸(甲酸) HCOOH 柠檬酸 HO—C—COOH CH2—COOH CH2—COOH 未成熟的梅子、李子、杏子 等水果中,含有草酸、安息香 酸等成分 草酸 (乙二酸) COOH COOH 安息香酸 (苯甲酸) COOH 二、酯 1. 定义: 羧酸分子羧基中的━OH被 ━OR′ 取代后的产物。 2. 简式: RCOOR′ 3. 化学性质:(水解反应) 稀H2SO4CH3—C—O—C2H5 + H2O O CH3—C—OH+H—O—C2H5 O CH3—C—OC2H5 + NaOH O CH3—CONa + HOC2H5 O 自然界中的有机酯资料卡片 含有:丁酸乙酯 含有:戊酸戊酯 含有:乙酸异戊酯 思考与交流 1)由于乙酸乙酯的沸点 比乙酸、乙醇都低,因此 从反应物中不断蒸出乙酸 乙酯可提高其产率。 2)使用过量的乙醇,可提高乙酸转化为乙酸乙 酯的产率。 根据化学平衡原理,提高乙 酸乙酯产率的措施有: 3)使用浓H2SO4作吸水剂,提高乙醇、乙酸的 转化率。 一、有机合成的过程 利用简单、易得的原料,通过有机反应, 生成具有特定结构和功能的有机化合物。 1. 有机合成的概念 2. 有机合成的任务 有机合成的任务包括目标化合物分子骨架 的构建和官能团的转化。 有机合成过程示意图 基础原料 辅助原料 副产物 副产物 中间体 中间体 辅助原料辅助原料 目标化合物 3、有机合成的过程 思考与交流 1. 引入碳碳双键的三种方法: 卤代烃的消去;醇的消去;炔烃的不完全加成。 2. 引入卤原子的三种方法: 醇(或酚)的取代;烯烃(或炔烃)的加成; 烷烃(或苯及苯的同系物)的取代。 3. 引入羟基的四种方法: 烯烃与水的加成;卤代烃的水解;酯的水解; 醛的还原。 二、有机合成的方法 1. 有机合成的常规方法 (1)官能团的引入 ①引入双键(C=C或C=O) 1)某些醇的消去引入C=C CH3CH2 OH 浓硫酸 170℃ CH2=CH2↑ +H2O 醇 △ CH2=CH2↑+ NaBr+ H2O CH3CH2Br +NaOH 2)卤代烃的消去引入C=C 3)炔烃加成引入C=C 4)醇的氧化引入C=O ②引入卤原子(—X) 1)烃与X2取代 CH4 +Cl2 CH3Cl+ HCl光照 2CH3CH2OH+O2 2CH3CHO+2H2O催化剂 △ CH≡CH + HBr CH2=CHBr催化剂 △ 3)醇与HX取代 CH2=CH2+Br2 CH2BrCH2Br 2)不饱和烃与HX或X2加成 ③引入羟基(—OH) 1)烯烃与水的加成 CH2=CH2 +H2O CH3CH2OH 催化剂 加热加压 2)醛(酮)与氢气加成 CH3CHO +H2 CH3CH2OH 催化剂 Δ C2H5OH + HBr C2H5Br + H2O△ 3)卤代烃的水解(碱性) C2H5Br +NaOH C2H5OH + NaBr 水 △ 4)酯的水解 稀H2SO4 CH3COOH+C2H5OHCH3COOC2H5 + H2O △ (2)官能团的消除 ①通过加成消除不饱和键 ②通过消去或氧化或酯化或取代等消除羟基 ③通过加成或氧化消除醛基 ④通过消去反应或水解反应可消除卤原子 (3)官能团的衍变 2. 正向合成分析法 此法采用正向思维方法,从已知原料入手, 找出合成所需要的直接可间接的中间产物,逐步 推向目标合成有机物。 基础原料 中间体 中间体 目标化合物 正向合成分析法示意图 3. 逆向合成分析法 是将目标化合物倒退一步寻找上一步反应的 中间体,该中间体同辅助原料反应可以得到目标 化合物。 基础原料中间体 中间体目标化合物 逆向合成分析法示意图 所确定的合成路线的各步反应,其反应条件 必须比较温和,并具有较高的产率,所使用物基 础原料和辅助原料应该是低毒性、低污染、易得 和廉价的。 2 C2H5OH C—OC2H5 C—OC2H5 O O C—OH C—OH O O + 草酸二乙酯的合成 H2C—OH H2C—OH H2C—Cl H2C—Cl CH2 CH2 C—H C—H O O 复习课 第三章 烃的含氧衍生物 一、烃的各类衍生物的重要性质 类别 通式 官能团 代表性物质 分子结构特点 主要化学性质 卤代 烃 R— X —X 卤原 子 溴乙烷 C2H5Br C—Br 易断裂 1. 取代反应:与NaOH 水溶液反应生成醇。 2. 消去反应:与强碱 的乙醇溶液共热,脱 去卤代氢,生成烯烃。 醇 R— OH —OH 羟基 乙醇 C2H5OH —OH与链 烃基相连, C—O键和 O—H键易 断裂 1. 跟金属钠反应。 2. 跟氢卤酸反应。 3. 分子间脱水。 4. 分子内脱水。 5. 氧化反应。 6. 酯化反应。 类别 通式 官能团 代表性物 质 分子结构特点 主要化学性质 酚 —OH —OH直接 跟苯环相连 1. 弱酸性:与强碱溶 液反应,生成苯酚盐 和水。 2. 取代反应:跟浓溴 水反应。 3. 显色反应:跟铁盐 反应,生成紫色物质。 醛 R— CH O — CHO 醛基 乙醛 CH3— CHO —CHO具有 不饱和性和 还原性 1. 加成反应:加氢生 成乙醇。 2. 具有还原性:能被 弱氧化剂氧化成羧酸 (如:银镜反应) OH 类别 通式 官能团 代表性 物质 分子结构特点 主要化学性质 羧酸 R— CO OH —COOH 羧基 乙酸 受C=O双键 影响,O— H能够电离, 产生H+ 1. 具有酸类通性。 2. 能起酯化反应。 酯 R— CO OR� —COOR � 酯基 乙酸 乙酯 分子中RCO 和OR�之间 的键容易断 裂 发生水解反应,生成 羧酸和醇 二、有机反应的主要类型 1. 取代反应:有机物分子中某些原子或原子团 被其它原子或原子团所代替的反应。 取代反应包括卤代、硝化、磺化、水解、 酯化等反应类型。 ①是原子或原子团与另一原子或原子团的交换; ②两种物质反应,生成两种物质,有进有出的; ③该反应前后的有机物的空间结构没有发生变化; ④取代反应总是发生在单键上; ⑤这是饱和化合物的特有反应。 2. 加成反应:有机物分子中未饱和的碳原子 跟其它原子或原子团直接结合生成别的物质 的反应。 加成反应试剂包括H2、X2(卤素)、 HX、HCN等。 ①加成反应发生在不饱和碳原子上; ②该反应中加进原子或原子团,只生成一种有机物 相当于化合反应),只进不出。 ③加成前后的有机物的结构将发生变化,烯烃变烷 烃,结构由平面形变立体形;炔烃变烯烃,结 构由直线形变平面形; ④加成反应是不饱和化合物的较特有反应,另外, 芳香族化合物也有可能发生加成反应。 3. 消去反应:有机物在一定条件下,从一个 分子中脱去一个小分子(如:H2O、HX、 NH3等)生成不饱和化合物的反应(消去小 分子)。 ①消去反应发生在分子内; ②发生在相邻的两个碳原子上; ③消去反应会脱去小分子,即生成小分子; ④消去后生成的有机物会产生双键或叁键; ⑤消去前后的有机物的分子结构变发生变化,它与加 成反应相反,因此,分子结构的变化正好与加成反 应的情况相反。 4. 氧化反应:有机物得氧或失氢的反应。 氧化反应包括: (1)烃和烃的衍生物的燃烧反应; (2)烯烃、炔烃、二烯烃、苯的同系物、醇、 醛等与酸性高锰酸钾反应; (3)醇氧化为醛和酮; (4)醛氧化为羧酸等反应。 5. 还原反应:有机物加氢或去氧的反应。 6. 加聚反应:通过加成反应聚合成高分子化 合物的反应(加成聚合)。主要为含双键的 单体聚合。 7. 缩合(聚)反应:单体间通过缩合反应生 成高分子化合物,同时生成小分子(H2O、 NH3、HX等)的反应。 缩聚反应主要包括:醇酸缩聚、羟酸缩聚、 氨基酸缩聚等。 8. 酯化反应(属于取代反应):酸(有机 羧酸、无机含氧酸)与醇作用生成酯和水的 反应。 9. 水解反应:有机物在一定条件下跟水作用 生成两种或多种物质的反应。 水解反应包括卤代烃水解、酯水解、糖(除单 糖外)水解、蛋白质水解等。 10. 裂化反应:在一定温度下,把相对分子 质量大、沸点高的长链烃断裂为相对分子质 量小、沸点低的短链烃的反应。 三、有机反应的官能团 有机物 无机物/有机物 反应名称 烷,芳烃,酚 X2 卤代反应 苯的同系物 HNO3 硝化反应 苯的同系物 H2SO4 磺化反应 醇 醇 脱水反应 醇 HX 取代反应 酸 醇 酯化反应 酯 醇 酯交换反应 酯/卤代烃 酸溶液或碱溶液 水解反应 二糖多糖 H2O 水解反应 蛋白质 H2O 水解反应 羧 酸 盐 碱石灰 脱羧反应 1. 发生取代反应的基/官能团 结构变化形式 —— 等 价 替 换 2. 发生加成反应的官能团 官能团 C=C C C -CHO -C=O C6H5- 有 机 物 反应条 件 C O -OHC O -H C O -O-C O - - 3. 发生氧化反应的官能团 C=C C C C-OH CHO C6H5-R CH3CH2CH2CH3 试 剂 条 件 产 物 -CH2OH -CHO为脱氢重键式 -CHO -COOH为氧原子插入式 反应条件 常 见 反 应 催化剂 加热加压 乙烯水化、乙烯氧化、丁烷氧化、 氯苯水解、油脂氢化 催化剂 加热 烯炔醛酮加氢、乙醇消去、 乙醇氧化、酯化反应 水浴加热 C6H5NO2制备、银镜反应、树脂制备、 纤维素水解、CH3COOC2H5水解 只用催化剂 苯的溴代、乙醛被空气氧化 只需加热 制CH4、苯的磺化、 R-OH的卤代 R-X水解和消去 不需外加 条件 烯与炔加溴、苯酚的取代 烯炔与苯的同系物氧化、 四、有机反应的条件 五、主要有机物之间的转化关系 —CH2—CH2—n CH3—CH3 CH2==CH2 CH≡CH CH3CH2Cl CH3COOH CH3CH2OH CH3CHO CH3COONa CH2—CH2— — Cl Cl CH2==CH— Cl CH==CH— — Cl Cl HC—CH— — Cl Cl — —Cl Cl Br OH ONa CH3COOCH2CH3 (1)(2) (3)(4) (5)(6) (8)(7) (9) (10)(11) (12) (13) (14) (15) (16) (17) (18) (19) (20) (21) (22) (23) (24) (25) OH Br Br Br查看更多