- 2021-07-08 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习人教版废金属屑的再利用教案
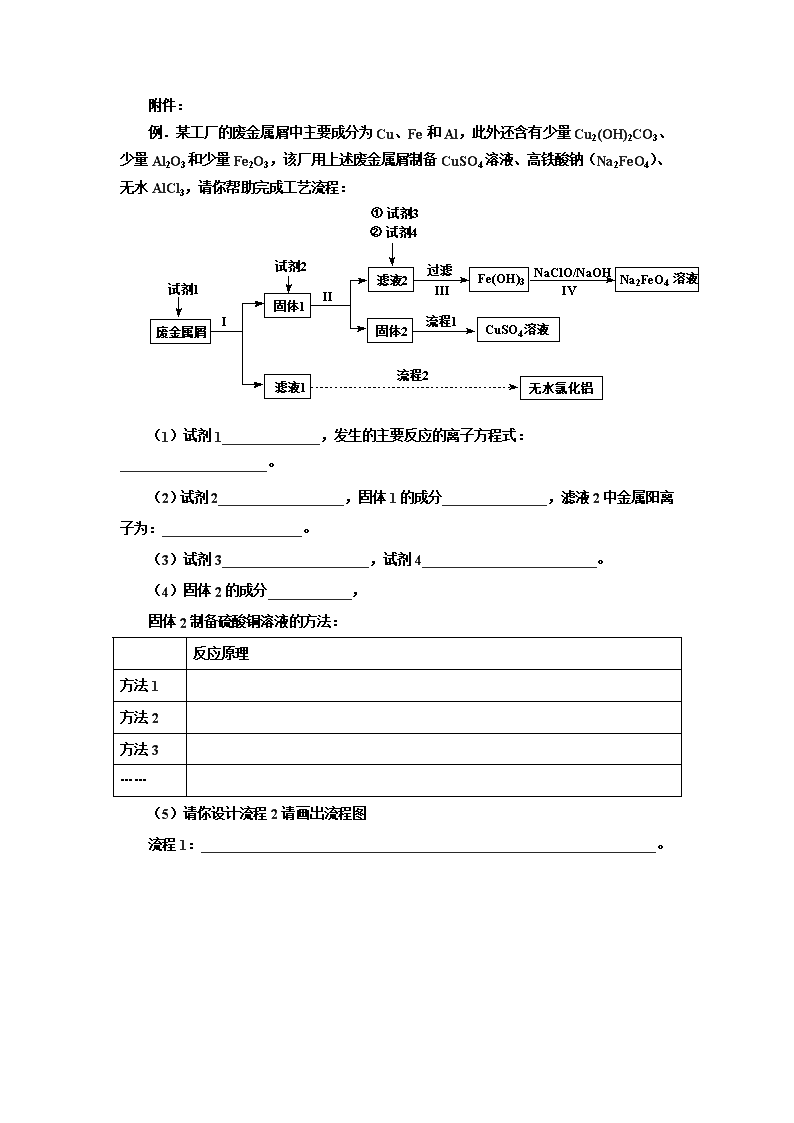
课题名称 废金属屑的再利用 教 学 目 标 1.知识与技能 (1)通过废金属屑再利用流程的设计与讨论,使学生复习相关物质的性质、分离提纯的方法、反应原理、反应规律。 (2)通过设计制备硫酸铜溶液、无水氯化铝的制备复习氧化还原反应规律、水解原理、分离提纯方法在实际中的应用。 2.过程与方法 (1)通过问题讨论,使学生体验应用化学原理,物质的分离提纯方法、物质转化等基础知识在解答实际问题中具体的应用方法。 (2)通过问题讨论,使学生意识到物质分类在解决具体问题如何进行应用的。 (3)通过流程设计的讨论渗透化学反应需要条件的思想,通过调节物质用量控制反应。 3.情感态度与价值观 (1)通过学习讨论,使学生体会化学原理、分离提纯基本操作、主要化学物质的性质等在解决具体问题时发挥的重要作用。 (2)通过学习讨论,使学生体会综合应用化学知识解决实际问题的重要性。 (3)通过物质制备的过程渗透绿色化学的思想。 (4)渗透化学反应是需要条件的化学思想。 教 学重 点 使学生认识化学原理、分离提纯基本方法等在具体实例中如何进行控制和选择 教 学难 点 使学生认识化学原理可以调控化学反应进行,并且会按实际所需,对反应进行控制 教 学方 法 讨论法 教 学 过 程 教 师 活 动 学 生 活 动 设 计 意 图 【环节1】讨论废金属屑制备硫酸铜溶液、高铁酸钠、无水氯化铝的流程 (1)试剂1的选择及发生的主要化学反应 (2)讨论试剂2的选择,发生的主要反应及反应的顺序从而判断滤液2中金属阳离子的成分及固体2的成分 (3)讨论制备高铁酸钠的过程中试剂3和试剂4的选择,发生的主要反应。 (4)讨论硫酸铜溶液的制备制备方法 (5)讨论无水氯化铝的制备的设计流程 (1)回答试剂1的选择方法和发生的主要反应 (2)回答加入过量的硫酸后发生的主要反应及反应的顺序从而判断滤液2中金属阳离子的成分 (3)回答备高铁酸钠的过程中试剂2的选择,发生的主要反应 (4)回答硫酸铜溶液的制备方法 (5)回答无水氯化铝的制备的设计过程 (1)应用物质分类方法将物质进行分类,并书写同类物质加入NaOH后发生的主要反应。 (2)复习过量的硫酸后Fe、Fe2O3、Cu2(OH)2CO3和硫酸及Fe和Cu和Fe3+的反应。 (3)如何判断反应的先后顺序。 (4)通过试剂2的选择,固体2制备硫酸铜溶液的方法的讨论渗透绿色化学、节能环保的思想。 (5)讨论硫酸铜溶液制备方法和无水氯化铝的制备流程复习盐类的水解原理,氧化还原反应、电化学知识 【环节2】 (1)总结1:处理复杂的反应体系时建立有序思维 (2)总结2:物质制备等工业实际归根到底是化学反应原理、氧化还原反应规律、主要物质化学性质、分离提纯方法的具体应用 (3)总结3:实现化学反应是多途径的;实现氧化还原的方式是多途径的;调控化学反应的手段是多途径的 倾听、思考、优化和调整自己思维 (1)处理复杂的反应体系时建立有序思维 (2)帮助学生意识到化学反应原理、氧化还原规律、分离提纯方法、物质分类思想等在解答实际问题的具体应用 (3)渗透元素化合物知识是认识化学反应原理知识的载体,化学反应原理为调控化学反应提供依据,建立起学生认识化学反应的视角 附件: 例.某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Cu2(OH)2CO3、少量Al2O3和少量Fe2O3,该厂用上述废金属屑制备CuSO4溶液、高铁酸钠(Na2FeO4)、无水AlCl3,请你帮助完成工艺流程: (1)试剂1______________,发生的主要反应的离子方程式:_____________________。 (2)试剂2__________________,固体1的成分_______________,滤液2中金属阳离子为:____________________。 (3)试剂3_____________________,试剂4_________________________。 (4)固体2的成分____________, 固体2制备硫酸铜溶液的方法: 反应原理 方法1 方法2 方法3 …… (5)请你设计流程2请画出流程图 流程1:_________________________________________________________________。 答案 (1)NaOH;2Al+2OH—+2H2O=2AlO2-+3H2、Al2O3+2OH-=2AlO2-+H2O (2)H2SO4;Cu、Fe、Cu2(OH)2CO3、Fe2O3;Fe2+。 (3)H2O2,NaOH (4)Cu 反应原理 方法1 2Cu+O2+2H2SO42CuSO4 + 2H2O 方法2 Cu+H2O2+H2SO4=CuSO4+2H2O (5)查看更多