- 2021-07-08 发布 |
- 37.5 KB |
- 15页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】云南省弥勒一中2019-2020学年高二下学期第三次月考(解析版)
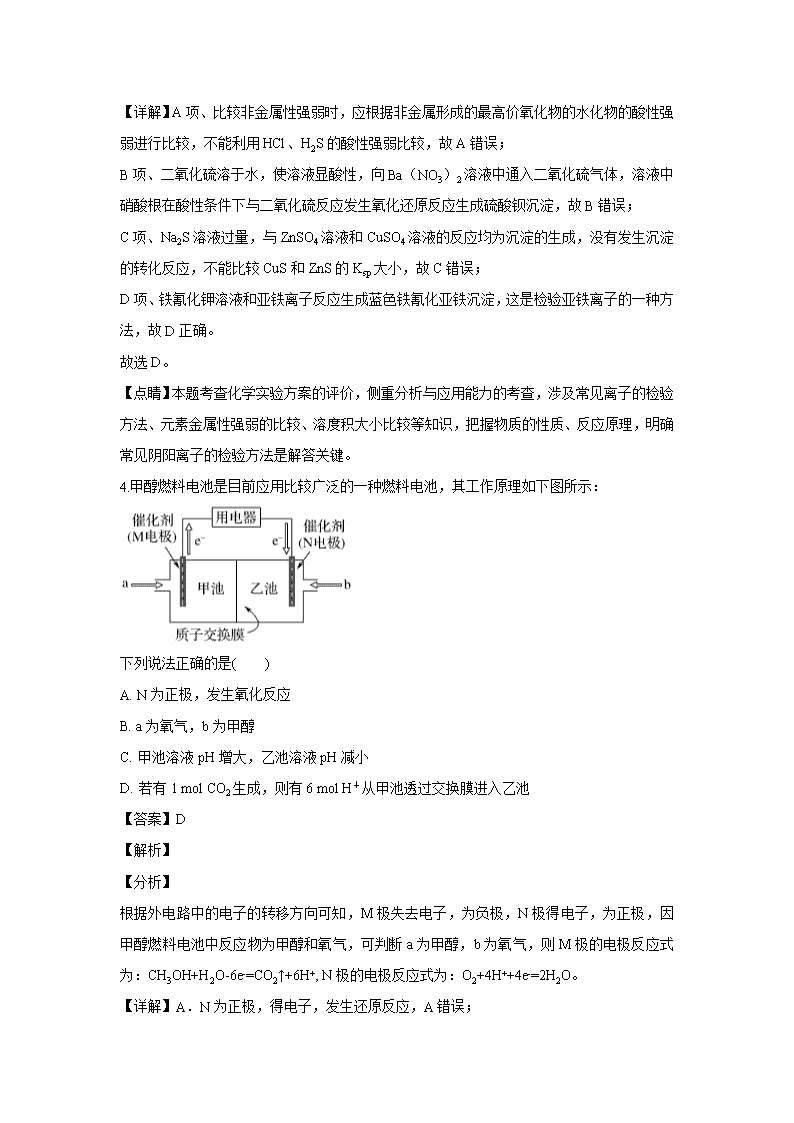
云南省弥勒一中2019-2020学年高二下学期第三次月考 本试卷可能用到的相对原子质量:H-1 C-12 O-16 第I卷(选择题) 一、选择题(每小题中只有一项是符合题意的。) 1.下列说法正确的是( ) A. 纤维素、花生油、蚕丝在一定条件下都能发生水解反应 B. 煤的干馏是化学变化,煤的气化、液化和石油的分馏都是物理变化 C. 新戊烷用系统命名法命名为2,2-二甲基戊烷 D. 正四面体烷()与立方烷()的二氯代物数目相同 【答案】A 【解析】 【详解】A项、纤维素在一定条件下发生水解反应最终生成葡萄糖,花生油是油脂,在一定条件下发生水解反应生成高级脂肪酸(或盐)和甘油,蚕丝的主要成分是蛋白质,在一定条件下发生水解反应最终生成氨基酸,故A正确; B项、煤的气化、液化是化学变化,故B错误; C项、新戊烷用系统命名法命名2,2—二甲基丙烷,故C错误; D项、正四面体烷的二氯代物有1种,立方烷的二氯代物有3种,故D错误。 故选A。 【点睛】本题考查有机物结构与性质,注意判断取代产物同分异构体的数目的方法是分析有机物的结构特点,确定不同位置的氢原子种数,再确定取代产物同分异构体数目。 2.NA 为阿伏加德罗常数的值,下列有关叙述正确的是( ) A. 标准状况下,1.12L 三氯甲烷(CHCl3)含有的化学键数目为0.2 NA B. 0.1mol-NH2 (氨基)中所含有的电子数NA C. 1L0.1mol·L-1Na2S溶液中,S2-、HS-和H2S的微粒数之和为0.2NA D. 乙烯和环丁烷(C4H8)的混合气体共28 g充分燃烧消耗3NA个O2 【答案】D 【解析】 【详解】A.标况下三氯甲烷为液体,不能利用气体摩尔体积计算其物质的填,A错误; B.1个-NH2中含有9个电子,0.1mol-NH2(氨基)中所含有的电子数0.9NA,B错误; C.1L0.1mol·L-1Na2S溶液,Na2S的物质的量为:1L×0.1mol·L-1=0.1mol,根据元素守恒可得:S2-、HS-和H2S的微粒数之和为0.1NA,C错误; D.乙烯和环丁烷(C4H8)的最简式均为CH2,则两者的混合气体共28g含有的CH2的物质的量为:28g÷(14g·mol-1)=2mol,可书写出:2CH2+3O2=2H2O+2CO2(实际上没有CH2这种物质,这样写仅仅是为了方便计算),所以2molCH2充分燃烧消耗3NA个O2,D正确; 答案选D。 3.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验操作、现象、结论或解释正确的是 选项 实验操作 现象 结论或解释 A 向Na2S溶液中滴加盐酸 有臭鸡蛋气味的气体产生 氯的非金属性比硫的强 B 向Ba(NO3)2溶液中通入SO2气体 产生白色沉淀 沉淀是BaSO3 C 将0.1mol/L ZnSO4溶液加入1mol/LNa2S溶液至不再有沉淀产生,再滴加0.1mol/L CuSO4溶液 先有白色沉淀生成后变为黑色沉淀 Ksp(CuS) > Ksp(ZnS) D 向某溶液中滴加K 3[Fe(CN)6] (铁氰化钾) 溶液 有蓝色沉淀产生 该溶液中一定含有Fe2+ A. A B. B C. C D. D 【答案】D 【解析】 【分析】 A、Na2S溶液与盐酸的反应是强酸制弱酸的反应; B、向Ba(NO3)2溶液中通入二氧化硫气体,溶液中硝酸根在酸性条件下与二氧化硫反应发生氧化还原反应生成硫酸钡沉淀; C、Na2S溶液过量,均为沉淀的生成,不发生沉淀的转化,不能比较Ksp大小; D、亚铁离子和铁氰化钾溶液反应生成蓝色沉淀 【详解】A项、比较非金属性强弱时,应根据非金属形成的最高价氧化物的水化物的酸性强弱进行比较,不能利用HCl、H2S的酸性强弱比较,故A错误; B项、二氧化硫溶于水,使溶液显酸性,向Ba(NO3)2溶液中通入二氧化硫气体,溶液中硝酸根在酸性条件下与二氧化硫反应发生氧化还原反应生成硫酸钡沉淀,故B错误; C项、Na2S溶液过量,与ZnSO4溶液和CuSO4溶液的反应均为沉淀的生成,没有发生沉淀的转化反应,不能比较CuS和ZnS的Ksp大小,故C错误; D项、铁氰化钾溶液和亚铁离子反应生成蓝色铁氰化亚铁沉淀,这是检验亚铁离子的一种方法,故D正确。 故选D。 【点睛】本题考查化学实验方案的评价,侧重分析与应用能力的考查,涉及常见离子的检验方法、元素金属性强弱的比较、溶度积大小比较等知识,把握物质的性质、反应原理,明确常见阴阳离子的检验方法是解答关键。 4.甲醇燃料电池是目前应用比较广泛的一种燃料电池,其工作原理如下图所示: 下列说法正确的是( ) A. N为正极,发生氧化反应 B. a为氧气,b为甲醇 C. 甲池溶液pH增大,乙池溶液pH减小 D. 若有1 mol CO2生成,则有6 mol H+从甲池透过交换膜进入乙池 【答案】D 【解析】 【分析】 根据外电路中的电子的转移方向可知,M极失去电子,为负极,N极得电子,为正极,因甲醇燃料电池中反应物为甲醇和氧气,可判断a为甲醇,b为氧气,则M极的电极反应式为:CH3OH+H2O-6e-=CO2↑+6H+, N极的电极反应式为:O2+4H++4e-=2H2O。 【详解】A.N为正极,得电子,发生还原反应,A错误; B.a为甲醇,b为氧气,B错误; C.装置中有质子交换膜,可推测电解质溶液为酸溶液,由M极的电极反应式为:CH3OH+H2O-6e-=CO2↑+6H+可知,甲池中消耗水,则酸溶液的浓度增大,pH变小;乙池中消耗H+生成水,酸溶液pH变大,C错误; D.若有1 mol CO2生成,根据CH3OH+H2O-6e-=CO2↑+6H+可知,电池中转移6mole-,根据O2+6H++6e-=3H2O可知,则有6 mol H+从甲池透过交换膜进入乙池参与反应,D正确; 答案选D。 5.Y是一种皮肤病用药,它可以由原料X经过多步反应合成。 下列说法正确的是 A. X与Y互为同分异构体 B. 1mol X最多可以与5mol H2发生加成反应 C. 产物Y能发生氧化、加成、取代、消去反应 D. 1 molY最多能与2mol NaOH发生反应 【答案】A 【解析】 【详解】A.原料X与中间体Y的分子式相同,但结构不同,则二者互为同分异构体,故A正确; B.能与氢气反应的为苯环和碳碳双键,则1mol X最多可以与4mol H2发生加成反应,故B错误; C.羟基连接在苯环上,且与羟基相连的碳原子的相邻碳上没有H原子,不能发生消去反应,故C错误; D.能与氢氧化钠反应的为酚羟基和酯基,1molY中含有1mol酚羟基形成的酯基,可水解生成酚羟基和羧基,消耗2molNaOH,还有1mol酚羟基,消耗1molNaOH,共消耗3mol,故D错误; 故选A。 6.下列叙述正确的是( ) A. 甲苯既可使溴的CCl4溶液褪色,也可使KMnO4酸性溶液褪色 B. 有机物的消去产物有2种 C. 鉴别乙醇和苯:将少量的酸性KMnO4溶液分别滴入少量的乙醇和苯中 D. 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CHCOOCH3 【答案】C 【解析】 【详解】A.甲苯不能使溴的四氯化碳溶液褪色,而能被高锰酸钾氧化,使高锰酸钾溶液褪色,故A错误; B.的结构对称,其消去产物只有一种,故B错误; C.将少量的酸性KMnO4溶液分别滴入少量的乙醇和苯中,乙醇能使酸性KMnO4溶液褪色,而苯不能使酸性KMnO4溶液褪色,所以能将两者鉴别出来,C正确; D.有机物A(C4H6O2)能发生加聚反应,则一定含碳碳双键,A的结构可能是:CH2=CHCOOCH3、CH2=CHCH2COOH等,故D错误; 答案选C。 7.由丁醇(X)制备戊酸(Z)的合成路线如图所示,不正确的是 A. Y的结构有4种 B. X、Z能形成戊酸丁酯,戊酸丁酯最多有16种 C. 与X互为同分异构体,且不能与金属钠反应的有机物有4种 D. 与Z互为同分异构体,且能发生水解反应的有机物有9种 【答案】C 【解析】 【详解】A、丁基有四种结构:,Y是丁基和溴原子结合而成,所以有四种结构,故A正确; B、戊酸丁酯中的戊酸,相当于丁基连接一个—COOH ,所以有四种结构,而丁醇是丁基连接一个—OH,所以也有四种结构,因此戊酸丁酯最多有16种,故B正确; C、X为丁醇,其同分异构体中不能与金属钠反应的是醚,分别是C—O—C—C—C、C—C—O—C—C和共3种,所以C错误; D、Z是戊酸,其同分异构体能发生水解的属于酯类,HCOOC4H9有4种,CH3COOC3H7有2种,CH3CH2COOCH2CH3、CH3CH2CH2COOCH3、(CH3)2CHCOOCH3,所以共9种,故D正确。 正确答案为C。 【点睛】注意B选项的戊酸丁酯的同分异构体还有很多,但题中要的是戊酸丁酯最多有多少种?这是很容易搞错的;本题正确解答的关键是掌握住丁基、丙基的结构有几种。 第II卷(非选择题) (一)必做题 8.用下图所示装置制备乙酸乙酯粗产品(加热和夹持装置等省略),有关数据如下表所示: 物质 C2H5OH CH3COOH CH3COOC2H5 密度g/cm3 0.79 1.05 0.90 沸点/℃ 78.3 118 77.1 已知:乙醇可以和氯化钙反应生成微溶于水的CaC12·6C2H5OH。在三颈烧瓶内将过量的乙醇和少量的浓硫酸混合,然后经恒压分液斗边滴加酸,边加热蒸馏。得到含有乙醇、醋酸和水的乙酸乙酯粗产品。 (1)混合乙醇与浓硫酸时,应先加入的试剂是_______;浓硫酸的作用是__________。 (2)边滴加醋酸,边加热蒸馏的目的是_______。将粗产品再经下列步骤精制: (3)为除去其中的醋酸,可向粗产品中加入______(填序号)。 A.无水乙醇 B.碳酸钠粉末 C.无水醋酸钠 (4)向其中加入饱和氯化钙溶液。振荡、分离。其目的是______。 (5)然后再向其中加入无水硫酸钠,振荡,静置,以除去水分。最后,将经过上述处理后的液体放入一干燥的蒸馏烧瓶内。再蒸馏,弃去低沸点馏分,收集沸程76℃~____℃(填“78”或“118“)之间的馏分即得纯净的乙酸乙酯。 (6)在实验中原料用量:23.0mL乙醇、15.0mL冰醋酸,最终得到16.0mL乙酸乙酯,则本次实验中乙酸乙酯的产率为________(百分数精确到0.1)。 【答案】 (1). 乙醇 (2). 催化作用、吸水作用 (3). 增加反应物浓度,同时蒸出乙酸乙酯,使平衡向正反应方向移动 (4). B (5). 除去未反应的乙醇 (6). 78 (7). 62.5% 【解析】 【详解】(1)浓硫酸溶于水放出大量的热,且密度比水大,为防止酸液飞溅,应先在烧瓶中加入一定量的乙醇,然后慢慢将浓硫酸加入烧瓶,边加边振荡;浓硫酸的作用是: 浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,所以浓硫酸的作用为催化作用,吸水作用; (2)因为制取乙酸乙酯的反应是个可逆反应,边滴加醋酸,边加热蒸馏,目的是增加反应物浓度,同时蒸出乙酸乙酯,使平衡向正反应方向移动,乙酸乙酯的产率就高了; (3)为除去其中的醋酸,可向粗产品中加入碳酸钠粉末,可生成二氧化碳气体和水而将醋酸除去,醋酸钠与醋酸不反应,选B; (4)根据已知:乙醇可以和氯化钙反应生成微溶于水的CaC12·6C2H5OH,所以向其中加入饱和氯化钙溶液的目的是除去未反应的乙醇; (5)乙酸乙酯的沸点为77.1℃,所以收集沸程76℃~78℃之间的馏分即得纯净的乙酸乙酯; (6) CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O,在实验中原料用量:23.0mL乙醇的物质的量为:; 15.0mL冰醋酸的物质的量为:; 16.0mL乙酸乙酯的物质的量为:; 可见乙醇是过量的,理论上会生成2.625×10-4mol乙酸乙酯,但实际上生成的乙酸乙酯的物质的量为1.64×10-4mol,所以实验中乙酸乙酯的产率为:。 9.甲醇是重要的化工原料,在有机合成中具有广泛应用。 (1)用甲醇制取甲胺的反应为:CH3OH(g)+NH3(g)⇌CH3NH2(g)+H2O(g)△H 已知该反应中相关化学键的键能数据如下: 共价键 C―O H―O N―H C―N 键能/kJ·mol-1 351 463 393 293 则该反应的△H=______kJ·mol-1 (2)一定条件下,将2mol CO和6mol H2通入2L密闭容器中发生如下反应: 主反应:CO(g)+2H2(g)⇌CH3OH(g)△H<0 Ⅰ 副反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H<0 Ⅱ 反应到t min时,达到平衡状态。平衡时CH3OH的体积分数φ(CH3OH)随温度、压强的变化如图所示: ①图中a___b(填“大于”或“小于”)。图中Y轴表示温度,其理由是_________; ②若反应II的平衡常数K值变小,则下列说法中正确的是___________(填序号)。 A.平衡均向正反应方向移动 B.平衡移动的原因是升高了温度 C.达到新平衡后,φ(CH3OH)减小 D.容器中φ(CH3OCH3)增大 ③平衡时,M点CH3OH的体积分数为12.5%,c(CH3OCH3)=0.1mol·L-1,则此时CO的转化率为_____;用H2表示I的反应速率为_____mol·L-1·min-1。 (3)用NaOH溶液做CO2碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=11的溶液,则溶液中c()∶c()=___________[已知H2CO3的电离平衡常数为:K1=4.4×10−7、K2=5×10−11],溶液中c(Na+)_______ c()+2c()(填“>”“<”或“=”)。 【答案】 (1). -12 (2). 小于 (3). 随着Y值增加,CH3OH的体积分数φ (CH3OH)减小,平衡逆向移动,若增大压强,平衡会正向移动,故Y表示温度 (4). BC (5). 56% (6). (7). 1:5 (8). > 【解析】 【详解】(1)设C―H的键能为xkJ/mol,反应CH3OH(g)+NH3(g)⇌CH3NH2(g)+H2O(g)的△H=反应物总键能-生成物总键能=(3x+351+463+ 393×3- 3x- 293- 393×2-463×2)kJ/mol=-12 kJ/mol; (2)①副反应反应前后气体分子数不变,若增大压强,主反应正向移动,CH3OH的体积分数增大,根据图示信息可判断,随着Y的增大CH3OH的体积分数减小,故X轴代表的是压强,X轴上a点的数值比b点小;随着Y值的增加,CH3OH的体积分数φ (CH3OH)减小,平衡逆向移动,若增大压强,平衡会正向移动,故Y表示温度; ②Ⅱ:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H<0,若反应Ⅱ的平衡常数K值变小,平衡常数只与温度有关,反应Ⅱ的正反应为放热反应,故平衡移动的原因是升高了温度,升高温度两个反应都逆向移动,容器中φ(CH3OCH3)减小,φ(CH3OH)也减小,所以正确的是BC; ③平衡时,M点CH3OH的体积分数为12.5%,c(CH3OCH3)=0.1mol·L-1,则n(CH3OCH3)=0.2mol,根据2CH3OH(g)⇌CH3OCH3(g)+H2O(g),分解的CH3OH为0.4mol,生成的水为0.2 mol,设CO转化物质的量是x,则有: 则,解得x=1.12mol,此时CO的转化率为;;用H2表示I的反应速率为: ; (3)常温下,pH=11的溶液,其c(H+)=10-11mol/L,c(OH-)=10-3mol/L,由+H2O+OH-得,根据溶液,代入相关数据可计算出溶液中c()∶c()=1:5,由电荷守恒原理得:c(Na+)+c(H+)=c()+2c()+c(OH-),由于c(OH-)>c(H+),所以c(Na+)> c()+2c()。 10.高分子化合物M的合成路线如下: 已知: (1)A中含氧官能团的名称是______。 (2)反应①试剂和条件为_______,B的结构简式为_________。 (3)写出反应的①化学方程式__________。 (4)写出反应的⑥化学方程式________。 (5)D为酯类,2D → E + C2H5OH,F中含有醇羟基,写出下列物质的结构简式: E______ 、F_______。 (6)反应①~⑥中属于取代反应的有_______。 【答案】 (1). 羰基 (2). 浓硝酸/浓硫酸、加热 (3). (4). +HNO3 +H2O (5). (6). (7). (8). ①③ 【解析】 【分析】 根据C的结构简式和反应条件Fe/HCl可知,B到C是硝基还原成氨基,推出B的结构简式 ,根据B可知A在浓硝酸和浓硫酸,加热条件下发生取代反应生成B(),由此推测出A;根据产物M()逆推,可知单体G为,因为F中含有醇羟基,可知是F发生醇消去反应生成G,再联系C()的结构,可知F为,根据F()和C()逆推出E(),因为2D → E + C2H5OH,可知两分子D发生取代反应:2CH3COOC2H5 → + C2H5OH,可知D为CH3COOC2H5。 【详解】(1)由以上分析可知A的结构简式为,A中含氧官能团的名称是羰基; (2)反应①为+HNO3 +H2O,因此试剂和条件为浓硝酸/浓硫酸、加热,B的结构简式为; (3)反应①为+HNO3 +H2O; (4)根据产物M()逆推,可知单体G为,反应⑥为:n; (5)由上面分析可知:2CH3COOC2H5 → + C2H5OH,E为,F为; (6)反应①为硝化反应,属于取代反应,反应②为硝基还原为氨基,属于还原反应,反应③为乙酸乙酯发生分子间取代反应,④属于加成反应⑤属于消去反应⑥属于加聚反应,因此反应①~⑥中属于取代反应有①③。 (二)选做题:【化学——选修5:有机化学基础】 11.芳香烃R的分子式为C9H10,其苯环上只有一个取代基,R与H2 1:1加成后产物的核磁共振氢谱中有5组峰,峰面积之比为1:2:2:1:6。高聚物I和J在生产、生活中有广泛应用,其合成路线如图 已知:R′CH= CH2 R′CH2CH2Br 回答下列问题: (1)芳香烃R分子的官能团是________(填官能团结构)。 (2)R的最简单同系物是___________(填化学名称)。 (3)反应②的化学方程式为____________。 (4)③和⑦的反应类型分别属于___________、___________。 (5)反应⑤的化学方程式为_____________。 (6)H与T互为同分异构体,符合下列性质特征的H分子共有___________种 ①能发生银镜反应 ②和氯化铁溶液反应显紫色 ③能使溴的四氧化碳溶液褪色 (7)仿照上述合成路线,设计一条以R为主要原料制备的合成路线(无机试剂任选):____________。 【答案】 (1). (2). 苯乙烯 (3). +2NaOH+2NaBr (4). 氧化反应 (5). 酯化反应 (6). (7). 16 (8). 【解析】 【分析】 芳香烃R的分子式为C9H10,其苯环上只有一个取代基,R与H2 1:1加成后产物的核磁共振氢谱中有5组峰,峰面积之比为1:2:2:1:6,则R的结构简式是;R与溴的四氯化碳溶液发生加成反应生成的X为,X在氢氧化钠的水溶液中水解为Y,Y的结构简式为,Y催化氧化得Z(),Z 被银氨溶液氧化后、酸化得到的W的结构简式为,W发生聚合反应生成J(),W在浓硫酸作用下发生消去反应生成T,T是,T与乙醇发生酯化反应生成M,M是,M在一定条件下发生加聚反应生成I,I是。 【详解】(1)R的结构简式是,其中含有的官能团是; (2)R的最简单同系物应含有一个苯环和一个碳碳双键,其化学名称为苯乙烯; (3)在氢氧化钠的水溶液中水解为的化学方程式为+2NaOH+2NaBr; (4)反应③为催化氧化得的反应,反应类型为氧化反应;⑦为与乙醇发生的酯化反应,反应类型是酯化反应(或取代反应); (5)反应⑤W()发生聚合反应生成J()的化学方程式为:n→+(n-1)H2O; (6) T是,H与T互为同分异构体,H具有①能发生银镜反应,说明含有醛基;②和氯化铁溶液反应显紫色,说明含有酚羟基;③能使溴的四氧化碳溶液褪色,说明含有碳碳双键;苯环有2个取代基为—OH和—CH=CHCHO、—OH和—C(CHO)=CH2 ,两个取代基有邻、间、对三种位置关系,共有6种,苯环有3个取代基:—OH、—CH=CH2和——CHO,先确定其中两个取代基,有邻、间、对三种位置关系,第三个取代基依次取代苯环上的H,邻位、间位各有4种,对位有2种,符合条件的同分异构体有6+4+4+2=16种; (7)由已知:R′CH=CH2 R′CH2CH2Br,先与HBr/过氧化物、加热生成,水解生成,氧化为,路线为:。查看更多