江西省高安中学2019-2020学年高二下学期期中考试化学试卷
江西省高安中学2019-2020学年
高二下学期期中考试化学试卷
可能用到的相对原子质量:Na:23 Cl:58.5 Zn:65 Fe:56 Cu:64 Ni:59 S:32 O:16 Ba:137 Ca:40
一、单项选择题(48分,每小题3分)
1. 关于下列词句或谚语。说法不正确的是( )
A. “水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化
B. “曾青得铁化为铜”发生了化学变化
C. “滴水石穿、绳锯木断”不包含化学变化
D. “卤水点豆腐,一物降一物”的前半句话与胶体知识有关
2. 设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,4.48L的Cl2通入水中反应转移的电子数为0.2NA
B. 常温下pH=3的FeCl3溶液中由水电离出的H+的数目为0.001NA
C. 273K、l0lkPa下,22.4L甲烷充分燃烧后,所得气体产物的分子总数为NA
D. 1L0.lmol⋅L−1氢氧化钠溶液中含有的H-O键的数目为0.1NA
3.分类法在化学学科的发展中起到了非常重要的作用。下列物质分类不合理的是( )
A. 酸性氧化物:CO2、SO2、SiO2
B. 碱性氧化物:Na2O2、MgO、CaO
C. 电解质: BaSO4、KAl(SO4)2•12H2O 、HCl
D. 胶体: 烟水晶、硅酸溶胶、云雾
4.下列实验操作或方法正确的是( )
A. 检验某溶液中是否含有Fe2+时,先加入少量H2O2,再滴加KSCN溶液
B. 配制100mL lmol/L NaCl溶液时,用托盘天平称取5.85g NaCl固体
C. 将FeC13饱和溶液煮沸制备Fe(OH)3胶体
D. 用紫色石蕊溶液鉴别乙醇、乙酸和苯
5.与100mL0.1mol/L(NH4)2SO4溶液中NH4+离子浓度相同的是( )
A.10mL 1mol/L (NH4)2SO4溶液 B.50mL 0.2mol/L NH4Cl溶液
C.10mL0.05mol/L(NH4)2SO4溶液 D.200mL 0.1mol/L NH4NO3溶液
6.安全是顺利进行实验及避免伤害的保障。下列实验操作正确且不是从实验安全角度考虑的是( )
A.操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B.操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C.操作③:吸收氨气或氯化氢气体并防止倒吸
D.操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
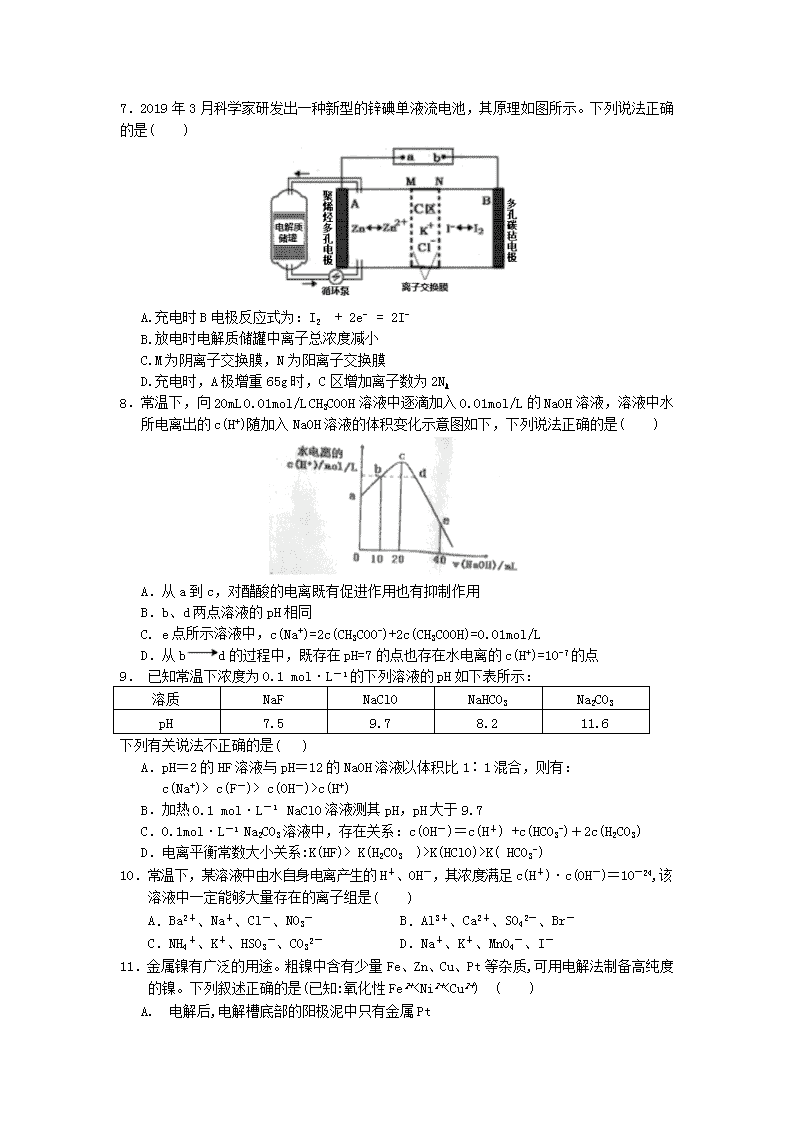
7.2019年3月科学家研发出一种新型的锌碘单液流电池,其原理如图所示。下列说法正确的是( )
A.充电时B电极反应式为:I2 + 2e- = 2I-
B.放电时电解质储罐中离子总浓度减小
C.M为阴离子交换膜,N为阳离子交换膜
D.充电时,A极增重65g时,C区增加离子数为2NA
8.常温下,向20mL 0.01mol/L CH3COOH溶液中逐滴加入0.01mol/L的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如下,下列说法正确的是( )
A.从a到c,对醋酸的电离既有促进作用也有抑制作用
B.b、d两点溶液的pH相同
C. e点所示溶液中,c(Na+)=2c(CH3COO-)+2c(CH3COOH)=0.01mol/L
D.从bd的过程中,既存在pH=7的点也存在水电离的c(H+)=10-7的点
9. 已知常温下浓度为0.1 mol·L-1的下列溶液的pH如下表所示:
溶质
NaF
NaClO
NaHCO3
Na2CO3
pH
7.5
9.7
8.2
11.6
下列有关说法不正确的是( )
A.pH=2的HF溶液与pH=12的NaOH溶液以体积比1∶1混合,则有:
c(Na+)> c(F-)> c(OH-)>c(H+)
B.加热0.1 mol·L-1 NaClO溶液测其pH,pH大于9.7
C.0.1mol·L-1 Na2CO3溶液中,存在关系:c(OH-)=c(H+) +c(HCO3-)+2c(H2CO3)
D.电离平衡常数大小关系:K(HF)> K(H2CO3 )>K(HClO)>K( HCO3-)
10.常温下,某溶液中由水自身电离产生的H+、OH-,其浓度满足c(H+)·c(OH-)=10-24,该溶液中一定能够大量存在的离子组是( )
A.Ba2+、Na+、Cl-、NO3- B.Al3+、Ca2+、SO42-、Br-
C.NH4+、K+、HSO3-、CO32- D.Na+、K+、MnO4-、I-
11.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍。下列叙述正确的是(已知:氧化性Fe2+
②>④>③
C. ①、④两溶液混合后,若溶液呈中性,则所得溶液中2c(NH4+)=c(SO42-)
D. V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=11:9
13.已知H2A为二元酸,其酸式盐NaHA的水溶液呈碱性,则下列有关结论错误的是( )
A.H2A为二元弱酸
B.NaHA水溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-)
C.物质的量浓度相同时,碱性:Na2A>NaHA
D.H2A在水溶液中电离方程式为:H2A=2H++A2-
14.某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。有关原溶液中说法不正确的是( )
A. 至少存在4种离子
B. Cl-一定存在,且c(Cl-)≥0.4mol / L
C. SO42-、NH4+、Fe3+一定存在,Al3+、K+、Cl-可能存在
D. SO42-、NH4+、Fe3+、Cl-一定存在,CO32-一定不存在
15.常温下,下列有关溶液的说法不正确的是( )
A.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则混合液中
c(R2﹣)>c(Na+)>c(HR﹣)
B.将0.2 mol/L的某一元弱酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液中存在:
2c(OH﹣)+c(A﹣)=2c(H+)+c(HA)
C.某物质的水溶液中由水电离出的c(H+)=1×10﹣amol/L,若a>7,则该溶液的pH为a或14-a
D.相同温度下,0.2mol/L的醋酸溶液与0.1mol/L的醋酸溶液中c(H+)之比小于2:1
16.向含MgCl2和CuCl2的溶液中逐滴加入0.1mol·L—的NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知V2=3V1,下列说法正确的是( )
A.原溶液中MgCl2和CuCl2的物质的量浓度相等
B.该实验不能证明Cu(OH)2的Ksp比Mg(OH)2的Ksp小
C.水的电离程度:A>B>C
D.若向Mg(OH)2悬浊液中加入CuCl2溶液,一定会有Cu(OH)2生成
二、非选择题(52分)
17.(8分)现有下列物质:①稀硫酸 ②小苏打 ③氨水 ④二氧化碳 ⑤FeCl3固体
⑥稀NaOH溶液 ⑦硝酸亚铁溶液。
(1)上述物质中属于电解质的物质序号为______ 。
(2)有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是______。
(3)加入盐酸、NaOH溶液均能发生化学反应的物质序号为______。
(4)能导电的物质序号为_______________。
(5)④与⑥充分反应后,将溶液小火蒸干,得到固体混合物。固体组成成分可能是(用化学式表示)___________________________。
(6)实验室用⑤制备胶体的化学方程式为__________________________________。如果将1molFeCl3全部制成胶体,制得的胶体________(选填“带负电”“电中性”“带正电”),胶粒数目________NA(选填“大于”“等于”“小于”)。
18.(12分)人体血液里Ca2+的浓度一般采用mg·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
I.(配制酸性KMnO4标准溶液)如图是配制50 mL酸性KMnO4标准溶液的过程示意图。
(1)请你观察图示判断其中不正确的操作有 (填序号)。
(2)其中确定50 mL溶液体积的容器是 (填名称)。
(3)如果按照图示的操作所配制的溶液进行实验,在其他操作均正确的情况下,所测的实验结果将_______(填“偏大”或“偏小”)。
II.(测定血液样品中Ca2+的浓度)抽取血样20. 00 mL,经过上述处理后得到草酸,再用0.020 mol/L酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL酸性KMnO4溶液。
(4)已知草酸与酸性KMn04溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mnx++10CO2↑+8H2O,则式中的x=____。
(5)滴定时,根据现象____,即可确定反应达到终点。
(6)经过计算,血液样品中Ca2+的浓度为____mg.cm-3。
19.(8分)设计出燃料电池使汽油氧化直接产生电流是本世纪最具有挑战性的课题之一。最近有人制造了一种燃料电池,一个极通入空气,另一个极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,回答如下问题:
(1)以丁烷为汽油代表,这个电池放电时发生的化学反应的方程式是:__________________;
(2)这个电池负极发生的反应是:C4H10+13O2--26e-=4CO2+5H2O,正极发生的反应是:_______________;固体电解质里O2-的移动方向是:______________________________;向外电路释放电子的电极是:__________;
(3)人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油产生动力的主要原因是:______________;
(4)汽油燃料电池最大的障碍是氧化反应不完全产生____________堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年,这正是新一代化学家的历史使命。
(5)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2,溶于水达到平衡时,溶液的pH=5.6 c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则
H2CO3 H++的平衡常数K1=__________(已知:10-5.60=2.5×10-6)
20.(12分)现有浓度为0.1 mol·L-1的五种电解质溶液:
① Na2CO3 ② NaHCO3 ③ NaAlO2 ④ CH3COONa ⑤ NaOH
已知:CO2+3H2O+2AlO2-===2Al(OH)3↓+CO32-
(1)这五种溶液的pH由小到大的顺序是___ ___(填编号);
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是____ __(填编号);
(3)混合碳酸(H2CO3)溶液和NaAlO2溶液,试写出所有可能发生的化学反应方程式:
;
(4)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号
HA物质的量浓度(mol/L)
NaOH物质的量浓度(mol/L)
混合溶液的pH
甲
0.20
0.20
pH=a
乙
0.10
0.10
pH=8.00
不考虑乙组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸 ;
乙组实验所得混合溶液中由水电离出的c(OH-)= mol/L。
求出该混合溶液中下列算式的结果。
I.c(Na+)-c(A-)= ;
Ⅱc.(OH-)-c(HA)= 。
21.(共12分)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图甲是高铁电池的实验装置:已知放电后,两极得到铁的相同价态的化合物。
(1)该电池放电时正极发生的电极反应是_ 。
(2)若该电池属于二次电池,则充电时阴极反应的电极反应式为 。
(3)已知盐桥中含有饱和KCl溶液,放电时,盐桥的作用是 。此盐桥中阴离子的运行方向是___________ ;若用某种高分子材料制成隔膜代替盐桥,该隔膜允许通过的离子是___________ 。
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10−5mol·L−1)时,溶液中c(Ag+)为___________mol·L−1,此时溶液中c(CrO42-)等于__________ mol·L−1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10−12和2.0×10−10)。
化学答案
一、选择题
1-5 CCBDB 6-10 DCDAA 11-16 BCDCAC
二、填空题
17.(9分)(除标注外,其余每空1分)
(1) ⑤ (2) ⑥
(3)⑦ (4)⑥⑦
(5)NaOH和Na2CO3 NaHCO3和Na2CO3 (2分)
(6)FeCl3+3H2O=FeCl3(胶体)+3HCl 电中性 小于
18.(11分)(除标注外,其余每空2分)
I、(1)⑤ (2) 50mL 容量瓶 (3)偏小
II、(4)2 (1分) (5) 溶液由无色变为浅红色,且半分钟内不变色 (6)1.2
19、(8分)(除标注外,其余每空1分)
(1)2C4H10+13O2=8CO2+10H2O
(2)O2+4e-=2O2-_(2分)
向负极移动 负极
(3) 燃料电池具有较高的能量利用率
(4)碳粒
(5)4.2×10-7
20、(12分)(除标注外,其余每空1分)
( 1 ) ④⑤
( 2 ⑤
(3)NaAlO2+ H2CO3 +H2O=NaHCO3+Al(OH)3↓、NaHCO3+NaAlO2+H2O=Na2CO3+Al(OH)3↓、
H2CO3+2NaAlO2+2H2O=Na2CO3+2Al(OH)3↓、H2CO3+Na2CO3=NaHCO3(4分,写其它方程式不得分,H2CO3 写成H2O+CO2给分);
(4)a=7时,HA是强酸;a>7时,HA是弱酸 ; 10-6,
I、9.9×10-7 mol/L(2分)II、1.0×10-8 mol/L(2分)(计算结果正确,计算结果没带单位不得分)
21、(12分)
(1)FeO42-+4H2O+3e- =Fe(OH)3↓+5OH-
(2)Fe(OH)3+3e- =Fe+3OH-
(3)平衡溶液中的电荷,形成闭合回路 左池到右池(1分) K+和H+(1分)
(4)2.0×10-5 5.0×10-3