福建省泉州市2019-2020学年高二上学期期末教学质量跟踪监测 化学
泉州市2019-2020学年度上学期高中教学质量跟踪监测试卷
高二化学(化学反应原理)
2020.1
(试卷满分100分,考试时间:90分钟)
温馨提示:
1.试卷共8页,1-4页为第I卷,5-8页为第II卷。
2.请将试题答案统一填写在答题卷上。
可能用到的相对原子质量:H1 O16 Cu64
第I卷(选择题,共42分)
一、选择题(每小题只有一个选项符合题意,本题包括18小题,1-12小题,每小题2分,13-18小题,每小题3分,共42分。)
1.化学与生活密切相关,下列说法错误的是
A.热的碳酸钠溶液可用于去除餐具的油污 B.燃烧木柴时,采用较细木材并将木柴架空
C.明矾可用作净水剂 D.一次性干电池的工作原理是电能转化为化学能
2.下列物质中,属于弱电解质的是
A.SO2 B.NH3·H2O C.NH4NO3 D.BaCO3
3.下列化学用语正确的是
A.NaHCO3的电离:NaHCO3=Na++H++CO32-
B.Na2SO3的水解:H2O+SO32-HSO3-+OH-
C.Fe(OH)3的溶解:Fe(OH)3=Fe3++3OH-
D.H2S的电离:H2S2H++S2-
4.在0.1 mol·L-1的CH3COOH溶液中,要促进醋酸电离且使H+浓度增大,应采取的措施是
A.升温 B.降温 C.加入NaOH溶液 D.加入稀盐酸
5.关于电解精炼铜的说法不正确的是
A.粗铜作阳极、纯铜作阴极 B.电解液一定含有Cu2+
C.阳极反应只有Cu-2e-=Cu2+ D.阴极反应只有Cu2++2e-=Cu
6.下列事实能用电化学原理解释的是
①常温条件下,铝在空气中不容易被腐蚀
②用颗粒较小的大理石与盐酸制二氧化碳,反应速率较快
③远洋海轮的尾部装上一定数量的锌板,轮船不容易被腐蚀
A.仅① B.仅③ C.仅②③ D.①②③
7.下列关于反应能量的说法正确的是
A.已知2C(s)+O2(g)=2CO(g) △H,△H表示碳的燃烧热
B.若C(s,石墨)=C(s,金刚石) △H>0,则石墨比金刚石稳定
C.已知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2
D.H++(aq)+OH-(aq)=H2O(l) △H=-57.3 mol·L-1,含1 mol NaOH的氢氧化钠溶液
与含0.5 mol H2SO4的浓硫酸混合后放出57.3kJ的热量
8.下列有关说法正确的是(水合离子用相应离子符号表示)
A.甲图:铁被腐蚀Fe-3e-=Fe3+
B.乙图:电解CuCl2溶液CuCl2=Cu2++2Cl-
C.丙图:CH3COOH在水中电离CH3COOHCH3COO-+H+
D.丁图:CO与H2反应CO(g)+2H2(g)=CH3OH(g) △H=+91 kJ·mol-1
9.甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。能说明反应已达到化学平衡状态的是
A.容器内CO2、H2、CH3OH、H2O(g)的浓度之比为1:3:1:1
B.生成1 mol H2O,同时消耗3 mol H2
C.体系中物质的总质量不变
D.恒温恒容下,密闭容器中压强保持不变
10.工业合成氨反应为:N2+3H22NH3 △H<0。下列因素能用勒夏特列原理解释的是
①高温 ②高压 ③分离出液氨 ④加催化剂
A.仅① B.仅② C.仅②④ D.仅②③
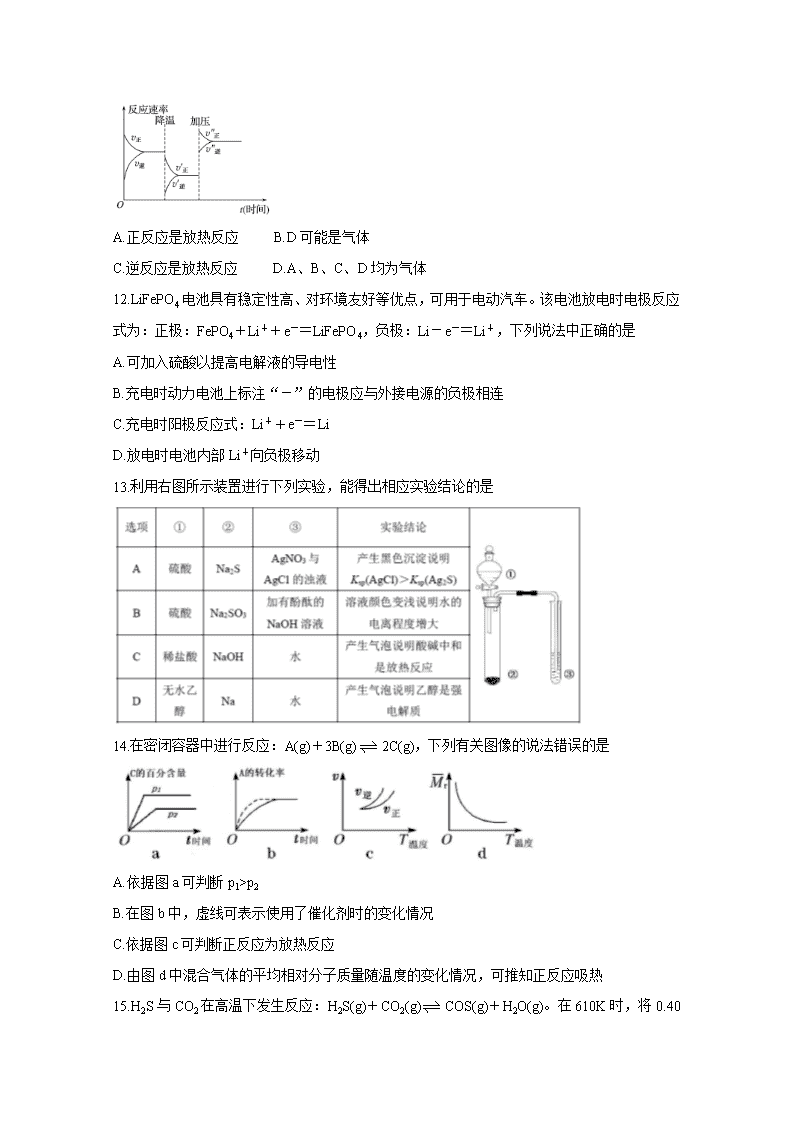
11.如图是可逆反应A+2B2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断下列说法正确的是
A.正反应是放热反应 B.D可能是气体
C.逆反应是放热反应 D.A、B、C、D均为气体
12.LiFePO4电池具有稳定性高、对环境友好等优点,可用于电动汽车。该电池放电时电极反应式为:正极:FePO4+Li++e-=LiFePO4,负极:Li-e-=Li+,下列说法中正确的是
A.可加入硫酸以提高电解液的导电性
B.充电时动力电池上标注“-”的电极应与外接电源的负极相连
C.充电时阳极反应式:Li++e-=Li
D.放电时电池内部Li+向负极移动
13.利用右图所示装置进行下列实验,能得出相应实验结论的是
14.在密闭容器中进行反应:A(g)+3B(g)2C(g),下列有关图像的说法错误的是
A.依据图a可判断p1>p2
B.在图b中,虚线可表示使用了催化剂时的变化情况
C.依据图c可判断正反应为放热反应
D.由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应吸热
15.H2S与CO2在高温下发生反应:H2S(g)+CO2(g)COS(g)+H2O(g)。在610K时,将0.40
mol H2S与0.10 mol CO2充入1L的空钢瓶中,10min后,反应达到平衡,此时水的物质的量分数为0.02。下列说法错误的是
A.反应平衡常数表达式为K=
B.前10min,反应速率v(H2S)=0.001 mol·L-1·min-1
C.在620K重复试验,平衡后水的物质的量分数为0.03,该反应的△H<0
D.在610K时,H2S的平衡转化率α为2.5%
16.25℃时的三种溶液:①pH=2的醋酸;②pH=2的硫酸;③pH=12的氢氧化钠溶液。下列有关说法正确的是
A.将①溶液用蒸馏水稀释,使体积扩大100倍,所得溶液pH变为4
B.①与②两溶液的物质的量浓度相等
C.V1L②溶液和V2L③溶液混合,若混合后溶液pH=3,则V1:V2=11:9
D.①与③两溶液等体积混合,混合液pH=7
17.已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12。在只含有KCl、K2CrO4的混合溶液中滴加0.0010 mol/L的AgNO3溶液,当AgCl与Ag2CrO4共存时,测得溶液中CrO42-的浓度是5.000×10-3 mol/L,此时溶液中Cl-的物质的量浓度是
A.8.90×10-6 mol/L B.1.36×10-5 mol/L C.1×10-5 mol/L D.4.45×10-2 mol/L
18.25℃时,Na2SO3溶液吸收SO2,溶液pH随n(SO32-):n(HSO3-)变化的关系如下表:
以下离子浓度关系的判断正确的是
A.NaHSO3溶液中c(H+)
c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液中n(SO32-):n(HSO3-)=1:1时,c(Na+)=c(SO32-)+c(HSO3-)
D.当吸收液呈中性时,c(Na+)>c(HSO3-)+c(SO32-)
第I卷(非选择题 共58分)
二、填空题(本题共有6小题,共58分)
19.(7分)(1)一种分解海水制氢气的方法为2H2O(l)H2(g)+O2(g)。下图为此反应的能量变化示意图,使用催化剂TiO2后图中A点将 (填“升高”、“降低”或“不变”)。
(2)已知:
①2H2(g)+O2(g)=2H2O(g) △H1=-483.6 kJ·mol-1
②H2O(g)=H2O(l) △H2=-44 kJ·mol-1
反应①中化学键的键能数据如下表:
由此计算a= kJ·mol-1;氢气的燃烧热△H= kJ·mol-1。
(3)1 g C(s,石墨)与适量水蒸气反应生成CO和H2,需要吸收10.94kJ热量,此反应的热化学方程式为 。
20.(7分)液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图甲所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。以该燃料电池为电源电解足量饱和CuCl2溶液的装置如图乙所示。
(1)甲中b电极称为 极(填“正”或“负”)。
(2)乙中d电极发生 反应(填“氧化”或“还原”)。
(3)当燃料电池消耗0.15 mol O2时,乙中电极增重 g。
(4)燃料电池中使用的阴离子交换膜只允许阴离子和水分子通过。甲中OH-通过阴离子交换膜向 电极方向移动(填“a”或“b”)。
(5)燃料电池中a的电极反应式为 。
21.(12分)过氧化氢的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某同学取一定量的过氧化氢溶液,通过滴定法测定了过氧化氢的含量。请填写下列空白:
(1)移取25.00mL密度为1.00g·mL-1的过氧化氢溶液至250mL (填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用0.1 mol/L高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写完整。
口MnO4-+口H2O2+口H+=口Mn2++口H2O+口
(3)滴定前,取 (填“酸式”或“碱式”)滴定管,水洗后要 (填操作名称),再注入高锰酸钾标准溶液,调整滴定管的尖嘴充满液体。如图,滴定管的读数方法 (填“A”、“B”或“C”)。
(4)滴定终点的现象是 。
(5)重复滴定三次,数据如下表:
平均耗用高锰酸钾标准溶液的体积V为 mL,原过氧化氢溶液中过氧化氢的质量分数为 %(保留两位有效数字)。
(6)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果 (填“偏高”、“偏低”或“不变”)。
22.(10分)煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气。
I.tΩ时,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,2SO2(g)+O2(g)2SO3(g),其起始物质的量及SO2的平衡转化率如下表所示。
回答下列问题:
(1)该反应的平衡常数K表达式为 。
(2)SO2的平衡转化率:α1 α2(填“>”、“<”或“=”)。
(3)平衡时,甲、丁两容器中SO3的浓度分别为c1、c2,则c1 c2(填“>”、“<”或“=”)。
II.向体积为2L的恒容密闭容器中充入1 mol SO2、4 mol CO和催化剂,发生反应SO2(g)+2CO(g)2CO2(g)+S(g) △H,测得温度对SO2的转化率及催化剂效率的影响如图所示:
(4)该反应的△H 0(填“>”或“<”,下同);图中M、N两点的平衡常数:K(M) K(N)。
(5)M点时的化学平衡常数K= 。
(6)工业生产时,该反应最佳温度为250℃,其原因是 。
23.(12分)I.氯化铁可用于金属蚀刻,污水处理。
(1)25℃时,FeCl3溶液的pH 7(填“>”、“<”或“=”),原因是(用离子方程式表示) 。把FeCl3溶液蒸干灼烧得到的主要产物是 。
(2)为了探究外界条件对氯化铁水解平衡的影响,某研究性学习小组设计实验方案,获得如下数据:
下列说法正确的是 (填序号)
A.上述实验能判断出温度对氯化铁水解的影响
B.表格中x>y>z
C.上述实验能得出:增大盐的浓度,水解平衡正向移动,水解程度越大
II.已知:某酸HA Ka=4.0×10-7(298K)25℃时,向100 mL 0.1 mol·L-1HA的溶液中逐滴加入0.2 mol·L-1 NaOH溶液,所得溶液的pH随NaOH溶液的体积变化如图所示(溶液体积变化忽略不计)。
(3)25℃时,0.1 mol·L-1 HA溶液中由水电离出的c(H+)= mol·L-1。
(4)在X点时,溶液中各离子浓度由大到小的排列顺序是 。
(5)在K点时,溶液中c(OH-)+c(A-)-c(H+)= mol·L-1。
(6)25℃时,在N点时NaA的水解平衡常数Kh为 (填数值)。
24.(10分)废弃物的综合利用既有利于资源节约,又有利于环境保护。某研究性学习小组利用含银废液[银主要以Ag(S2O3)23-形式存在]为原料制备硝酸银,工艺流程如下:
已知:1.常温下Ag2S的Ksp为2.0×10-48
2.Na2CO3与少量硼砂是为了降低灼烧温度
请回答下列问题:
(1)操作I的名称是 。
(2)用NaOH溶液将pH调至8,其目的是 。
(3)“反应”工序中,常温下加入Na2S溶液生成Ag2S沉淀,当溶液中Ag+完全沉淀[c(Ag+)≤
1.0×10-5 mol·L-1]时,溶液中c(S2-)为 mol·L-1。
(4)称取Na2CO3和硼砂并与Ag2S混合,研细后置 中灼烧(选填“坩埚”或“蒸发皿”),灼烧反应的化学方程式为 。
(5)将制得Ag溶解在稀HNO3溶液中,蒸发,干燥,即可制得AgNO3。写出HNO3与Ag反应的化学反应方程式 。
(6)从绿色化学的要求看,上述流程中存在的不足为 。
泉州市2019—2020学年度上学期高中教学质量跟踪监测试卷
高二化学(化学反应原理)参考答案 2020.1
题号
1
2
3
4
5
6
7
8
9
答案
D
B
B
A
C
B
B
C
D
题号
10
11
12
13
14
15
16
17
18
答案
D
A
B
B
D
C
C
A
D
一、选择题答题表(本题共18小题,1-12题每题2分,13-18每题3分,共42分)
二、填空题(本题共6小题,共58分)
19.(7分)
(1)降低 (1分)
(2)439.2 ,-285.8 (各2分,共4分)
(3)C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.28 kJ·mol−1 (2分)
20.(7分)
(1)正 (1分)
(2)还原 (1分)
(3)19.2 (2分)
(4)a (1分)
(5)N2H4+4OH--4e-===N2↑+4H2O (2分)
21.(12分)
(1)容量瓶 (1分)
(2)2 5 6 2 8 5O2↑ (2分)
(3)酸式 ,润洗 , B (各1分,共3分)
(4)滴入最后一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色 (2分)
(5)14.50 ,4.9% (5.0%或4.8%也给分) (1分,2分,共3分)
(6)偏高 (1分)
22.(10分)
I. (1)K= (1分)
(2) < (1分)
(3) > (2分)
II. (4) < ,> (各1分,共2分)
(5)(或0.11) (2分)
(6)此温度下催化效率最高,转化率适中。升高温度,SO2转化率降低;降低温度,反应变慢且催化效率下降。 (2分)
23.(12分)
I. (1)< ,Fe3++3H2OFe (OH)3 +3H+ ,Fe2O3 (各1分,共3分)
(2)A (1分)
II.(3) 5.0×10-11 (2分)
(4)c(A-)>c(Na+)>c(H+)>c(OH-) (2分)
(5)0.1 (2分)
(6)2.5×10–8 (2分)
24.(10分)
(1)过滤 (1分)
(2)抑制硫化钠水解 (1分)
(3)2.0×10−38 (2分)
(4) 坩埚; (1分)
Ag2S + O2 2Ag + SO2 (2分)
(5)3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O (2分)
(6)在空气中灼烧产生的SO2有毒,污染空气等合理答案 (1分)