- 2021-07-08 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习全国非新高考地区版第三章微考点15Na2CO3和NaHCO3的性质研究作业
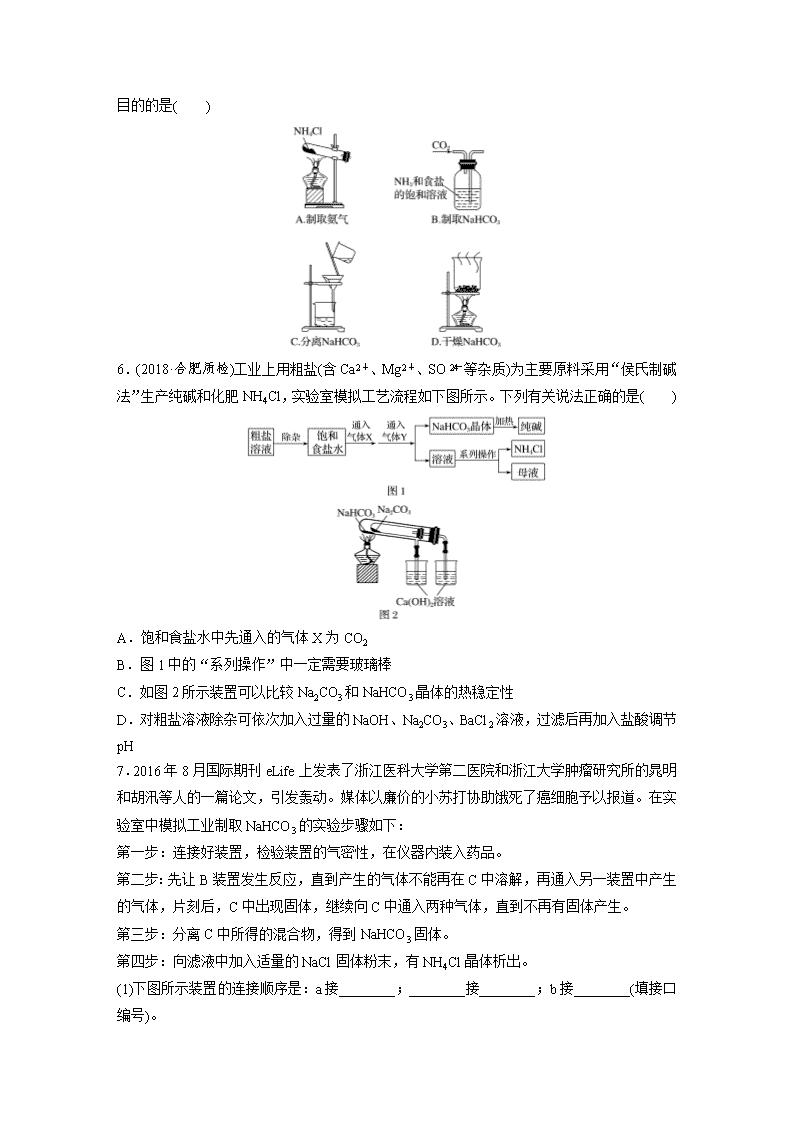
1.有关Na2CO3和NaHCO3的性质,下列叙述错误的是( ) A.相同温度下,等浓度的Na2CO3和NaHCO3溶液的碱性比较,前者更强 B.常温时水溶性:Na2CO3>NaHCO3 C.在酒精灯加热的条件下,前者不分解,后者分解 D.将澄清的石灰水分别加入Na2CO3和NaHCO3溶液中,前者产生沉淀,后者无现象 2.我国医学家通过研究发现小苏打可去除肿瘤内的氢离子,从而快速有效地杀死处于葡萄糖饥饿或缺乏状态的肿瘤细胞,为治疗原发性肝癌开辟了新路径。下列有关小苏打的说法错误的是( ) A.可用于制备苏打 B.可用于糕点生产中 C.与H+作用易产生CO2 D.可用饱和食盐水与CO2反应制得 3.工业上制备过碳酸钠(2Na2CO3·3H2O2)的一种流程如下: 下列说法不正确的是( ) A.可以用MnO2作稳定剂 B.“结晶”时,加入NaCl的主要作用是增大产品的产率 C.“分离”所用的主要玻璃仪器为烧杯、漏斗、玻璃棒 D.2Na2CO3·3H2O2受热分解属于氧化还原反应 4.(2019·上海市普陀区一模)不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的实验方案是( ) A.取a克混合物充分加热至质量不变,减重b克 B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,冷却得b克固体 C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰完全吸收,增重b克 D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 5.(2019·北京石景山期末)侯氏制碱原理:NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl,需经过制取氨气、制取NaHCO3、分离及干燥NaHCO3四个步骤,下列图示装置能达到实验 目的的是( ) 6.(2018·合肥质检)工业上用粗盐(含Ca2+、Mg2+、SO等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,实验室模拟工艺流程如下图所示。下列有关说法正确的是( ) A.饱和食盐水中先通入的气体X为CO2 B.图1中的“系列操作”中一定需要玻璃棒 C.如图2所示装置可以比较Na2CO3和NaHCO3晶体的热稳定性 D.对粗盐溶液除杂可依次加入过量的NaOH、Na2CO3、BaCl2溶液,过滤后再加入盐酸调节pH 7.2016年8月国际期刊eLife上发表了浙江医科大学第二医院和浙江大学肿瘤研究所的晁明和胡汛等人的一篇论文,引发轰动。媒体以廉价的小苏打协助饿死了癌细胞予以报道。在实验室中模拟工业制取NaHCO3的实验步骤如下: 第一步:连接好装置,检验装置的气密性,在仪器内装入药品。 第二步:先让B装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,片刻后,C中出现固体,继续向C中通入两种气体,直到不再有固体产生。 第三步:分离C中所得的混合物,得到NaHCO3固体。 第四步:向滤液中加入适量的NaCl固体粉末,有NH4Cl晶体析出。 (1)下图所示装置的连接顺序是:a接________;________接________;b接________(填接口编号)。 (2)检查A装置气密性的具体操作是________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________。 (3)A中常选用的固体反应物为__________;D中试剂为__________________。 (4)装有无水CaCl2的U形管的作用是_______________________________________。 (5)第四步所得的晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单实验,不使用其他任何试剂,证明所得晶体大部分是NH4Cl。简要写出操作和现象_____________ _______________________________________________________________________________。 8.某Na2CO3样品中混有一定量的Na2SO4(假设均不含结晶水),某实验小组设计如下方案测定样品中Na2CO3的质量分数。 (1)甲同学通过测定二氧化碳的质量来测定碳酸钠的质量分数,实验装置如图: ①主要实验步骤有:a.向装置中通入空气;b.称量干燥管B与装入碱石灰的总质量;c.打开分液漏斗活塞,使稀硫酸与样品充分反应。合理的步骤是________________________(可重复)。 ②按气体从左向右的流向,干燥管A的作用是________________________,干燥管C的作用是________________________________________________________________________ ________________________________________________________________________。 (2)乙同学利用图ⅰ、ⅱ、ⅲ三个仪器组装一套装置完成Na2CO3质量分数的测定,其中样品已称量完毕,ⅲ中装有CO2难溶于其中的液体。 ①ⅱ中盛装的是________(填字母)。 a.浓硫酸 b.饱和NaHCO3溶液 c.10 mol·L-1盐酸 d.2 mol·L-1硫酸 ②用橡胶管连接对应接口的方式是:A接________,B接________,C接________(填各接口的编号)。 ③在测量气体体积时,组合仪器与ⅳ装置相比更为准确,主要原因是____________。组合仪器相对于ⅳ装置的另一个优点是________________________。 答案精析 1.D 2.D 3.A [MnO2能够催化双氧水分解,不能作为反应的稳定剂,A错误;结晶过程中加入氯化钠、搅拌,能降低过碳酸钠的溶解度,有利于过碳酸钠析出,从而增大产品的产率,B正确;“分离”所选用的操作为过滤,过滤主要用到的玻璃仪器为烧杯、漏斗、玻璃棒,C正确;2Na2CO3·3H2O2受热分解生成碳酸钠、水和氧气,有元素的化合价发生变化,属于氧化还原反应,D正确。] 4.C [C项反应中逸出的气体中除含CO2外,还混有水蒸气,故导致数据不准确。] 5.C [A项,氯化铵不稳定,加热易分解生成氨气和HCl,温度稍低时二者又可化合生成氯化铵;B项,气体进出口错误;C项,从溶液中分离固体,可用过滤的方法;D项,碳酸氢钠不稳定,受热易分解,不能直接加热干燥。] 6.B [A项,饱和食盐水中应先通入NH3,以增大CO2的溶解度,错误;B项,“系列操作”为蒸发、浓缩、冷却结晶、过滤,故要用到玻璃棒,正确;C项,比较Na2CO3和NaHCO3晶体的热稳定性,NaHCO3应放到内管中,Na2CO3应放到外管中,错误;D项,粗盐溶液除杂,BaCl2溶液应放在Na2CO3溶液之前,以除去引入的BaCl2杂质,错误。] 7.(1)f e d c (2)关闭弹簧夹,通过长颈漏斗往试管中加水,使长颈漏斗中的水面高于试管中的水面,静置片刻,漏斗内水面不下降,说明A装置气密性良好 (3)石灰石(或大理石或块状CaCO3) 饱和NaHCO3溶液 (4)吸收多余的NH3 (5)取少量固体放入试管中,加热,固体大部分消失,在试管口内壁又有较多的固体凝结 解析 (1)向饱和氯化钠溶液中先通入足量的氨气,再通入足量的二氧化碳,反应生成NaHCO3固体,则在A装置中制取CO2,在B装置中制取NH3,用D装置除去CO2中的HCl,CO2与NH3通入装置C中,其中NH3应防止倒吸,故a接f,e接d,b接c。 (2)利用液差法检验A装置的气密性,实验操作:关闭弹簧夹,通过长颈漏斗往试管中加水,使长颈漏斗中的水面高于试管中的水面,静置片刻,漏斗内水面不下降,说明A装置气密性良好。 (3)A为启普发生器的简易装置,适合块状固体和液体反应制备气体,A中制备CO2气体,常选用的固体反应物为石灰石。制得的CO2中含有HCl杂质,D装置的作用是净化CO2,选择饱和NaHCO3溶液。 (4)装有无水CaCl2的U形管的作用是吸收多余的NH3。 8.(1)①abcab ②除去空气中的二氧化碳 防止空气中的水分和二氧化碳被干燥管B吸收 (2)①d ②D E F ③ⅳ将滴下的酸的体积也计入气体体积,而组合仪器没有 液体可以顺利滴下查看更多