2019届二轮复习元素周期律元素周期表学案
元素周期律 元素周期表
[考纲导航]
知识条目
加试要求
核心素养
(1)元素周期律(核外电子排布、原子半径、元素主要化合价、元素的金属性和非金属性的周期性变化)
b
1.宏观辨识与微观探析:能从不同层次认识物质的多样性;能从元素和原子、分子水平认识物质的组成、结构、性质和变化,形成“结构决定性质”的观念。能从宏观和微观相结合的视角分析与解决实际问题。
2.证据推理与模型认知:具有证据意识,能基于实验现象和事实对物质的组成、结构及其变化分析得出元素周期律;能基于元素周期律理解元素周期表的编排方法,能运用元素周期表揭示元素周期律。
3.科学探究与创新意识:在探究同周期、同主族元素性质递变性的实验中,要明确探究目的,设计探究方案,并在探究中学会合作,面对“异常”现象敢于提出自己的见解。
(2)元素周期表的结构、同主族、同周期元素原子核外电子排布、元素化学性质的递变规律
b
(3)主族元素在周期表中位置、原子结构、元素性质三者关系
c
(4)元素周期表的发展史、意义、作用
b
考点1 元素周期表的结构和应用
[主干精讲]
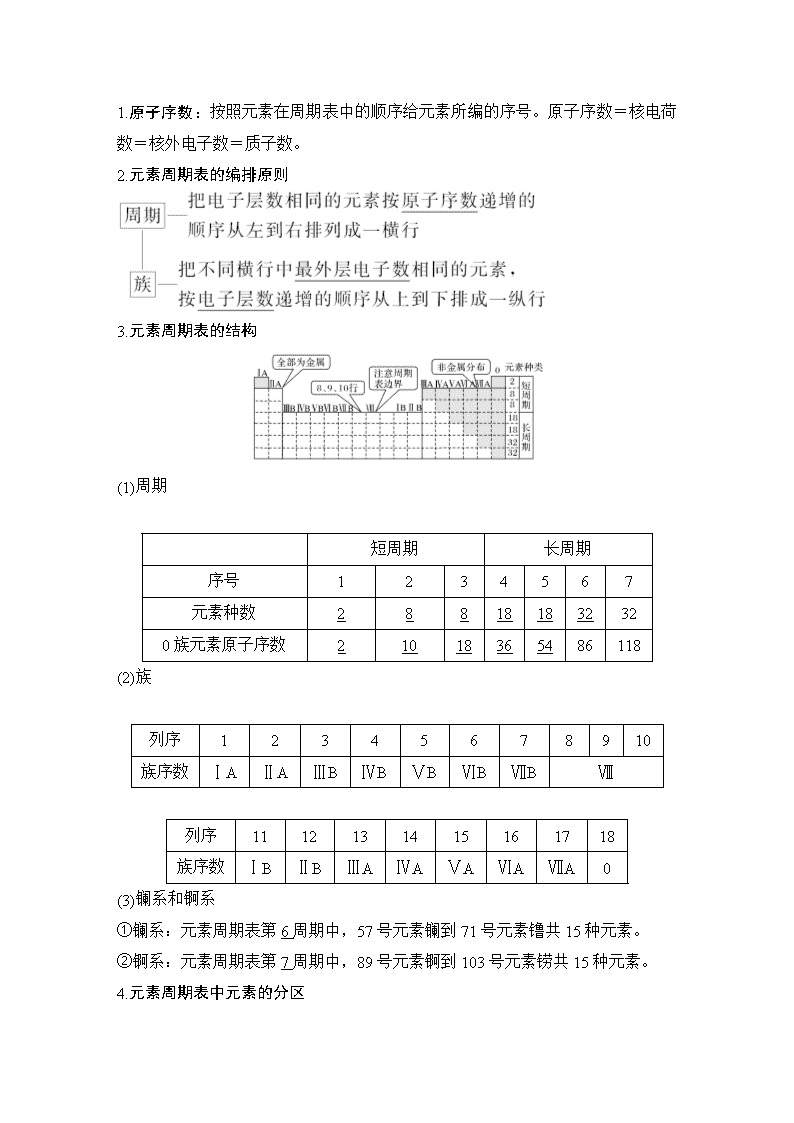
1.原子序数:按照元素在周期表中的顺序给元素所编的序号。原子序数=核电荷数=核外电子数=质子数。
2.元素周期表的编排原则
3.元素周期表的结构
(1)周期
短周期
长周期
序号
1
2
3
4
5
6
7
元素种数
2
8
8
18
18
32
32
0族元素原子序数
2
10
18
36
54
86
118
(2)族
列序
1
2
3
4
5
6
7
8
9
10
族序数
ⅠA
ⅡA
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
Ⅷ
列序
11
12
13
14
15
16
17
18
族序数
ⅠB
ⅡB
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
(3)镧系和锕系
①镧系:元素周期表第6周期中,57号元素镧到71号元素镥共15种元素。
②锕系:元素周期表第7周期中,89号元素锕到103号元素铹共15种元素。
4.元素周期表中元素的分区
①ⅠA族元素不等同于碱金属元素,H元素不属于碱金属元素;
②元素周期表第18列是0族,不是ⅧA族,第8、9、10三列是Ⅷ族,不是ⅧB族。
5.元素周期表的应用
(1)科学预测:元素周期表为新元素的发现及预测它们原子结构和性质提供线索。
(2)寻找新材料
①在金属和非金属交界处附近寻找半导体材料;
②在过渡元素中寻找优良的催化剂和耐高温、耐腐蚀的合金材料。
[速检速测]
1.[明辨是非]正确的打“√”,错误的打“×”
(1)元素周期表中位于金属与非金属分界线附近的元素属于过渡元素( )
(2)两短周期元素原子序数相差8,则周期数一定相差1( )
(3)某元素原子的核电荷数为53,则该元素位于第5周期ⅦA族( )
(4)元素周期表中镧系元素和锕系元素都占据同一格,它们是同位素( )
(5)元素周期表中ⅠA族是包含元素种类最多的纵行( )
(6)元素所在的主族序数与最外层电子数相等的元素都是金属元素( )
(7)短周期元素中,若两种元素的原子序数相差8,则它们一定是同主族元素( )
(8)短周期元素中,若两种元素的原子序数相差2,则它们一定不是同主族元素( )
(9)位于同一周期的甲、乙两种元素,甲位于ⅠA族,原子序数为x,乙位于ⅢA族,则乙原子序数可能为x+19( )
答案 (1)× (2)√ (3)√ (4)× (5)× (6)× (7)× (8)× (9)×
2.在元素周期表中,铂元素如图所示,下列有关说法正确的是( )
A.铂是非金属元素,在常温下呈固态
B.Pt和Pt的核外电子数相同,互为同位素
C.“195.1”是铂的质量数
D.由78可以推出Pt为第5周期元素
解析 铂为金属元素,A项错误;Pt和Pt的质子数相同,中子数不同,是两种不同核素,二者互为同位素,B项正确;195.1是铂元素的相对原子质量,C项错误;由质子数78推出Pt为第6周期元素,D项错误。
答案 B
3.用所学知识填写下列空白。
(1)35号元素位于第________周期第________族。
(2)55号元素位于第________周期第________族。
(3)84号元素位于第________周期第________族。
(4)电子层数与最外层电子数相等的短周期元素:________。
(5)最高正价是最低负价绝对值3倍的短周期元素是________。
(6)次外层电子数是最外层电子数2倍的元素:________。
(7)最外层电子数是电子层数2倍的元素:________。
答案 (1)4 ⅦA (2)6 ⅠA (3)6 ⅥA (4)H、Be、Al (5)S (6)Li、Si (7)He、C、S、Kr
[模拟题组]
元素周期表的结构应用
1.(2019·杭州四校期中联考)下列叙述错误的是( )
A.元素周期表共7个周期,第1、2、3周期为短周期,第4、5、6、7周期为长周期,第7周期又称为不完全周期
B.元素周期表是元素周期律的具体表现形式
C.第4、5、6、7周期含有的元素种类分别为18、18、32、26种
D.第8、9、10三个纵行为第ⅦB族
解析 本题考查元素周期表。A项,由于第7周期暂时没有排满,又称不完全周期,正确;B项,元素周期表是元素周期律的具体表现形式,正确;C项,目前第7周期仅排了26种元素,而第4、5、6周期分别排了18种、18种和32种元素,正确;D项,第8、9、10三个纵行为第Ⅷ族,错误。
答案 D
2.正误判断,正确的打“√”,错误的打“×”
(1)原子的最外层有2个电子的元素一定是第ⅡA族元素( )
(2)原子及离子的核外电子层数等于该元素所在的周期数( )
(3)最外层电子数等于或大于3(小于8)的元素一定是主族元素( )
(4)原子的最外层有1个或2个电子,则可能是ⅠA、ⅡA族元素,也可能是副族、Ⅷ族元素或0族元素氦( )
(5)最外层电子数比次外层电子数多的元素一定位于第二周期( )
(6)某元素阴离子最外层电子数与次外层相同,该元素位于第三周期;若为阳离子,则位于第四周期( )
答案 (1)× (2)× (3)√ (4)√ (5)√ (6)√
【归纳总结】
根据稀有气体元素的原子序数推断元素位置
第1~7周期稀有气体元素的原子序数依次为2、10、18、36、54、86、118(第7周期若排满),可利用元素的原子序数与最相近稀有气体元素原子序数的差值来推断元素在周期表中的位置,遵循“比大小,定周期;比差值,定族数”的原则。如53号元素,由于36<53<54,则53号元素位于第5周期,54-53=1,所以53号元素位于54号元素左侧第一格,即ⅦA族,得53号元素在元素周期表中的位置是第5周期ⅦA族。
元素周期表的综合应用
3.(2018·沧州模拟)A、B、C均为短周期元素,它们在周期表中的位置如图所示,已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C符合的一组是( )
A.Be、Na、Al B.B、Mg、Si
C.O、P、Cl D.C、Al、P
解析 由于A、B、C为短周期元素,从A、B、C的相对位置可知,A只能处在第二周期,而B、C处在第三周期。设A的原子序数为x,则B的原子序数为:(x+8-1)=x+7,C的原子序数为:(x+8+1)=x+9,则(x+7)+(x+9)=4x,x=8。所以,A、B、C的原子序数分别为8、15、17,对应的元素分别为O、P、Cl。故选C。
答案 C
4.(2017·浙江省台州中学高三上学期第四次统练)X、Y、Z、M、W为5种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的位置如图所示。下列说法不正确的是( )
Y
Z
M
W
A.原子半径:W>Y>Z>M>X
B.热稳定性:XM>X2Z,沸点:X2Z>YX3
C.X、Y、Z三种元素形成的化合物中不可能含离子键
D.YM3、WM4分子中每个原子最外层均满足8电子结构
解析 X原子的质子数与电子层数相同,则X为H;W原子核外电子数是M原子最外层电子数的2倍,W为Si,Y为N,Z为O,M为F。A.电子层数越多,原子半径越大,同周期元素,从左到右,原子半径逐渐减小,则原子半径:Si>N>O>F>H,A项正确;B.非金属性:F>O,热稳定性:HF>H2O,常温常压下,水是液体,而NH3是气体,沸点:H2O>NH3,B项正确;C.H、N、O可形成NH4NO3离子型化合物,含有离子键,C项错误;D.NF3、SiF4分子中每个原子均满足8电子结构,D项正确。
答案 C
[真题对接]
1.(2018·江苏化学,8)
短周期主族元素X、Y、Z、W原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层只有一个电子,Z位于元素周期表ⅢA族,W与X属于同一主族。下列说法正确的是( )
A.原子半径:r(W)>r(Z)>r(Y)
B.由X、Y组成的化合物中均不含共价键
C.Y的最高价氧化物的水化物的碱性比Z的弱
D.X的简单气态氢化物的热稳定性比W的强
解析 地壳中含量最多的元素X为O元素;短周期元素Y的原子序数大于X,且Y原子的最外层只有一个电子,则Y为Na元素;Z的原子序数大于Na且为第ⅢA族短周期元素,则Z为Al元素;W与X属于同一主族,且为短周期元素,则W为S元素。原子半径:Na>Al>S,A项错误;Na2O2中两个氧原子之间为共价键,B项错误;Y和Z的最高价氧化物的水化物分别为NaOH、Al(OH)3,碱性:NaOH>Al(OH)3,C项错误;O的非金属性强于S,则气态氢化物的热稳定性:H2O强于H2S,D项正确。
答案 D
2.(2017·课标全国Ⅰ,12)短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是( )
A.X的简单氢化物的热稳定性比W强
B.Y的简单离子与X的具有相同的电子层结构
C.Y与Z形成化合物的水溶液可使蓝色石蕊试纸变红
D.Z与X属于同一主族,与Y属于同一周期
解析 W为氮元素,Y为钠元素,X、Y、Z形成的盐,加入盐酸生成黄色沉淀及刺激性气体,结合四种元素均是短周期元素,说明是Na2S2O3与盐酸反应生成S和SO2:Na2S2O3+2HCl===2NaCl+S↓+ SO2↑+H2O,X为氧元素,Z为硫元素。A项,O的非金属性强于N,稳定性:H2O>NH3,正确;B项,O2-、Na+均具有Ne的电子层结构,B正确;C项,Na2S溶液因S2-水解呈碱性,蓝色石蕊试纸不变色,错误;D项,S和O同属于第ⅥA族,S与Na同属于第3周期,正确。
答案 C
考点2 元素周期律
[主干精讲]
1.元素周期律
2.元素周期表中主族元素性质的递变规律
项目
同周期(左→右)
同主族(上→下)
原子结构
核电荷数
逐渐增大
逐渐增大
电子层数
相等
逐渐增加
原子半径
逐渐减小
逐渐增大
离子半径
阳离子逐渐减小
阴离子逐渐减小
r(阴离子)大于r(阳离子)
逐渐增大
性质
化合价
最高正化合价由+1→+7(O、F除外)
负化合价=-(8-最外层电子数)
最高正化合价=主族序数(O、F除外)
元素的金属性和非金属性
金属性逐渐减弱
非金属性逐渐增强
金属性逐渐增强
非金属性逐渐减弱
离子的氧化性、还原性
阳离子氧化性逐渐增强
阴离子还原性逐渐减弱
阳离子氧化性逐渐减弱
阴离子还原性逐渐增强
气态氢化物稳定性
逐渐增强
逐渐减弱
最高价氧化物对应的水化物的酸碱性
碱性逐渐减弱
酸性逐渐增强
碱性逐渐增强
酸性逐渐减弱
3.元素金属性强弱和元素非金属性强弱比较依据
(1)结构比较依据
①最外层电子数越少,电子层数越多,元素的金属性越强。
②最外层电子数越多,电子层数越少,元素非金属性越强。
(2)位置比较依据
(3)实验比较依据
金属性是指金属气态原子失电子能力的性质,金属活动性是指单质在水溶液中,金属原子失去电子能力的性质,二者顺序基本一致,仅极少数例外。如金属性Pb>Sn,而金属活动性Sn>Pb。
[速检速测]
1.[明辨是非]正确的打“√”,错误的打“×”
(1)同周期主族元素中,第ⅦA族元素的原子半径最小( )
(2)第ⅦA族元素自上而下,原子半径逐渐减小( )
(3)同周期主族元素形成的简单离子中第ⅠA族元素的离子半径最小( )
(4)离子半径由大到小的顺序:r(S2-)>r(Cl-)>r(Al3+)>r(Mg2+)>r(Na+)( )
(5)第ⅤA族元素的最高正价与族序数相同( )
(6)第二周期元素从左到右,最高正价从+1递增至+7( )
(7)同周期金属元素的化合价越高,其原子失去电子能力越强( )
(8)金属性由强到弱顺序:Li>Na>K( )
(9)非金属性由强到弱顺序:F>Cl>Br>I( )
(10)I的原子半径大于Br,HI的热稳定性比HBr强( )
(11)P的非金属性强于Si,H3PO4的酸性比H2SiO3强( )
(12)同主族元素含氧酸的酸性随核电荷数的增加而减弱( )
答案 (1)√ (2)× (3)× (4)× (5)√ (6)× (7)× (8)× (9)√ (10)× (11)√ (12)×
2.(2017·浙江省温州中学高三3月高考模拟)下列各组性质比较中,正确的是( )
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2 ③非金属性:F>C>O ④氧化性:Li+
HCl
A.①②③ B.①②⑤
C.②③④ D.①②④⑤
解析 ①都是最高价含氧酸,非金属性越强,其酸性越强,非金属性:Cl>Br>I,因此酸性:HClO4>HBrO4>HIO4,故正确;②碱性:金属性越强,其最高价氧化物对应水化物的碱性越强,金属性:Ba>Mg>Be,碱性:Ba(OH)2>Mg(OH)2>Be(OH)2,故正确;③同周期从左向右,非金属性逐渐增强(稀有气体除外),F>O>C,故不正确;④依据金属性越强,其阳离子的氧化性越弱,金属性强弱:K>Na>Li,氧化性:Li+>Na+>K+,故错误;⑤HF分子之间形成分子间氢键,存在分子间氢键的物质沸点高,而HCl分子间只有范德华力,故正确,综上所述B选项正确。
答案 B
[模拟题组]
微粒半径比较
1.已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则下列叙述中正确的是( )
A.原子序数:D>C>B>A
B.原子半径:B>A>C>D
C.离子半径:C3->D->A2+>B+
D.氧化性:A2+>B+,还原性:C3-<D-
解析 A2+、B+、C3-、D-都具有相同电子层结构,则A、B在下一周期,为金属元素,且原子序数A>B,C、D在上一周期,为非金属元素,且原子序数D>C,A.由电子层数越多的原子序数越大,同周期从左向右原子序数依次增大,所以原子序数为A>B>D>C,故A错误;B.电子层越多,原子半径越大,同周期原子序数越大,半径越小,则原子半径为B>A>C>D,故B正确;C.具有相同电子排布的离子,原子序数大的离子半径小,原子序数为A>B>D>C,则离子半径为C3->D->B+>A2+,故C错误;D.金属性越强,其阳离子的氧化性越弱,非金属性越强,其阴离子的还原性越弱,金属性为B>A,则氧化性:A2+>B+,非金属性:C<D,则还原性:C3->D-,故D错误;故选B。
答案 B
2.比较下列微粒半径大小,用“>”或“<”填空。
(1)Na________Na+ (2)O________O2-
(3)O2-________S2- (4)Fe2+________Fe3+
(5)Na________Mg________Al
(6)Na+________Mg2+________Al3+
(7)O2-________Na+
答案 (1)> (2)< (3)< (4)> (5)> >
(6)> > (7)>
【规律方法】
微粒半径的大小比较
元素金属性、非金属性强弱比较
3.下列事实不能说明元素的金属性或非金属性相对强弱的是( )
序号
事实
推论
A
与冷水反应,Na比Mg剧烈
金属性:Na>Mg
B
Ca(OH)2的碱性强于Mg(OH)2
金属性:Ca>Mg
C
SO2与NaHCO3溶液反应生成CO2
非金属性:S>C
D
t ℃时,Br2+H22HBr
K=5.6×107
I2+H22HI K=43
非金属性:Br>I
解析 金属元素金属性越强,其单质化学性质越活泼,其最高价氧化物对应的水化物的碱性越强,A、B正确;非金属性越强,其单质越易与H2发生化合反应,D正确;C中SO2并不是S元素的最高价氧化物,无法以此为依据判断S、C元素的非金属性强弱,错误。
答案 C
4.(1)下列事实能说明氯元素原子得电子能力比硫元素原子强的是________。
①HCl的溶解度比H2S大 ②HCl的酸性比H2S强 ③HCl的稳定性比H2S大 ④HCl的还原性比H2S弱 ⑤HClO4的酸性比H2SO4强 ⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS ⑦Cl2能与H2S反应生成S ⑧在周期表中Cl处于S同周期的右侧 ⑨还原性:Cl-<S2-
(2)有三种金属元素A、B、C,在相同条件下,B的最高价氧化物的水化物的碱性比A的最高价氧化物的水化物的碱性强;若将A、C相连后投入稀硫酸中,发现C表面有明显气泡产生。则这三种金属元素的原子失电子能力由强到弱的顺序是________。
解析 (1)元素原子得电子能力的强弱与元素氢化物的溶解性无关,所以①不符合题意;氢化物的酸性强弱和元素原子得电子能力大小没有固定的对应关系,所以②也不符合题意,其他均符合题意。(2)由金属B的最高价氧化物的水化物的碱性比A的最高价氧化物的水化物的碱性强,可判断失电子能力B>A;又根据A与C形成原电池,C作正极,可判断失电子能力A>C,故三种金属元素的原子失电子能力B>A>C。
答案 (1)③④⑤⑥⑦⑧⑨ (2)B>A>C
元素周期律的综合应用
5.下列有关性质的比较,不能用元素周期律解释的是( )
A.密度:Na>K
B.0.1 mol·L-1溶液的pH:NaOH>LiOH
C.还原性:I->Br-
D.Mg、Al与同浓度盐酸反应,Mg更剧烈
解析 密度为物理性质,与元素周期律无关,A项选;同主族元素从上到下,金属性逐渐增强,最高价氧化物对应水化物的碱性逐渐增强,碱性:NaOH>LiOH,则同浓度的两种溶液,NaOH的pH大,能用元素周期律解释,B项不选;溴的非金属性强于碘,所以碘离子的还原性强于溴离子,可用元素周期律解释,C项不选;同周期元素从左到右,金属性逐渐减弱,金属单质的还原性逐渐减弱,因此Mg、Al与同浓度盐酸反应,Mg更剧烈,可用元素周期律解释,D项不选。
答案 A
6.(2018·宁波市效实中学期中)有A、B两种短周期元素,原子半径是:r(A)c>b>a
B.4种元素中b的金属性最强
C.c的氧化物的水化物是强碱
D.d单质的氧化性比a单质的氧化性强
解析 a、b、c、d分别为O、Na或Mg、Al、S。A项,原子半径b>c>d>a,错误;B正确;C项,c的氧化物的水化物为氢氧化铝,为两性氢氧化物,不是强碱,错误;D项,单质S的氧化性比氧气氧化性弱,错误。
答案 B
课时训练
一、选择题
1.(2019·温州教学质检)位于元素周期表中第3周期ⅥA族的元素是( )
A.C B.O
C.Si D.S
答案 D
2.根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )
事实
推测
A
12Mg与水反应缓慢,20Ca与水反应较快
56Ba(ⅡA族)与水反应会更快
B
Si是半导体材料,同族的Ge也是半导体材料
ⅣA族的元素都是半导体材料
C
HCl在1500 ℃时分解,HI在230 ℃时分解
HBr的分解温度介于二者之间
D
Si与H2在高温时反应,S与H2在加热时能反应
P与H2在高温时能反应
解析 同主族金属元素由上至下金属性逐渐增强,与水反应剧烈程度逐渐增强,A项正确;半导体材料通常位于元素周期表中金属元素和非金属元素的分界处,第ⅣA族元素并不都是半导体材料,B项错误;同主族非金属元素由上至下非金属性逐渐减弱,气态氢化物的热稳定性逐渐减弱,C项正确;同周期非金属元素从左到右非金属性逐渐增强,与氢气化合难度逐渐减小,D项正确。
答案 B
3.如图所示,元素周期表中的金属和非金属元素的分界线用虚线表示。下列说法正确的是( )
A.虚线右上方的元素为金属元素
B.第6周期ⅤA族的元素为非金属元素
C.可在虚线附近寻找用于制造半导体材料的元素
D.可在虚线附近寻找稀土元素
解析 虚线右上方的元素为非金属元素,A错;第6周期ⅤA族的元素是铋,为金属元素,B错;可在虚线附近寻找用于制造半导体材料的元素,C对,D错。
答案 C
4.下列叙述能说明金属A比金属B更活泼的是( )
A.A原子的最外层电子数比B原子的最外层电子数少
B.A原子电子层数比B原子的电子层数多
C.1 mol A从酸中置换生成的H2比1 mol B从酸中置换生成的H2多
D.常温下,A能从水中置换出氢,而B不能
解析 金属A比金属B活泼的依据是A比B更易失去电子,而失电子的能力并不取决于最外层电子数的多少、电子层数的多少、以及与酸反应置换出H2
的多少,而是取决于其与酸(或H2O)反应置换出氢的难易程度。
答案 D
5.X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )
A.原子最外层电子数:X>Y>Z
B.单质沸点:X>Y>Z
C.离子半径:X2->Y+>Z-
D.原子序数:X>Y>Z
解析 根据题中信息可确定X、Y、Z分别为S、Na和F。原子最外层电子数:F>S>Na,A项错误;单质沸点:Na>S>F2,B项错误;离子半径:S2->F->Na+,C项错误;原子序数:S>Na>F,D项正确。
答案 D
6.某元素的原子结构示意图为,则该元素在元素周期表中的位置( )
A.第2周期ⅠA族 B.第2周期ⅤA族
C.第3周期ⅣA族 D.第3周期ⅤA族
答案 D
7.(2017·绍兴市高三3月教学质量调测)几种短周期元素的原子半径及某些化合价见下表,下列说法不正确的是( )
元素代号
A
B
D
E
G
I
J
K
化合价
-1
-2
+4
-4
-1
+5
-3
+3
+2
+1
原子半
径/nm
0.071
0.074
0.077
0.099
0.110
0.143
0.160
0.186
A.常温下B元素的单质能与K单质反应
B.A、I、J的离子半径由大到小顺序是A>J>I
C.G元素的单质存在同素异形体
D.J在DB2中燃烧生成B元素的单质
解析 短周期元素,A、E有-1价,B有-2价,且A的原子半径与B相差不大,则A、E处于第ⅦA族,B处于第ⅥA族,A原子半径小于E,可推知A为F、E为Cl,B为O;D有-4、+4价,处于第ⅣA族,原子半径与O原子相差不大,可推知D为C元素;G元素有-3、+5价,处于第ⅤA族,原子半径大于C原子,应处于第3周期,则G为P元素;I、J、K的化合价分别为+3、+2、+1,分别处于第ⅢA族、第ⅡA族、第ⅠA族,原子半径依次增大,且都大于P原子半径,应处于第3周期,可推知Ⅰ为Al、J为Mg、K为Na;Na与O2常温下可生成Na2O,故A正确;F-、Mg2+、Al3+核外电子排布相同,核电荷数越大离子半径越小,故离子半径大小顺序为F->Mg2+>Al3+,故B正确;磷的单质有红磷和白磷等,存在同素异形体,故C正确;镁在二氧化碳中燃烧生成MgO和碳单质,故D错误;故选D。
答案 D
8.(2019·浙江省选考仿真预测卷)已知33As、35Br位于同一周期。下列关系中正确的是( )
A.原子半径:As>Cl>P
B.热稳定性:HCl>AsH3>HBr
C.还原性:As3->S2->Cl-
D.酸性:H3AsO4>H2SO4>H3PO4
解析 同周期元素(稀有气体元素除外),从左向右原子半径依次减小,Cl的原子半径小于P的原子半径,A错误;同周期元素,从左向右非金属性依次增强,气态氢化物的稳定性依次增强,AsH3的稳定性小于HBr,B错误;As、S、Cl的非金属性逐渐增强,所以As3-、S2-、Cl-的还原性逐渐减弱,C正确;同主族元素,自上而下,非金属性依次减弱,最高价氧化物对应的水化物的酸性依次减弱,H3AsO4的酸性弱于H3PO4,D错误。
答案 C
9.短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21。下列说法不正确的是( )
W
X
Y
Z
A.原子半径大小:X>Y>Z
B.W、Y两种元素都能与氧元素形成化合物WO2、YO2
C.最高价氧化物对应水化物的酸性:W>Y>Z
D.W元素的单质能从X的氧化物中置换出X单质
解析 设W的最外层电子数为a个,则W与X同主族,其最外层电子数相同,Y的最外层电子数为a+2,Z的最外层电子为a+3,则有a+a+a+2+a+3=21,a=4,故W为C,X为Si,Y为S,Z为Cl。A项:同周期从左至右,原子半径依次减小(稀有气体除外),正确;B项:W、Y两种元素都能与氧元素形成化合物CO2、SO2,正确;C项:最高价氧化物对应水化物的酸性:W(H2CO3)r(C)>r(B)
C.1.0 L 0.1 mol/L戊溶液中含阴离子总的物质的量小于0.1 mol
D.1 mol甲与足量的乙完全反应共转移约1.204×1024个电子
解析 依题意可以判断A为氢元素,B为碳元素,C为氧元素,D为钠元素。甲为过氧化钠,乙为水,丙为二氧化碳,丁为氢氧化钠,戊为碳酸钠,辛为氧气,因此选A。
答案 A
11.(2018·浙江东阳中学期中)下列叙述中正确的是( )
A.进行H2O和H2S的热分解实验,可确定S、O两种元素的非金属性强弱
B.根据非金属性强弱F>Cl,可以推测沸点HF>HCl
C.已知2C+SiO2Si+2CO↑,说明C的非金属性比Si强
D.H2SO3的酸性比H2CO3的酸性强,说明S的非金属性比C强
解析 A项,非金属性越强,氢化物的稳定性越强,则进行H2O和H2S的热分解实验,可确定S、O两种元素的非金属性强弱,A正确;B项,非金属性强弱与氢化物的沸点没有关系,氟化氢分子间存在氢键,沸点高于氯化氢,B错误;C项,已知2C+SiO2Si+2CO↑,不能说明C的非金属性比Si强,因为该反应是难挥发性物质制备易挥发性物质,C错误;D项,H2SO3的酸性比H2CO3的酸性强,但亚硫酸不是最高价含氧酸,则不能说明S的非金属性比C强,D错误。
答案 A
二、非选择题
12.X、Y、Z、L、M、N六种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是短周期原子半径最大的元素,N是地壳中含量最高的金属元素。回答下列问题:
(1)M在元素周期表中的位置为________;六种元素的原子半径从大到小的顺序是________。
(2)X、L两元素按原子数目比1∶1构成分子B,B的电子式为________________。
(3)硒(Se)是人体必需的微量元素,已知非金属性:Se<L。请结合原子结构解释原因__________________________________________________________________
___________________________________________________________________。
(4)用石墨作电极,NCl3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出电解熔融Q制取N的电极反应式。
阳极:_____________________________________________________________;
阴极:_____________________________________________________________。
解析 由“组成蛋白质的基础元素”可知X、Y、Z、L分别为H、C、N、O,M是Na、N为Al。
(1)依据元素周期律即可判断六种元素半径的大小、顺序。
(2)由上述推断可知B为H2O2。
(3)从同族元素原子半径的角度比较两者非金属性的强弱。
(4)电解AlCl3溶液,阴极H+得电子,溶液中OH-浓度增大,阳极Cl-失电子生成Cl2,Al3+与阴极生成的OH-结合生成Al(OH)3沉淀,所以Q为Al2O3。
答案 (1)第三周期第ⅠA族
Na>Al>C>N>O>H
(2)
(3)O和Se同主族,从上到下,原子半径依次增大,得电子能力减弱,所以非金属性减弱
(4)2O2--4e-===O2↑ Al3++3e-===Al
13.利用如图装置可验证同主族元素非金属性的变化规律。
(1)仪器D的名称为________。
(2)已知:KMnO4与浓盐酸常温下反应生成氯气。若要证明非金属性:Cl>I,则A中加浓盐酸、B中加KMnO4、C中加淀粉碘化钾混合溶液,观察到C中溶液________的现象即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,应将尾气通入________溶液。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液进行实验。但有的同学认为由于盐酸具有挥发性对实验造成干扰,需要改进实验方法:先将产生的气体通入________溶液除去HCl,再通入Na2SiO3溶液,观察装置C中出现________现象即可证明,C中发生的化学反应能够证明非金属性强弱(C>Si)的理论依据是___________________________________________
_________________________________________________________________。
答案 (1)干燥管
(2)变蓝 NaOH
(3)饱和NaHCO3 白色浑浊 最高价氧化物对应水化物的酸性越强,其元素的非金属性越强
14.[2019·义乌市群星外国语高三(上)期中]如图是由短周期元素组成的一些单质及其化合物之间的转化关系图,各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。
(1)物质C的化学式:______________________________________________。
(2)物质A的电子式:______________________________________________。
(3)写出G→E的化学方程式:_______________________________________。
解析 (1)由以上分析可知C为NH3;(2)A为CO2,为共价化合物,电子式为;(3)Cu与稀硝酸反应生成硝酸铜、NO和水,反应的化学方程式为3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O。
答案 (1)NH3 (2)
(3)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O