- 2021-07-08 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习化学反应与能量变化作业(全国通用)
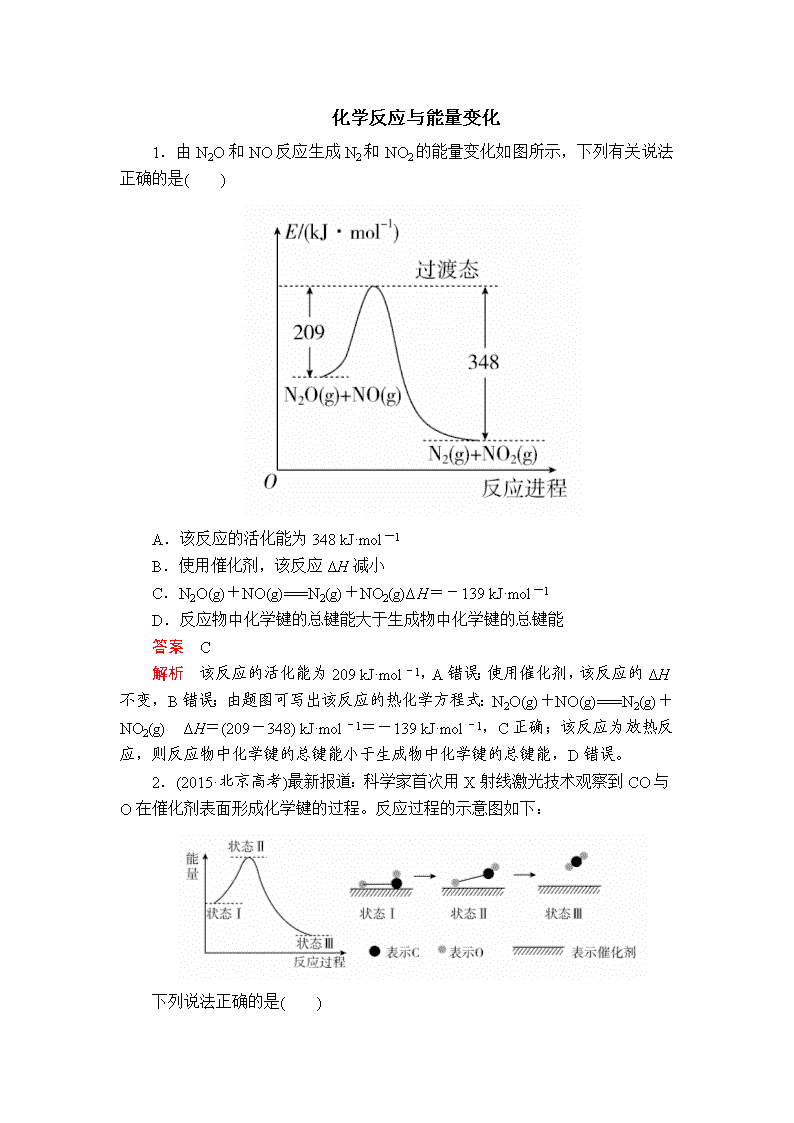
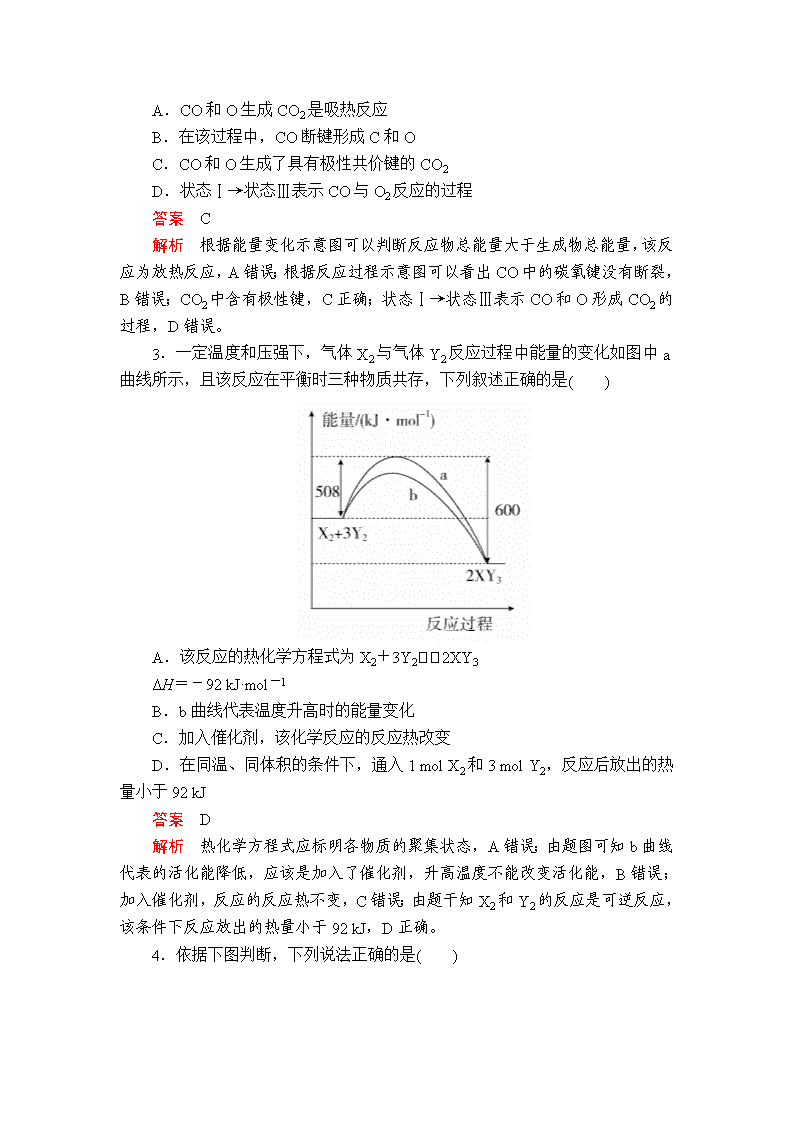
化学反应与能量变化 1.由N2O和NO反应生成N2和NO2的能量变化如图所示,下列有关说法正确的是( ) A.该反应的活化能为348 kJ·mol-1 B.使用催化剂,该反应ΔH减小 C.N2O(g)+NO(g)===N2(g)+NO2(g)ΔH=-139 kJ·mol-1 D.反应物中化学键的总键能大于生成物中化学键的总键能 答案 C 解析 该反应的活化能为209 kJ·mol-1,A错误;使用催化剂,该反应的ΔH不变,B错误;由题图可写出该反应的热化学方程式:N2O(g)+NO(g)===N2(g)+NO2(g) ΔH=(209-348) kJ·mol-1=-139 kJ·mol-1,C正确;该反应为放热反应,则反应物中化学键的总键能小于生成物中化学键的总键能,D错误。 2.(2015·北京高考)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下: 下列说法正确的是( ) A.CO和O生成CO2是吸热反应 B.在该过程中,CO断键形成C和O C.CO和O生成了具有极性共价键的CO2 D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 答案 C 解析 根据能量变化示意图可以判断反应物总能量大于生成物总能量,该反应为放热反应,A错误;根据反应过程示意图可以看出CO中的碳氧键没有断裂,B错误;CO2中含有极性键,C正确;状态Ⅰ→状态Ⅲ表示CO和O形成CO2的过程,D错误。 3.一定温度和压强下,气体X2与气体Y2反应过程中能量的变化如图中a曲线所示,且该反应在平衡时三种物质共存,下列叙述正确的是( ) A.该反应的热化学方程式为X2+3Y22XY3 ΔH=-92 kJ·mol-1 B.b曲线代表温度升高时的能量变化 C.加入催化剂,该化学反应的反应热改变 D.在同温、同体积的条件下,通入1 mol X2和3 mol Y2,反应后放出的热量小于92 kJ 答案 D 解析 热化学方程式应标明各物质的聚集状态,A错误;由题图可知b曲线代表的活化能降低,应该是加入了催化剂,升高温度不能改变活化能,B错误;加入催化剂,反应的反应热不变,C错误;由题干知X2和Y2的反应是可逆反应,该条件下反应放出的热量小于92 kJ,D正确。 4.依据下图判断,下列说法正确的是( ) A.2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低 B.氢气的燃烧热为ΔH=-241.8 kJ·mol-1 C.液态水分解的热化学方程式为2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1 D.H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 答案 C 解析 2 mol H2(g)与1 mol O2(g)反应生成2 mol H2O(g),放出483.6 kJ的热量,故2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量高,A错误;氢气的燃烧热是指1 mol氢气完全燃烧生成液态水放出的热量,故氢气的燃烧热为 kJ·mol-1=285.8 kJ·mol-1,B错误;水分解的热化学方程式为2H2O(l)===2H2(g)+O2(g) ΔH=+(483.6+88) kJ·mol-1=+571.6 kJ·mol-1,C正确;H2O(g)生成H2O(l)为物理变化,不存在化学键的断裂与形成,D错误。 5.已知:①C(s)+O2(g)===CO2(g)ΔH1=-394 kJ·mol-1 ②H2(g)+O2(g)===H2O(g)ΔH2=-242 kJ·mol-1 ③2C2H2(g)+5O2(g)===4CO2(g)+2H2O(g) ΔH3=-2510 kJ·mol-1 ④2C(s)+H2(g)===C2H2(g) ΔH4 下列说法正确的是( ) A.反应①若放出197 kJ的热量,转移4 mol电子 B.由反应②可知1 mol液态水分解所放出的热量为242 kJ C.反应③表示C2H2燃烧热的热化学方程式 D.ΔH4=2ΔH1+ΔH2-ΔH3 答案 D 解析 1 mol C参与反应①,放出的热量为394 kJ,转移电子为4 mol,故放出197 kJ热量时,转移2 mol电子,A错误;液态水分解需要吸收热量,B错误;表示燃烧热的热化学方程式中可燃物的化学计量数必须为1,且生成物应为稳定的氧化物,H2O的稳定状态应是液态,而不是气态,C错误;应用盖斯定律,由①×2+②-③×=④可知,D正确。 6.已知氢气的燃烧热为286 kJ·mol-1,N2与O2反应的热化学方程式为N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1,且N2(g)与H2(g)在铁催化剂表面反应生成NH3(g)的过程如图所示。 则氨气的催化氧化反应4NH3(g)+5O2(g)===4NO(g)+6H2O(l)的ΔH为( ) A.+1540 kJ·mol-1 B.-1540 kJ·mol-1 C.+1172 kJ·mol-1 D.-1172 kJ·mol-1 答案 D 解析 由氢气的燃烧热可写出热化学方程式①H2(g)+O2(g)===H2O(l) ΔH1=-286 kJ·mol-1;由合成氨的能量变化图像可得合成氨反应②H2(g)+N2(g)NH3(g) ΔH2=1127 kJ·mol-1-(324+389+460) kJ·mol-1=-46 kJ·mol-1;结合题给反应③N2(g)+O2(g)===2NO(g) ΔH3=+180 kJ·mol-1,根据盖斯定律,由①×6-②×4+③×2,即得4NH3(g)+5O2(g)===4NO(g)+6H2O(l) ΔH=ΔH1×6-ΔH2×4+ΔH3×2=-1172 kJ·mol-1。 7.(2019·河北武邑高三调研)甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。 已知:CH3OH(l)+O2(g)===CO(g)+2H2O(g) ΔH1=-443.64 kJ·mol-1 2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1 下列说法正确的是( ) A.CO的燃烧热为566.0 kJ·mol-1 B.2 mol CO(g)和1 mol O2(g)的总能量比2 mol CO2(g)的总能量低 C.完全燃烧20 g甲醇,生成二氧化碳和水蒸气时放出的热量为908.3 kJ D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1453.28 kJ·mol-1 答案 D 解析 1 mol可燃物完全燃烧生成稳定氧化物放出的热量为燃烧热,根据热化学方程式2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1,可得CO的燃烧热为283.0 kJ·mol-1,故A错误;放热反应中反应物的总能量大于生成物的总能量,所以2 mol CO(g)和1 mol O2(g)的总能量比2 mol CO2(g)的总能量高,故B错误;已知:①CH3OH(l)+O2(g)===CO(g)+2H2O(g) ΔH1=-443.64 kJ·mol-1,②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1,根据盖斯定律①+②×得CH3OH(l)+O2(g)===CO2(g)+2H2O(g) ΔH1=-726.64 kJ·mol-1,则完全燃烧20 g甲醇,即0.625 mol,放出的热量为0.625 mol×726.64 kJ·mol-1=454.15 kJ,故C错误;由C项知CH3OH(l)+O2(g)===CO2(g)+2H2O(g) ΔH1=-726.64 kJ·mol-1,方程式的计量数加倍,则反应热也加倍,则2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1453.28 kJ·mol-1,故D正确。 8.已知下列反应的热化学方程式: ①6C(s)+5H2(g)+3N2(g)+9O2(g)===2C3H5(ONO2)3(l) ΔH1 ②2H2(g)+O2(g)===2H2O(g) ΔH2 ③C(s)+O2(g)===CO2(g) ΔH3 ④H2(g)+O2(g)===H2O(l) ΔH4 ⑤4C3H5(ONO2)3(l)===12CO2(g)+10H2O(g)+O2(g)+6N2(g) ΔH5 下列判断正确的是( ) A.反应②③④的焓变ΔH均大于0 B.ΔH2<2ΔH4 C.ΔH5=12ΔH3+5ΔH2-2ΔH1 D.ΔH5=2ΔH1-5ΔH2-12ΔH3 答案 C 解析 A项,反应②③④均为放热反应,故焓变ΔH均小于0。B项,反应②生成气态水,反应④生成液态水,两个反应生成等量H2O的情况下,生成液态水释放出更多热量,释放热量越多,ΔH越小,故有ΔH2>2ΔH4。根据盖斯定律,⑤=12×③+5×②-2×①,故ΔH5=12ΔH3+5ΔH2-2ΔH1。 9.室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( ) A.ΔH2>ΔH3 B.ΔH1<ΔH3 C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2>ΔH3 答案 B 解析 由题干信息可得:①CuSO4·5H2O(s)===Cu2+(aq)+SO(aq)+5H2O(l) ΔH1>0,②CuSO4(s)===Cu2+(aq)+SO(aq) ΔH2<0,③CuSO4·5H2O(s)=== CuSO4(s)+5H2O(l) ΔH3,根据盖斯定律可知,ΔH3=ΔH1-ΔH2,由于ΔH1>0,ΔH2<0,故ΔH3>ΔH1,B正确,C、D错误;ΔH3>0,ΔH2<0,故ΔH3>ΔH2,A错误。 10.(2019·河南汝州实验中学高三期末)已知25 ℃、101 kPa下,如下图所示,石墨的燃烧热为393.51 kJ/mol,金刚石的燃烧热为395.41 kJ/mol。下列表达正确的是( ) A.金刚石比石墨稳定 B.C(s,石墨)===C(s,金刚石) ΔH=+1.9 kJ/mol C.ΔH1<ΔH2 D.如果使用催化剂,ΔH1和ΔH2都变小 答案 B 解析 由题可知石墨、金刚石燃烧的热化学方程式分别为C(s,石墨)+O2(g)===CO2(g) ΔH=-393.51 kJ/mol;C(s,金刚石)+O2(g)===CO2(g) ΔH=-395.41 kJ/mol,二者相减可得C(s,石墨)===C(s,金刚石) ΔH=+1.9 kJ/mol,B正确。金刚石燃烧放出能量较多,则说明金刚石总能量较大,石墨比金刚石稳定,A错误;反应放热,则ΔH<0,金刚石放出的热量多,则有ΔH1>ΔH2,C错误;催化剂不改变反应热的大小,D错误。 11.(2019·江西师大附中高三期末考试)按要求回答下列问题: (1)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_________。 (2)已知碳的燃烧热ΔH1=a kJ·mol-1,S(s)+2K(s)===K2S(s) ΔH2=b kJ·mol-1,2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ·mol-1,则S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH=____________________________。 (3)已知:C(s)+O2(g)===CO2(g) ΔH=-437.3 kJ·mol-1,H2(g)+O2(g)===H2O(g) ΔH=-285.8 kJ·mol-1,CO(g)+O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1,写出煤气化(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式:____________。计算10m3(标准状况)水煤气完全燃烧放出的热量为________kJ(结果保留到小数点后一位)。 答案 (1)N2(g)+3H2(g)2NH3(g)ΔH=-92 kJ·mol-1 (2)(3a+b-c) kJ·mol-1 (3)C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.5 kJ·mol-1 126964.3 解析 (1)在反应N2+3H22NH3中,断裂3 mol H—H键,1 mol N≡N键共吸收的能量为3×436 kJ+946 kJ=2254 kJ,生成2 mol NH3,共形成6 mol N—H键,放出的能量为6×391 kJ=2346 kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为2346 kJ-2254 kJ=92 kJ,则N2与H2反应生成NH3的热化学方程式为N2(g)+3H2(g)2NH3(g) ΔH=-92 kJ·mol-1。 (2)碳的燃烧热ΔH1=a kJ·mol-1,其热化学方程式为C(s)+O2(g)===CO2(g) ΔH1=a kJ·mol-1 ①, S(s)+2K(s)===K2S(s) ΔH2=bkJ·mol-1 ②,2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ·mol-1 ③,将方程式3×①+②-③得S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g),则ΔH=(3a+b-c) kJ·mol-1。 (3)已知:C(s)+O2(g)===CO2(g) ΔH=-437.3 kJ·mol-1①,H2(g)+O2(g)===H2O(g) ΔH=-285.8 kJ·mol-1②,CO(g)+O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1③。 根据盖斯定律计算,①-②-③得到固态碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.5 kJ·mol-1。根据反应②③可以知道,每2摩尔水煤气完全燃烧放出的热量为285.8 kJ+283.0 kJ=568.8 kJ,所以10 m3(标准状况)的水煤气完全燃烧放出的热量为×568.8 kJ×≈126964.3 kJ。查看更多