- 2021-07-08 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习化学反应速率与化学平衡图象题的破解策略作业(全国通用)
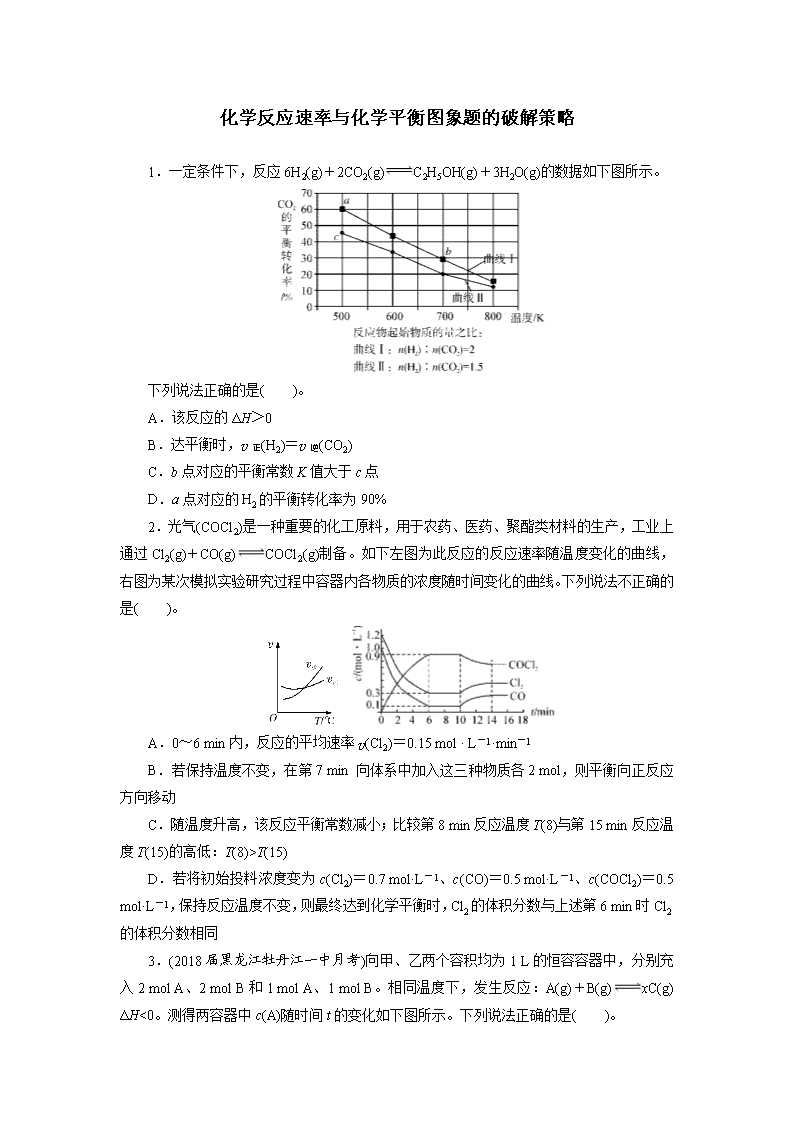
化学反应速率与化学平衡图象题的破解策略 1.一定条件下,反应6H2(g)+2CO2(g)C2H5OH(g)+3H2O(g)的数据如下图所示。 下列说法正确的是( )。 A.该反应的ΔH>0 B.达平衡时,v正(H2)=v逆(CO2) C.b点对应的平衡常数K值大于c点 D.a点对应的H2的平衡转化率为90% 2.光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)COCl2(g)制备。如下左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。下列说法不正确的是( )。 A.0~6 min内,反应的平均速率v(Cl2)=0.15 mol · L-1·min-1 B.若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡向正反应方向移动 C.随温度升高,该反应平衡常数减小;比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)>T(15) D.若将初始投料浓度变为c(Cl2)=0.7 mol·L-1、c(CO)=0.5 mol·L-1、c(COCl2)=0.5 mol·L-1,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同 3.(2018届黑龙江牡丹江一中月考)向甲、乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同温度下,发生反应:A(g)+B(g)xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如下图所示。下列说法正确的是( )。 甲 乙 A.x可能等于2 B.甲、乙两容器中反应达平衡时,平衡常数K(甲)<K(乙) C.将乙容器升温可使甲、乙容器内各物质的体积分数相同 D.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1 4.可逆反应X(g)+2Y(g)Z(g) ΔH<0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如下图所示,则下列说法正确的是( )。 A.若向该容器中加入1 mol X、2 mol Y,达平衡时,X的平衡浓度小于0.125 mol·L-1 B.a点正反应速率大于逆反应速率 C.反应达平衡时,降低温度可以实现c到d的转化 D.该条件下,反应达平衡时,平衡常数K=3 5.(2018届新疆生产建设兵团二中月考)研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。 (1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)===2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1; C(s)+CO2(g)===2CO(g) ΔH2 =+172.5 kJ·mol-1。 则CO还原Fe2O3(s)的热化学方程式为_______________________________________。 (2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:____________________________________。 (3)一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)CH3OH(g)。 ①CO的平衡转化率(α)与温度、压强的关系如下图所示。 B、C两点的平衡常数K(B)________K(C)(填“>”“=”或“<”)。 ②某温度下,将2.0 mol CO和6.0 mol H2充入2 L的密闭容器中,达到平衡时测得c(CO)=0.25 mol·L-1,CO的转化率=________,此温度下的平衡常数K=________(保留两位有效数字)。 6.氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料。 (1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H22NH3。该可逆反应达到平衡的标志是________。 A.3v(H2)正=2v(NH3)逆 B.单位时间生成m mol N2的同时消耗3m mol H2 C.容器内的总压强不再随时间而变化 D.混合气体的密度不再随时间变化 E.a mol N≡N键断裂的同时,有6a mol N—H键断裂 F.N2、H2、NH3的分子数之比为1∶3∶2 (2)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2 L的密闭容器内充入1 mol N2和3 mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度、压强下开始反应,并用压力计监测容器内压强的变化如下: 反应时间/min 0 5 10 15 20 25 30 压强/MPa 16.80 14.78 13.86 13.27 12.85 12.60 12.60 则从反应开始到25 min时,以N2表示的平均反应速率=________;该温度下平衡常数K=________。 (3)利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,主要反应如下: ①CO(g)+2H2(g)CH3OH(g) ΔH=-99 kJ·mol-1 ②CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-58 kJ·mol-1 ③CO2(g)+H2(g)CO(g)+H2O(g) ΔH 图1中能正确反映平衡常数K随温度变化关系的曲线是________;反应③的ΔH=________kJ·mol-1。 图1 图2 (4)合成气的组成=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图2所示。图中的压强p1、p2、p3由大到小的顺序为____________;α(CO)随温度升高而减小,其原因是________________________________________。 7.(2018年浙江名校协作体联考)氮是一种重要的化学元素,与氮有关的重要物质有氨、联氨、尿素、丙烯腈、己二腈等,回答下列问题: (1)已知:2NH3(g)N2 (g)+3H2(g) ΔH=a kJ·mol-1 2H2(g)+O2(g)===2H2O(g) ΔH=b kJ·mol-1 NH3(l)NH3(g) ΔH =c kJ·mol-1 则反应4NH3(l)+3O2(g)===2N2(g)+6H2O(g)的ΔH =________kJ·mol-1。(用a、b、c表示) (2)丙烯腈(CH2==CHCN)是一种重要的化工原料,工业上以氨、丙烯、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)的热化学方程式如下: C3H6(g)+NH3(g)+O2(g)===C3H3N(g)+3H2O(g) ΔH=-515 kJ·mol-1 ①对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则上述反应的Kp=__________________。该反应能自发进行,其原因是__________________________________________________。 ②若其他条件不变,在恒容、温度T1时丙烯腈的物质的量与时间的图象如图(a)所示。请补充完成温度为T2[化学平衡常数K(T1)>K(T2)]时丙烯腈的物质的量随时间变化的示意图。 图(a) 图(b) (3)图(b)为在相同压强下,经过相同反应时间测得的丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460 ℃。则高于 460 ℃时,丙烯腈的产率降低可能的原因:①有副反应发生;②________________________;③________________________。 (4)恒容时,若按丙烯、氨、空气的体积比1∶1∶7.5投料,有利于提高C3H6转化为 C3H3N的平衡转化率的措施有________(填字母)。 A.使用催化剂 B.投料比不变,增加反应物的浓度 C.降低反应温度 D.将产物液化,及时移走产物 (5)己二腈[NC(CH2)4CN] 是一种重要的化工原料,是制造尼龙的中间体。工业上通过电解丙烯腈(CH2==CHCN)制己二腈,H3PO4K3PO4等作为电解质溶液,控制pH在8.5~9.0范围内。写出该电解的总化学方程式:_______________________________。 答案及解析 1.D 解析:随着温度的升高,CO2的转化率降低,说明平衡向逆反应方向移动,正反应为放热反应,ΔH<0,故A错误;速率之比等于化学计量数之比,平衡时v正(H2)=3v逆(CO2),故B错误;正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,即c点大于b点,故C错误;假设消耗CO2的物质的量为1 mol×60%=0.6 mol,则消耗H2的物质的量为1.8 mol,因此氢气的转化率为×100%=90%,故D正确。 2.C 解析:分析右侧图象知0~6 min内,反应的平均速率v(Cl2)==0.15 mol ·L-1·min -1,A正确;分析右侧图象知第7 min时,n(Cl2)∶n(CO)∶n(COCl2)=3∶1∶9,若保持温度不变,在第7 min向体系中加入这三种物质各2 mol,反应物增大的程度较大,则平衡向正反应方向移动,B正确;分析左侧图象知反应达平衡后,升高温度,平衡逆向移动,该反应为放热反应,平衡常数减小;分析右侧图象知第10 min时,平衡逆向移动,改变的条件为升高温度,T(8)查看更多