【化学】天津市滨海新区塘沽一中2020届高三毕业班5月复课模拟检测
天津市滨海新区塘沽一中2020届高三毕业班5月复课模拟检测
第Ⅰ卷
本卷共12题,每题3分,共36分。在每题给出的四个选项中,只有一项是最符合题目要求的。
可能用到的相对原子质量:N14 C12 O16 Al27 Cl35.5 Mn55 Fe56 Cu64 I127
1.下列说法不正确的是( )
A.煤的气化是物理变化,是高效、清洁地利用煤的重要途径
B.我国研制的重组新冠疫苗无需冷藏
C.将牛油和烧碱溶液混合加热,充分反应加入热的饱和食盐水,上层析出甘油
D.华为继麒麟980 之后自主研发的7m芯片问世,芯片的主要成分是硅
2.2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2可用于工业上制备Na2S2O3。下列正确的是( )
A.中子数为20的硫原子:
B.Na+的结构示意图:
C.Na2S的电子式:
D.Na2CO3溶液显碱性的离子方程式:CO32-+2H2O=H2CO3+2OH-
3.下列说法正确的是( )
A.固态二氧化碳属于共价晶体
B.CH4分子中含有极性共价键,所以是极性分子
C.所有的金属元素都分布在d区和ds区
D.离子键、氢键、范德华力本质上都是静电作用
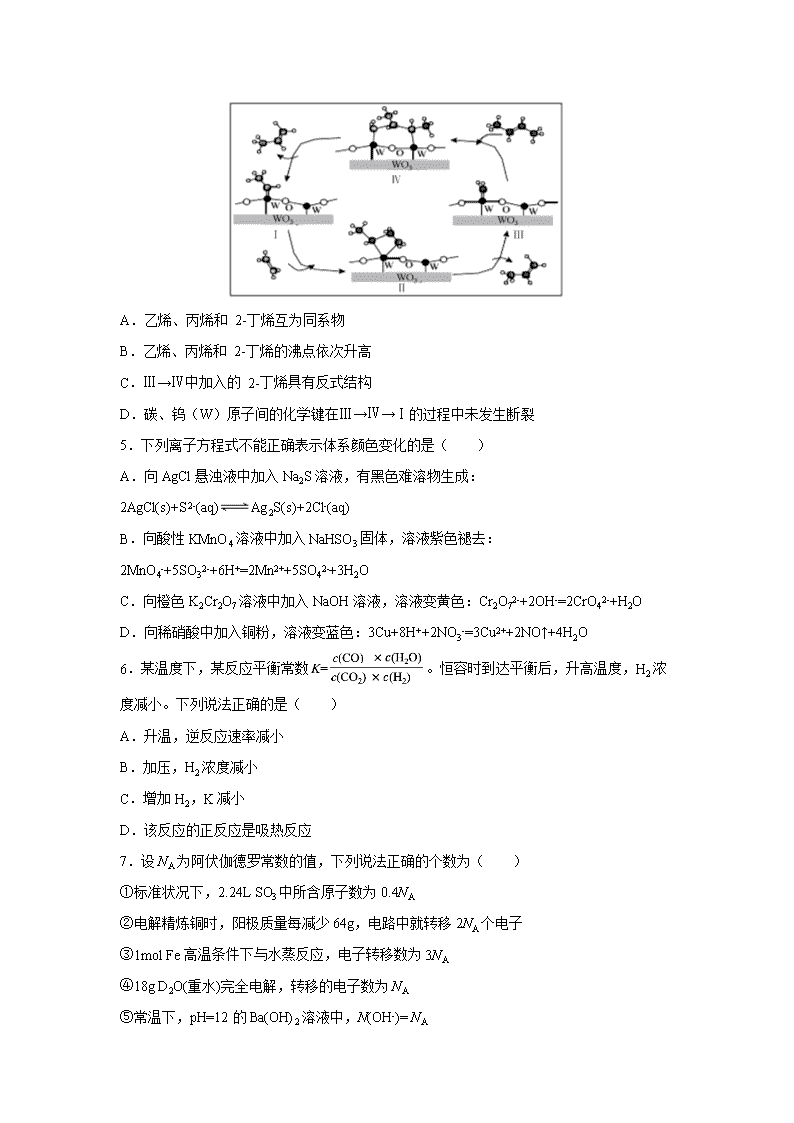
4.科学家提出由WO3催化乙烯和2-丁烯合成丙烯的反应历程如图(所有碳原子满足最
外层八电子结构)。下列说法不正确的是( )
A.乙烯、丙烯和 2-丁烯互为同系物
B.乙烯、丙烯和 2-丁烯的沸点依次升高
C.Ⅲ→Ⅳ中加入的 2-丁烯具有反式结构
D.碳、钨(W)原子间的化学键在Ⅲ→Ⅳ→Ⅰ的过程中未发生断裂
5.下列离子方程式不能正确表示体系颜色变化的是( )
A.向AgCl悬浊液中加入Na2S溶液,有黑色难溶物生成:2AgCl(s)+S2-(aq)Ag2S(s)+2Cl-(aq)
B.向酸性KMnO4溶液中加入NaHSO3固体,溶液紫色褪去:
2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O
C.向橙色K2Cr2O7溶液中加入NaOH溶液,溶液变黄色:Cr2O72-+2OH-=2CrO42-+H2O
D.向稀硝酸中加入铜粉,溶液变蓝色:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
6.某温度下,某反应平衡常数。恒容时到达平衡后,升高温度,H2浓度减小。下列说法正确的是( )
A.升温,逆反应速率减小
B.加压,H2浓度减小
C.增加H2,K减小
D.该反应的正反应是吸热反应
7.设NA为阿伏伽德罗常数的值,下列说法正确的个数为( )
①标准状况下,2.24L SO3中所含原子数为0.4NA
②电解精炼铜时,阳极质量每减少64g,电路中就转移2NA个电子
③1mol Fe高温条件下与水蒸反应,电子转移数为3NA
④18g D2O(重水)完全电解,转移的电子数为NA
⑤常温下,pH=12的Ba(OH)2溶液中,N(OH-)= NA
⑥1L 0.1mol·L-1 Fe2(SO4)3溶液中含有的阳离子数目小于0.2NA
⑦12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
⑧NA个Fe(OH)3胶体粒子形成的纳米材料的质量大于107g
A.1 B.2 C.3 D.4
8.短周期主族元素W、X、Y、Z的原子序数依次增大。W的某种核素不含中子;X、Y原子核外L层的电子数之比为3:4;X与Z同主族,且X、Y、Z原子的最外层电子数之和为16。下列说法不正确的( )
A.W、X、Z三种元素形成的化合物一定为强电解质
B.简单氢化物的稳定性:X>Z>Y
C.电负性:X>Z>Y
D.原子半径:Y>Z>X>W
9.下列设计的实验方案能达到实验目的的是( )
实验方案
实验目的
A
取三种试剂各10 mL于试管中,再分别加入5mL蒸馏水,振荡、静置,观察现象
鉴别苯、乙醇、四氯化碳三种无色液体
B
向MgCl2、FeCl3的混合溶液中滴加少量NaOH溶液,观察现象
比较Ksp[Fe(OH)3]、 Ksp[Mg(OH)2]的大小
C
取溶液少许,向其中滴加BaCl2溶液,向所得沉淀中加入足量稀硫酸,观察现象
检验久置的亚硫酸钠溶液是否变质
D
向苯酚稀溶液中加入过量的饱和溴水,充分反应后静置,向上层清液中滴加硝酸银溶液,观察现象
证明苯酚与溴水反应是取代反应
10.我国化学家侯德榜发明的“侯氏制碱法”联合合成氨工业生产纯碱和氮肥,工艺流程图如下。碳酸化塔中的反应:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
下列说法不正确的是( )
A.以海水为原料,经分离、提纯和浓缩后得到饱和氯化钠溶液进入吸氨塔
B.碱母液储罐“吸氨”后的溶质是NH4Cl和NaHCO3
C.经“冷析”和“盐析”后的体系中存在平衡 NH4Cl(s)NH4+(aq)+Cl-(aq)
D.该工艺的碳原子利用率理论上为 100%
11.利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示,H+、O2、NO3-等共存物会影响修复效果。下列说法错误的是( )
A.反应①②③④均为还原反应
B.1mol三氯乙烯完全脱Cl时,电子转移为3mol
C.④的电极反应式为NO3- +10H+ +8e- =NH4++3H2O
D.修复过程中可能产生Fe(OH)3
12.常温下,向盛50mL0.100mol·L-1盐酸的两个烧杯中各自匀速滴加50mL的蒸馏水、0.100mol·L-1醋酸铵溶液,测得溶液pH随时间变化如图所示。
已知Ka(CH3COOH)=1.8×10-5,Kb(NH3·H2O)=1.8×10-5。下列说法正确的是( )
A.曲线X是盐酸滴加蒸馏水的pH变化图,滴加过程中各种离子浓度逐渐减小
B.曲线Y上的任意一点溶液中均存在c(CH3COO-)
”或“<”) ,原因是 。
(3)①AlH4-的中心原子的杂化方式为 ,其空间构型为 。
②AsH3分子中H—As—H键角 NH3分子中H—N—H(填“>”、“=”或“<”),其原因是
(从原子结构和性质角度解释)。
(4)是治疗昏睡病的药物,其中存在的化学键种类为 (填字母编号)。a.离子键 b.σ键 c.π键 d.碳碳双键
(5)砷的同主族元素氮及其化合物在生产生活中应用广泛。
①是典型钝感起爆药,由[Co(NH3)5H2O](ClO4)3和合成,中孤电子对与π键比值为 , Co3+的配位数为 。
②AlN是一种陶瓷绝缘体,晶胞如图。其密度为dg/cm3,则最近的N原子与Al原子间的距离为_______pm。
14.(16分)花椒毒素(H)有抗实验性心律失常、镇痛、抗炎等作用。由芳香族化合物A为原料合成H的一种合成路线如下:
已知: +ClCH2CH2Cl+HCl
(1)A的化学名称是 (用系统命名法)。
(2)G中所含官能团的名称是 。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。E中 (填“有”或“没有”)手性碳。
(4)反应⑥的反应类型是 。
(5)D的结构简式为 。
(6)F与足量NaOH溶液反应的化学方程式为 。
(7)芳香族化合物W是D的同分异构体,能发生银镜反应和水解反应,遇FeCl3溶液发生显色反应;W的核磁共振氢谱有5组峰,且面积比为1∶2∶2∶2∶1。符合上述要求的W有 种。
(8)有机物M()是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线(无机试剂及有机溶剂任用)
15.(17分)乳酸亚铁晶体([CH3CH(OH)COO]2Fe·3H2O,相对分子质量为288)易溶于水,是一种很好的补铁剂,可由乳酸[CH3CH(OH)COOH]与FeCO3反应制得。
I.碳酸亚铁的制备(装置如图所示)
(1)仪器B的名称是 ;实验操作如下:打开k1、k2,加入适量稀硫酸,关闭k1,使反应进行一段时间,其目的是 。
(2)接下来要使仪器C中的制备反应发生,需要进行的操作是 ,其反应的离子方程式为 。
(3)仪器C中混合物经过滤、洗涤得到FeCO3沉淀,检验其是否洗净的方法是
。
Ⅱ.乳酸亚铁的制备及铁元素含量测定
(4)向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在 的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
(5)两位同学分别用不同的方案进行铁元素含量测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于100%,其原因可能是 。
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成100mL溶液。吸取 25.00mL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0.100 mol·L-1硫代硫酸钠溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),当溶液 ,即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24.80 mL,则样品纯度为 %(保留1位小数)。
16.(14分)甲醇、乙醇是重要的化工原料,可以用多种方法合成。
(1)已知:H2的燃烧热为-285.8 kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,CH3OH(g)=CH3OH(l) △H= -37.3 kJ/mol,则CO2与H2反应生成甲醇蒸气和液态水的热化学方程式为 。
(2)若在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)下列能说明该反应达到平衡状态的是 。
A.混合气体平均相对分子质量不变
B.混合气体密度不变
C.容器内压强恒定不变
D.反应速率满足以下关系:v正(CO2)=3v逆(H2)
E.CO2、H2、CH�OH、H2O物质的量浓度之比为1:3:1:1
F.单位时间内断裂3NAH-H键的同时形成2molH-O键
(3)将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应[生成H2O(g)],图1表示压强为0.1 MPa和5.0 MPa下CO2转化率随温度的变化关系。
a、b两点化学反应速率分别用va、vb表示,则va vb(填“>”、“<”或“=”)。
(4)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g)+3H2(g) CH3OH (g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是 。
A.该反应的正反应为放热反应 B.压强大小关系为p1<p2<p3
C.M点平衡常数K约为1.04×10-2 D.在P2及512 K时,图中N点υ(正)<υ(逆)
(5)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。
离子交换膜a为 (填“阳膜”、“阴膜”),阳极的电极反应式为 。
(6)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:
N2H4+H2ON2H5++OH- K1=10-a;
N2H5++H2ON2H62++OH- K1=10-b;
25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)> c(N2H4),同时c(N2H5+)> c(N2H62+),应控制溶液pH范围 (用含a、b式子表示)。
【参考答案】
1.D 2.B 3.D 4.D 5.B 6.D 7.B 8.A 9.A 10. B 11.B 12.B
13. (共17分)
(1)3d84s2 哑铃(纺锤) 第四周期第ⅤA族(每空1分)
(2)> As元素原子的4p轨道上的电子呈半满状态,比较稳定 (每空1分)
(3)①sp3 正四面体 ②< 砷原子半径大,电负性小,共用电子对离核较远斥力小(前三个空每空1分,最后一个空2分)
(4)abc (3分)
(5)①5:4(1分) 6(1分)
② (2分)
14. (共16分)
(1)1,2,3—苯三酚 (2分)
(2)酯基、醚键和碳碳双键(3分)
(3)有 (1分)
(4)消去反应 (1分)
(5) (2分)
(6) +3NaOH→+2H2O (2分)
(7) 1 (2分)
(8) (3分)
15. (共17分)
(1)蒸馏烧瓶(1分)
生成FeSO4溶液,用产生的H2排尽装置内的空气,防止二价铁被氧化(2分)
(2)关闭(1分) Fe2++2HCO3- = Fe CO3↓+ CO2↑+H2O(2分)
(3)取最后一次水洗液于试管中,加入过量稀盐酸酸化,滴加一定量的BaCl2溶液,若无白色浑浊出现,则洗涤干净 (3分)
(4)隔绝空气 (2分)
(5)①乳酸根中羟基(-OH)能被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾溶液偏多 (2分)
②蓝色褪去且半分钟不恢复 (2分) 95.2%(2分)
16.(共14分)
(1)CO2(g)+3H2(g)=CH3OH(g)+ H2O(1) △H=-94.3 kJ/mol (2分)
(2)AC (2分)
(3)> (2分)
(4)AC (2分)
(5)阳膜 (2分) 2CH3OH+CO−2e−=(CH3O)2CO+2H+ (2分)
(6)14-b<pH<14-a (2分)