- 2021-07-08 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习有关反应速率、平衡常数、转化率的计算作业(全国通用)
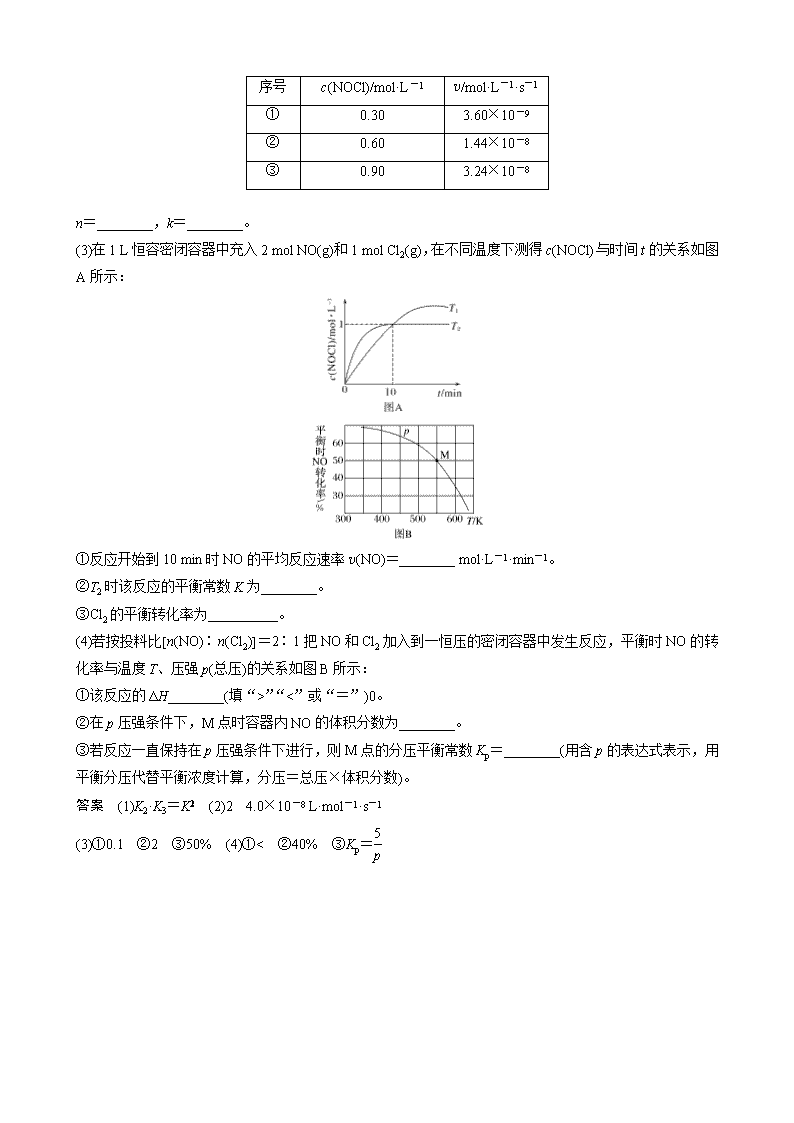
有关反应速率、平衡常数、转化率的计算 1.用催化剂可以使NO、CO污染同时降低,2NO(g)+2CO(g)N2(g)+2CO2(g),根据传感器记录某温度下NO、CO的反应进程,测量所得数据绘制出如图。 前1 s内的平均反应速率v(N2)=__________,第2 s时的x值范围________。 答案 2.7×10-4 mol·L-1·s-1 30.6>x>25.2 2.研究漂白液的稳定性对其生产和保存有实际意义。下图是30 ℃时,三种漂白液中NaClO的质量百分含量随时间的变化关系。 (1)分解速率v(Ⅰ)________(填“>”“<”或“=”)v(Ⅱ),其原因是 ________________________________________________________________________。 (2)漂白液Ⅰ在4~8天内的分解速率为________mol·L-1·d-1。(常温下漂白液的密度近似等于1 g·cm-3,溶液体积变化忽略不计,计算结果保留2位有效数字) 答案 (1)> 相同条件下,Ⅰ中NaClO浓度大,因而反应速率大 (2)0.047 3.近期发现,H2S是继NO、CO之后第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题: H2S与CO2在高温下发生反应:H2S(g)+CO2(g)COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。 H2S的平衡转化率α1=________%,反应平衡常数K=________。 答案 2.5 2.8×10-3 4.[2017·全国卷Ⅲ,28(4)①]砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题: 298 K时,将20 mL 3x mol·L-1Na3AsO3、20 mL 3x mol·L-1 I2和20 mL NaOH溶液混合,发生反应:AsO(aq)+I2(aq)+2OH-(aq)AsO(aq)+2I-(aq)+H2O(l)。溶液中c(AsO)与反应时间(t)的关系如图所示。 若平衡时溶液的pH=14,则该反应的平衡常数K为____。 答案 5.化学家研究在催化剂作用下,通过反应:CCl4+H2CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为77 ℃,CHCl3的沸点为61.2 ℃。在密闭容器中,该反应在110 ℃下达到平衡状态后,测得如下数据(假设不考虑副反应): 实验序号 温度/℃ 初始CCl4的浓度/mol·L-1 初始H2的浓度/mol·L-1 CCl4平衡转化率 1 110 0.8 1.2 a 2 110 1 1 50% 3 100 1 1 b (1)此反应的化学平衡常数表达式为___________________________________________。 在110 ℃时平衡常数为_____________________________________________________。 (2)实验1中,CCl4的转化率a__________(填“大于”“小于”或“等于”)50%。 (3)实验2中,10 h后达到平衡,H2的平均反应速率为________________。 (4)实验3中,b的值________(填字母)。 A.等于50% B.大于50% C.小于50% D.无法判断 答案 (1)K= 1 (2)大于 (3)0.05 mol·L-1·h-1 (4)D 6.亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO和Cl2反应得到,化学方程式为 2NO(g)+Cl2(g)2NOCl(g)。 (1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应: ①2NO2(g)+NaCl(s)NaNO3(s)+NOCl(g) ②4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g) ③2NO(g)+Cl2(g)2NOCl(g) 设反应①②③对应的平衡常数依次为K1、K2、K3,则K1、K2、K3之间的关系为______________________。 (2)300 ℃时,2NOCl(g)2NO(g)+Cl2(g)。 正反应速率的表达式为v正=k·cn(NOCl)(k为速率常数,只与温度有关),测得速率与浓度的关系如表所示: 序号 c(NOCl)/mol·L-1 v/mol·L-1·s-1 ① 0.30 3.60×10-9 ② 0.60 1.44×10-8 ③ 0.90 3.24×10-8 n=________,k=________。 (3)在1 L恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g),在不同温度下测得c(NOCl)与时间t的关系如图A所示: ①反应开始到10 min时NO的平均反应速率v(NO)=________ mol·L-1·min-1。 ②T2时该反应的平衡常数K为________。 ③Cl2的平衡转化率为__________。 (4)若按投料比[n(NO)∶n(Cl2)]=2∶1把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图B所示: ①该反应的ΔH________(填“>”“<”或“=”)0。 ②在p压强条件下,M点时容器内NO的体积分数为________。 ③若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=________(用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。 答案 (1)K2·K3=K (2)2 4.0×10-8 L·mol-1·s-1 (3)①0.1 ②2 ③50% (4)①< ②40% ③Kp=查看更多