- 2021-07-08 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学第一轮复习课件第3讲 电解池、金属的腐蚀与防护-6真题演练·部分真题解读
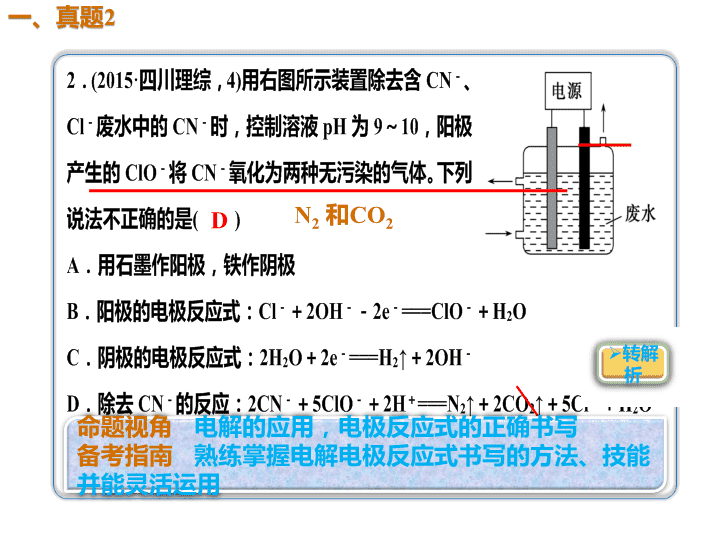
N2 和CO2 D 解析 Cl-在阳极发生氧化反应生成ClO-,水 电离出的H+在阴极发生还原反应生成H2,又 由于电解质溶液呈碱性,故A、B、C项正确; D项,溶液呈碱性,离子方程式中不能出现H+, 正 确 的 离 子 方 程 式 为 2 C N - + 5 C l O - + H2O===N2↑+2CO2↑+5Cl-+2OH-,错误。 3.(2015·上海化学,14)研究电化学腐蚀及防护 的装置如图所示。下列有关说法错误的是( ) A.d为石墨,铁片腐蚀加快 B.d为石墨,石墨上电极反应为:O2+2H2O+ 4e-→4OH-C.d为锌块,铁片不易被腐蚀 D.d为锌块,铁片上电极反应为:2H++2e- →H2↑ D 发生吸氧腐 蚀 解析 A项,由于活动性:Fe>石墨,所以铁、石墨 及海水构成原电池,Fe为负极,失去电子被氧化变 为Fe2+进入溶液,溶解在海水中的氧气在正极石墨 上得到电子被还原,比没有形成原电池时的速率快, 正确;B项,d为石墨,由于是中性电解质,所以发 生的是吸氧腐蚀,石墨上氧气得到电子,发生还原 反应,电极反应为O2+2H2O+4e-―→4OH-,正确; C项,若d为锌块,则由于金属活动性:Zn>Fe,Zn 为原电池的负极,Fe为正极,首先被腐蚀的是Zn, 铁得到保护,铁片不易被腐蚀,正确;D项,d为锌 块,由于电解质为中性环境,发生的是吸氧腐蚀, 在铁片上电极反应为O2+2H2O+4e-―→4OH-,错 误。查看更多