黑龙江省双鸭山市第一中学2019-2020学年高一线上考试化学试卷
化学试题
注意事项:
1. 非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。注意拍照上传清晰、规范。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
2.相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Fe 56 Mn 55 Ba 137
一、单选题(每小题3分,共60分。每小题只有一个选项符合题目要求。)
1.下列关于化学反应中能量变化的说法正确的是
A.断开化学键会释放能量 B.氧化还原反应均为放热反应
C.化学反应过程中一定伴有能量变化 D.需要加热才能发生的反应一定是吸热反应
2.下列物质间的反应,其能量变化符合如图的是
A.碳酸钙的分解 B.灼热的炭与二氧化碳反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合 D.铝热反应
3.下列化学用语或模型图表示正确的是
A.S2−的结构示意图为:
B.CO2分子比例模型:
C.6个质子8个中子的碳元素的核素符号:12C
D.NH4Cl的电子式:
4.在恒温、恒容的密闭容器中进行反应A(g)=B(g)+C(g)。若反应物A的浓度由2mol·L−1降到0.8mol·L−1需20s,那么反应物浓度由0.8mol·L−1降到0.2mol·L−1所需反应时间为
A.10s B.大于10s C.小于10s D.无法判断
5.在2A+B3C+4D反应中,表示该反应速率最快的是
A.υ(A)=15mol·(L·min)−1 B.υ(B)=18mol·(L·min)−1
C.υ(C)=0.8mol·(L·s)−1 D.υ(D)=1mol·(L·s)−1
6.在密闭容器中进行反应X+2Y2Z,已知反应中X、Y、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到化学平衡时,各物质的浓度可能是
A.X为0.2mol/L B.Y为0.5mol/L
C.Z为0.35mol/L D.Y为0.10mol/L
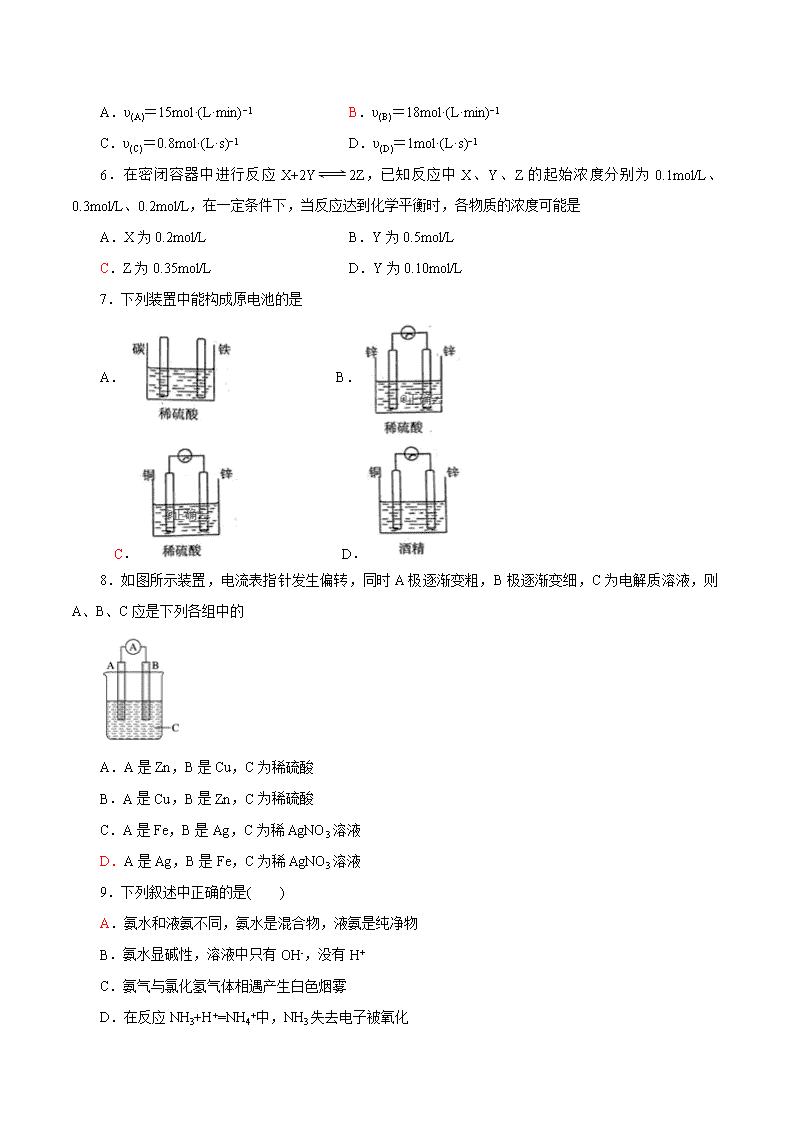
7.下列装置中能构成原电池的是
A. B.
C. D.
8.如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的
A.A是Zn,B是Cu,C为稀硫酸
B.A是Cu,B是Zn,C为稀硫酸
C.A是Fe,B是Ag,C为稀AgNO3溶液
D.A是Ag,B是Fe,C为稀AgNO3溶液
9.下列叙述中正确的是( )
A.氨水和液氨不同,氨水是混合物,液氨是纯净物
B.氨水显碱性,溶液中只有OH-,没有H+
C.氨气与氯化氢气体相遇产生白色烟雾
D.在反应NH3+H+=NH4+中,NH3失去电子被氧化
10.锂电池是一代新型高能电池,它以质量轻、能量高而重视,目前已研制成功多种锂电池。某种锂电池的总反应方程式为Li+MnO2==LiMnO2,下列说法正确的是
A.Li是正极,电极反应式为Li-e−=Li+
B.Li是负极,电极反应式为Li-e−=Li+
C.MnO2是负极,电极反应式为MnO2+e−=MnO2-
D.Li是负极,电极反应式为Li-2e−=Li2+
11.1999年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素,该同位素原子的质量数为298。以下叙述不正确的是
A.该元素属于第七周期 B.该元素为金属元素,性质与82Pb相似
C.该元素位于ⅣA族 D.该同位素原子含有184个质子
12.离子RO中共有x个核外电子,R原子的质量数为A,则R原子核内含中子的数目
A.A+n+32-x B.A+n-24-x C.A-n+24-x D.A+n+24-x
13.将40 mL二氧化氮和一氧化氮的混合气体通入倒立于水槽中盛满水的试管中,充分反应后试管中剩下20 mL气体,则原混合气体中二氧化氮和一氧化氮的体积比为( )
A.2∶1 B.1∶3
C.3∶1 D.1∶1
14.同周期的A、B、C三元素,其最高价氧化物对应水化物的酸性强弱顺序是:HAO4>H2BO4>H3CO4,则下列判断错误的是
A.阴离子还原性C3−>B2−>A− B.气态氢化物稳定性HA>H2B>CH3
C.非金属性A>B>C D.离子半径A>B>C
15.下列各组中的性质比较正确的是( )
①酸性:HClO4>HBrO4>HIO4
②碱性:KOH>Ca(OH)2>Mg(OH)2
③熔点:Li
Cl->Br-
⑤稳定性:HCl>H2S>PH3
A. ①②⑤ B. ②③④ C. ①②③ D. ③④⑤
16.几种短周期元素的原子半径及主要化合价见下表
元素符号
X
Y
Z
R
T
原子半径(nm)
0.160
0.080
0.102
0.143
0.074
主要化合价
+2
+2
-2,+4,+6
+3
-2
根据表中信息,判断以下说法正确的是
A.单质与稀硫酸反应的速率快慢:R>X>Y
B.离子半径:T2−>X2+
C.元素最高价氧化物的水化物的碱性:Y>R>X
D.单质与氢气化合由易到难:Z>T
17.下列说法正确的是
A.同一周期相邻主族的两种元素的原子序数之差一定是1
B.同一主族的两种元素的原子序数之差可能是36
C.同一主族相邻周期的两种元素的原子序数之差可能是26
D.同一主族相邻周期的两种元素的原子序数之差都相同
18.有关硝酸化学性质的叙述中,正确的是
A.硝酸能与Na2CO3、Na2S、Na2SO3等盐反应,产生CO2、H2S和SO2
B.硝酸与FeO反应生成Fe(NO3)2和水,与Fe反应生成Fe(NO3)2和H2
C.浓硝酸、稀硝酸都只能使蓝色石蕊试纸变红
D.浓硝酸因分解放出的NO2又溶解于浓硝酸而使之呈黄色
19.在两个恒温、恒容的密闭容器中进行下列两个可逆反应:(甲)2X(g)Y(g)+Z(s) (乙)A(s)+2B(g)C(g)+D(g),当下列物理量不再发生变化时:①混合气体的密度;②混合气体的压强;③反应物的消耗速率与生成物的消耗速率之比等于系数之比;④反应容器中生成物的百分含量;⑤混合气体的总物质的量。其中能表明(甲)和(乙)都达到化学平衡状态是
A.①②③ B.①②③④ C.①③④ D.①②③④⑤
20.有某硫酸和硝酸的混合溶液20mL,其中含有硫酸的浓度为2mol/L,含硝酸的浓度为1mol/L,现向其中加入0.96g铜粉,充分反应后(假设只生成NO气体),最多可收集到标况下的气体的体积为( )
A.89.6mL B.112mL C.168mL D.224mL
二、 非选择题(共40分)
21 (13分).三种短周期元素x、y、z对应的单质X、Y、Z,常温常压下均为无色气体,在适当条件下单质X、Y、Z之间可以发生如图所示的变化。已知B分子组成中z原子个数比C分子中多一个。
请回答下列问题:
(1)元素x的原子结构示意图___;元素y在周期表中的位置是___;
(2)写出单质氟与C反应的离子反应方程式:___。
(3)Y与X在一定条件下生成化合物A的化学方程式:___。
(4)一定条件下,将盛有10mLA的大试管倒置于水槽的水中然后缓缓通入Y至液体刚好充满试管,写出反应的化学方程式___;通入相同状况下气体Y的体积为___。
(5)用电子式表示B的形成过程___。
【答案】 (1). (1分) 第二周期ⅥA族 (2分) (2). 2F2+2H2O=4HF+O2 (2分) (3). N2+O22NO (2分) (4). 4NO+3O2+2H2O═4HNO3 (2分) 7.5mL (2分) (5). +3 (2分)
22.(12分)I.某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。
(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s
0
50
150
250
350
n(NH3)
0
0.36
0.48
0.50
0.50
0~50s内的平均反应速率v(N2)=__________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol NH3过程中放出46kJ的热量。则的键能为 kJ/mol。
II.在2L密闭容器内,800℃时反应2NO(g)+O2(g)→2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s
0
1
2
3
4
5
n(NO)/mol
0.020
0.010
0.008
0.007
0.007
0.007
(4)上述反应_____(填“是”或“不是”)可逆反应。
(5)如图所示,表示NO2变化曲线的是____。用O2表示0~1s内该反应的平均速率v=____。
(6)能说明该反应已达到平衡状态的是____(填字母)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
【答案】(1)3X(g)+Y(g)2Z(g)(2分)
(2)1.8×10−3mol/(L·s)(2分)
(3)946(2分)
(4)是(1分)
(5)b(1分) 0.0025mol/(L·s)(2分)
(6)bc(2分)
23.(11分)能源与材料、信息一起被称为现代社会发展的三大支柱。面对能源枯竭的危机,提高能源利用率和开辟新能源是解决这一问题的两个主要方向。
I. 化学反应速率和限度与生产、生活密切相关,这是化学学科关注的方面之一。某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水法收集反应放出的氢气,实验记录如下(累计值):
时间
1
2
3
4
5
氢气体积/mL(标况)
100
240
464
576
620
(1)哪一段时间内反应速率最大:__________min(填“0~1”“1~2”“2~3”“3~4”或“4~5”)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积。他事先在盐酸中加入等体积的下列溶液以减慢反应速率但不影响生成氢气的量。你认为可行的是____________(填字母序号)。
A.KCl溶液 B.浓盐酸 C.蒸馏水 D.CuSO4溶液
II. 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
甲 乙 丙
(3)下列对于甲乙说法正确的是________。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
(4)图丙为甲烷(CH4)氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。通甲烷一极的电极反应方程式为___________________________________________。
(5)以NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2mol·L−1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为____________________;每消耗3.4g NH3转移的电子数目为_________。
【答案】(1)2~3min(1分) (2) AC(2分)
(3)BD (2分) (4) CH4+10OH−-8e−=CO+7H2O (2分)
(5)2NH3+6OH-6e−=N2+6H2O (2分) 0.6NA (2分)
24.(4分)中学化学常见物质A、B可以发生如下反应:A+B→X+Y+H2O (未配平,反应条件略去)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,A和B以物质的量之比1∶4反应。
(1)过量的A和100 mL 2 mol·L-1的B溶液充分反应后将溶液稀释至500 mL后溶液中阴离子的物质的量浓度为____________。
(2)含amol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量之比为1∶2时,则被还原的X的物质的量是__________。
【答案】.(1)0.3 mol·L-) (2分)(2)amol或amol (2分)
【解析】由题意可知A为铁,B为硝酸,铁与稀硝酸反应的方程式:
3Fe+8HNO3(稀)===3Fe(NO3)2+2NO↑+4H2O。
硝酸的物质的量=0.1 L×2 mol·L-1=0.2 mol,
生成硝酸亚铁的物质的量=0.2 mol÷8×3=0.075 mol,
稀释后溶液中阴离子的物质的量浓度=0.075 mol×2÷0.5 L=0.3 mol·L-1;
设被还原的硝酸铁的物质的量为x,
由2Fe3++Fe===3Fe2+可知, 生成Fe2+的物质的量=1.5x,
(amol-x) ∶1.5x=1∶2,x=amol,
(amol-x) ∶1.5x=2∶1,x=amol。