- 2021-07-08 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
云南省麻栗坡民中2020届高三上学期期中考试化学试题
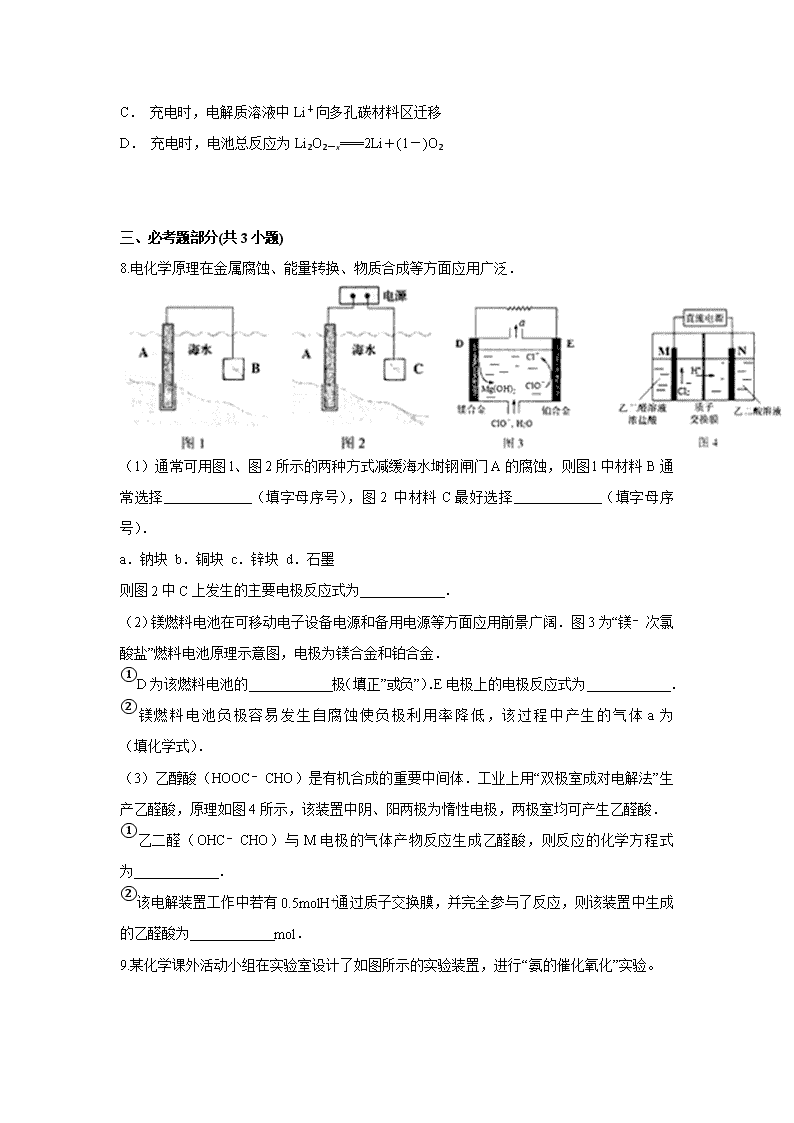
云南省麻栗坡民中2019-2020学年上学期期中考试 高三 理综 化学 一、单选题(共7小题,每小题6.0分,共42分) 1.下列叙述正确的是( ) A. 24 g镁与27 g铝中,含有相同的质子数 B. 同等质量的氧气和臭氧中,电子数相同 C. 1 mol重水与1 mol水中,中子数比为2∶1 D. 1 mol乙烷与1 mol乙烯中,化学键数相同 2.下列叙述错误的是( ) A. 氦气可用于填充飞艇 B. 氯化铁可用于硬水的软化 C. 石英砂可用于生产单晶硅 D. 聚四氟乙烯可用于厨具表面涂层 3.将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到aL混合气体。将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为( ) A. 2∶1∶1 B. 1∶1∶2 C. 1∶2∶1 D. 4∶3∶1 4.下列有关物质性质的比较,结论正确的是( ) A. 溶解度:Na2CO3<NaHCO3 B. 热稳定性:HCl<PH3 C. 沸点:C2H5SH<C2H5OH D. 碱性:LiOH<Be(OH)2 5.a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族,下列叙述正确的是( ) A. 原子半径:d>c>b>a B. 4种元素中b的金属性最强 C. c的氧化物的水化物是强碱 D. d单质的氧化性比a单质的氧化性强 6.下列物质加热熔化时,所克服粒子间相互作用力属于同类型的是( ) A. 食盐和金属钠的熔化 B. 氯化铵和单质硫的熔化 C. 碘和干冰的升华 D. 金刚石和石灰石的熔化 7.一种可充电锂—空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是( ) A. 放电时,多孔碳材料电极为负极 B. 放电时,外电路电子由多孔碳材料电极流向锂电极 C. 充电时,电解质溶液中Li+向多孔碳材料区迁移 D. 充电时,电池总反应为Li2O2-x===2Li+(1-)O2 三、必考题部分(共3小题) 8.电化学原理在金属腐蚀、能量转换、物质合成等方面应用广泛. (1)通常可用图l、图2所示的两种方式减缓海水埘钢闸门A的腐蚀,则图l中材料B通常选择 (填字母序号),图2 中材料C最好选择 (填字母序号). a.钠块 b.铜块 c.锌块 d.石墨 则图2中C上发生的主要电极反应式为 . (2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.图3为“镁﹣次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金. ①D为该燃料电池的 极(填“正”或“负”).E电极上的电极反应式为 . ②镁燃料电池负极容易发生自腐蚀使负极利用率降低,该过程中产生的气体a为 (填化学式). (3)乙醇酸(HOOC﹣CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸. ①乙二醛(OHC﹣CHO)与M电极的气体产物反应生成乙醛酸,则反应的化学方程式为 . ②该电解装置工作中若有0.5molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为 mol. 9.某化学课外活动小组在实验室设计了如图所示的实验装置,进行“氨的催化氧化”实验。 (1)A处是气体发生装置,A中所用的试剂只能从下列物质中选取: ①硝酸铵;②碳酸铵;③碳酸氢铵;④氯化铵;⑤熟石灰;⑥氢氧化钠。 若A中制取气体时只用了一种药品,则该药品可以是________(填选项编号),在只用一种药品制取氨气时,图中空白处所需仪器应为__________(选填下列仪器编号,固定装置省略)。 (2)该装置补充完整后,仍然存在一定的缺陷,试从安全与环保的角度来考虑,对该装置进行改进: ①________________________________________________________________________; ②________________________________________________________________________。 (3)按照改进后的装置进行实验,请完成以下问题: ①装置B的作用是_________________________________________________________; ②写出C中发生反应的化学方程式:_________________________________________; ③若A,B处试剂足量,则装置D中可以观察到的实验现象有___________________。 10.铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下: 注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。 (1)“碱溶”时生成偏铝酸钠的离子方程式为___________________________________。 (2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH________(填“增大”、“不变”或“减小”)。 (3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是_____________________________________________。 (4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为________,阴极产生的物质A的化学式为________。 (5)铝粉在1 000 ℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_________________________________________________。 【化学选修:有机化学基础15分】 11.化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下: 已知以下信息: ①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。 ②D的苯环上仅有两种不同化学环境的氢;1 mol D可与1 mol NaOH或2 mol Na反应。 回答下列问题: (1)A的结构简式为________________。 (2)B的化学名称为________________。 (3)C与D反应生成E的化学方程式为___________________________。 (4)由E生成F的反应类型为________________。 (5)G的分子式为________________。 (6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1 mol的L可与2 mol的Na2CO3 反应,L共有________种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为____________________、____________________。 【化学选修:物质结构与性质】15分 12.有A、D、E、G、M、L六种前四周期的元素。A是宇宙中最丰富的元素。D原子核外有1个未成对电子,D+比E原子少1个电子层,E原子得1个电子填入3p轨道后,3p轨道呈全充满状态。G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G原子序数相差8。L位于周期表第12纵行且是六种元素中原子序数最大的。R是由M、L形成的化合物,其晶胞结构如下图所示。 请回答下列问题: (1)E元素的电负性________(填“>”“<”或“=”)M元素的电负性。 (2)G的第一电离能比它同周期前一族相邻元素的第一电离能________(填“大”或“小”)。 (3)M2E2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构。则在M2E2分子中M原子的杂化类型是________,M2E2是________(填“极性”或“非极性”)分子。 (4)L的价电子排布式为________,该元素位于周期表中的________族。 (5)R的化学式为____________(用元素符号表示),属于________晶体。已知R晶体的密度为ρg·cm-3,则该晶胞的边长a________cm。(阿伏伽德常数用NA表示) 答案 1.B 2.B 3.A 4.C 5.B 6.C 7.D 8.(1)c;d;2Cl﹣﹣2e﹣═Cl2↑; (2)①负;ClO﹣+2e﹣+H2O═Cl﹣+2OH﹣;②H2; (3)①OHC﹣CHO+Cl2+H2O═HOOC﹣CHO+2HCl;②0.5. 9.(1)②或③ e,f,g,h (2)①在装置C与D之间增加一个防倒吸装置 ②在D后增加一个尾气吸收装置 (3)①吸收CO2和水蒸气,并生成O2 ②4NH3+5O24NO+6H2O ③铜片逐渐减少直至溶解,溶液变蓝色,生成无色气体并在广口瓶上方变成红棕色 10.(1)Al2O3+2OH-===2AlO+H2O (2)减小 (3)石墨电极被阳极上产生的O2氧化 (4)4CO+2H2O-4e-===4HCO+O2↑ H2 (5)NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜 11. (1) (2)2丙醇(或异丙醇) (3)HOCH2CH2OCH(CH3)2+ +H2O (4)取代反应 (5)C18H31NO4 (6)6 、 12.(1)> (2)小 (3)sp3 极性 (4)3d104s2 ⅡB (5)ZnS 离子 a=查看更多