- 2021-07-08 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版化学反应进行的方向作业
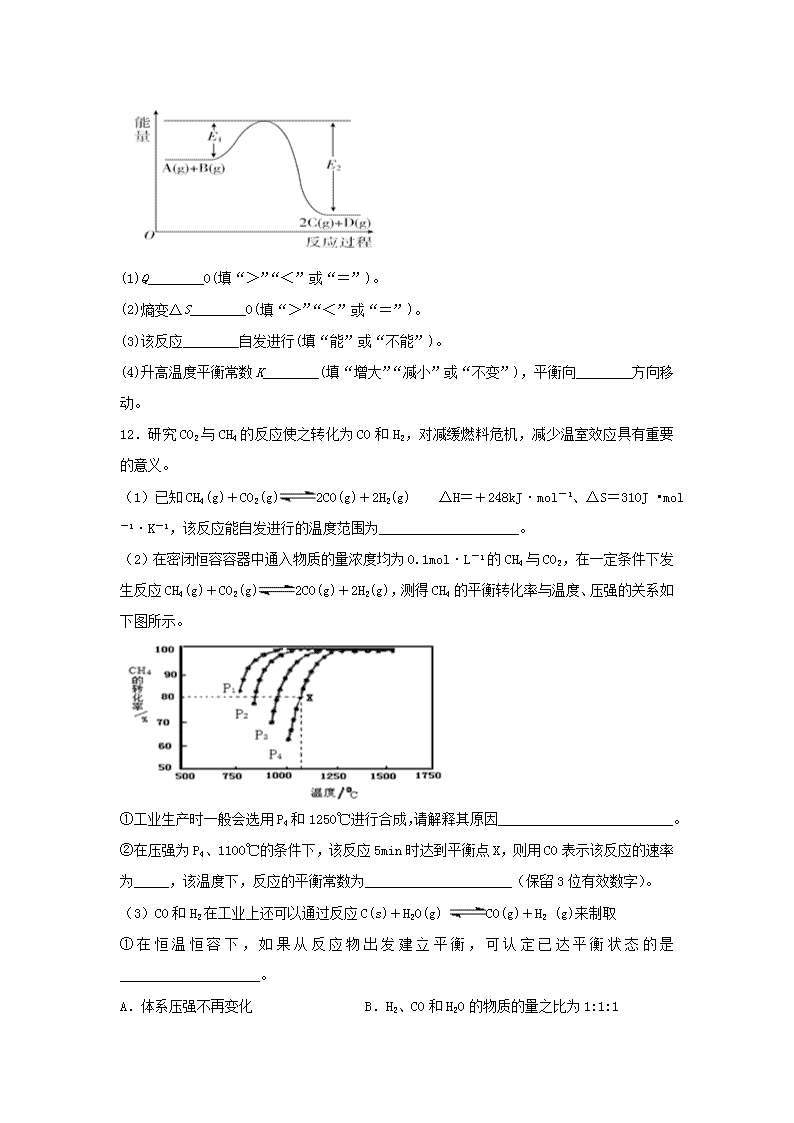
化学反应进行的方向 一、单选题 1.下列变化过程中,∆S<0的是 A. 溶解少量葡萄糖于水中 B. 氨气与氯化氢合成氯化铵 C. 氢气与氯气合成氯化氢 D. NH4HCO3(s)受热分解 2.下列说法不正确的是 A. 焓变是一个与反应能否自发进行有关的因素,多数能自发进行的反应都是放热反应 B. 熵增加有利于反应的自发进行,熵减小的反应常温下都不会自发进行 C. 在同一条件下物质有不同的熵值,其体系的混乱程度越大,熵值越大 D. 一个反应能否自发进行与焓变和熵变的共同影响有关 3.下列说法正确的是 A. 反应物的热效应与是否使用催化剂无关 B. 4NO2(g)+O2(g)=2N2O5 (g)的过程属于熵增加过程 C. 由C(石墨)= C(金刚石)△H﹥0,可知金刚石比石墨稳定 D. 对任何化学反应来说,反应速率越大,反应现象就越明显 4.下列说法正确的是 A. ΔH<0、ΔS<0的反应在低温时不能自发进行 B. 反应:CaCO3(s)=CaO(s)+CO2(g) ΔH>0,在高温时能自发进行 C. 两种物质反应,无论方程式的书写形式如何△H均不变 D. 增大反应物浓度,使活化分子百分数增加,化学反应速率增大 5.下列说法中正确的是( ) A. 非自发反应在任何条件下都不能实现 B. 自发反应一定是熵增大 C. 凡是放热反应都是自发的,吸热反应都是非自发的 D. 熵增加且放热的反应一定是自发反应 6.某反应CH3OH(l)+NH3(g) = CH3NH2(g)+H2O(g)在高温度时才能自发进行,则该反应过程的△H、△S判断正确的是( ) A. △H>0 、△S<0 B. △H<0 、△S>0 C. △H<0 、△S<0 D. △H>0 、△S>0 7.下列有关说法正确的是 A. 常见金属氧化物粉末与铝粉都能发生铝热反应 B. ΔH>0、ΔS<0 的过程也可能自发进行 C. 同位素原子之间具有相同化学性质 D. 石油分馏、煤的干馏等均属于化学变化 8.现有反应2SO3(g)2SO2(g)+O2(g) △H>0 ,下列有关说法正确的是 A. △H>0的化学反应一定不能自发进行 B. 该反应熵增大(即△S>0) C. 该反应在任何条件下一定能自发 D. 自发过程一定使体系的熵增大 9.反应“P4(s)+3NaOH(aq)+3H2O(l)=3NaH2PO2(aq)+PH3(g) ΔH>0”制得的NaH2PO2可用于化学镀镍。下列说法正确的是 A. P4分子中P原子均满足8电子稳定结构 B. 反应中NaOH作还原剂 C. 该反应能自发进行,则ΔS<0 D. 反应中生成1 mol NaH2PO2,转移电子数目为3×6.02×1023 10.下列说法不正确的是 A. 反应MgO(s)+C(s)=Mg(s)+CO(g)在室温下不能自发进行,则该反应的△H>0 B. 原电池输出电能的能力取决于组成原电池的反应物的氧化还原能力 C. 0.1 mol·L-1CH3COOH溶液加水稀释后,溶液中的值减小 D. 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 二、综合题 11.在化学反应A(g)+B(g)2C(g)+D(g) ΔH=Q kJ·mol-1 过程中的能量变化如图所示,回答下列问题。 (1)Q________0(填“>”“<”或“=”)。 (2)熵变ΔS________0(填“>”“<”或“=”)。 (3)该反应________自发进行(填“能”或“不能”)。 (4)升高温度平衡常数K________(填“增大”“减小”或“不变”),平衡向________方向移动。 12.研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。 (1)已知CH4(g)+CO2(g)2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J •mol-1·K-1,该反应能自发进行的温度范围为____________________。 (2)在密闭恒容容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。 ①工业生产时一般会选用P4和1250℃进行合成,请解释其原因_________________________。 ②在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,则用CO表示该反应的速率为_____,该温度下,反应的平衡常数为_____________________(保留3位有效数字)。 (3)CO和H2在工业上还可以通过反应C(s)+H2O(g) CO(g)+H2 (g)来制取 ①在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是____________________。 A.体系压强不再变化 B.H2、CO和H2O的物质的量之比为1:1:1 C.混合气体的密度保持不变 D.气体平均相对分子质量保持不变 ②在某体积可变的密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2molH2(g)和足量的C(s),如果此时对体系加压,平衡向___________(填“正”或“逆”)反应方向移动,达到新的平衡后,气体的平均摩尔质量为_____________________。 13.工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。 Ⅰ.脱硝: 已知:H2的燃烧热为285.8kJ·mol-1 N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ·mol-1 H2O(g)=H2O(l) ΔH=-44kJ·mol-1 催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:____________。 Ⅱ.脱碳: (1)向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下,发生反应: CO2(g)+3H2(g)CH3OH(l)+H2O(l) ①该反应自发进行的条件是_____________(填“低温”、“高温”或“任意温度”) ②下列叙述能说明此反应达到平衡状态的是____________。(填字母) a.混合气体的平均式量保持不变 b.CO2和H2的体积分数保持不变 c.CO2和H2的转化率相等 d.混合气体的密度保持不变 e.1molCO2生成的同时有3mol H—H键断裂 ③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2浓度随时间的变化。_____________ ⑵改变温度,使反应CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表: 反应时间 CO2(mol) H2(mol) CH3OH(mol) H2O(mol) 反应Ⅰ:恒温恒容 0min 2 6 0 0 10min 4.5 20min 1 30min 1 反应Ⅱ:绝热恒容 0min 0 0 2 2 ①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)______ K(II)(填“﹥”“﹤”或“=”下同);平衡时CH3OH的浓度c(I)____ c(II)。 ②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=_______ 。在其他条件不变的情况下,若30min时只改变温度T2℃,此时H2的物质的量为3.2mol,则T1___T2(填“>”、“<”或“=”)。若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡_____移动(填“正向”“逆向”或“不”)。 ⑶利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2, 装置如图所示: ①电极2的电极反应式是____________; ②在标准状况下,当电极2室有11.2L CO2反应。 理论上电极1室液体质量_____(填“增加”或“减少”______g。 14.煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下: CaSO4(s)+CO(g) CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ) CaSO4(s)+4CO(g) CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ) 请回答下列问题: (1)反应Ⅰ能自发进行的条件是 。 (2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅱ的Kp= (用表达式表示)。 (3)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 。 (4)通过监测反应体系中气体浓度的变化判断反应Ⅰ和Ⅱ是否同时发生,理由是 。 (5)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有 。 A.向该反应体系中投入石灰石 B.在合适的温度区间内控制较低的反应温度 C.提高CO的初始体积百分数 D.提高反应体系的温度 (6)恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,请在图2中画出反应体系中c(SO2)随时间t变化的总趋势图。 参考答案 1.B 2.B 3.A 4.B 5.D 6.D 7.C 8.B 9.A 10.C 11. < > 能 减小 逆反应 12. 大于800K 较大的压强和温度能加快合成速率,提高生产效率 0.032mol·L-1·min-1 1.64 ACD 逆 12 g/mol 13. 4H2(g)+2NO2(g)=N2(g)+4H2O(g) △H=-1100.2kJ·mol-1 低温 d e < < 0.025 mol·L-1 ·min-1 < 不 CO2+2H++2e-=HCOOH 减少 9 14.(1)高温 (2) (3)C. (4) 反应I中生成有SO2,监测SO2与CO2的浓度增加量的比不为1:1,可确定发生两个反应。 (5)A、B、C (6)查看更多