2020_2021学年高中化学第三章水溶液中的离子平衡2_2pH的计算课时作业含解析新人教版选修4
课时作业13 pH的计算
时间:45分钟 满分:100分
一、选择题(每小题4分,共48分)
1.pH=2的盐酸和pH=2的稀硫酸相比较,下列说法正确的是( B )
A.两溶液的物质的量浓度相同
B.两溶液的c(H+)相同
C.等体积的两溶液分别与足量的Zn反应,产生H2的量不同
D.将两溶液均稀释100倍后,pH不同
解析:两溶液均为强酸,pH相同,则c(H+)相同,但硫酸为二元酸,物质的量浓度应该是盐酸的。与Zn反应的实质是H+的反应,因c(H+)和体积均相同,产生的H2的量也应该相同。两溶液稀释100倍后,pH均变为4。
2.下列叙述中一定正确的是( C )
A.任何浓度溶液的酸碱性都可用pH试纸测定
B.某温度下,pH=6.2的纯水显酸性
C.25 ℃时,pH=1的醋酸溶液中c(H+)是pH=2的盐酸中c(H+)的10倍
D.25 ℃,pH=12的NaOH溶液中的n(OH-)=10-2 mol
解析:c(H+)>1 mol/L或c(OH-)>1 mol/L溶液的酸碱性不能使用pH试纸测定,A错误,纯水中c(H+)=c(OH-),显中性,B错误;25 ℃时,pH=1的醋酸溶液中:c(H+)CH3COOH=0.1 mol/L,pH=2的盐酸溶液中:c(H+)HCl=0.01 mol/L,==10,C正确;溶液的体积不确定,25 ℃时,pH=12的NaOH溶液中的n(OH-)无法计算,D错误。
3.4体积的pH=9的Ca(OH)2溶液与1体积的pH=13的NaOH溶液混合后,溶液中氢离子的浓度为( A )
A.5×10-13 mol·L-1
B.2×10-12 mol·L-1
C.(1×10-1+4×10-5) mol·L-1
D.(1×10-13+4×10-9)mol·L-1
解析:c(OH-)= mol·L-1≈2×10-2 mol·L-1。根据Kw,求得c(H+)=5×10-13 mol·L-1。
7
4.下列叙述正确的是( B )
A.95 ℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液稀释10倍后pH<4
C.0.2 mol·L-1的稀盐酸与等体积水混合后pH=1
D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
解析:纯水中氢离子的浓度等于氢氧根离子的浓度,纯水呈中性,A项错误;pH=3的醋酸溶液中氢离子浓度为0.001 mol·L-1,稀释10倍后醋酸的电离程度增大,氢离子浓度大于0.000 1 mol·L-1,故溶液的pH小于4,B项正确;0.2 mol·L-1的稀盐酸,与等体积水混合后,由于溶液的体积小于原来的2倍,溶液中氢离子的浓度大于0.1 mol·L-1,所以溶液的pH不等于1,C项错误;pH=3的醋酸溶液,氢离子浓度为0.001 mol·L-1,醋酸溶液的物质的量浓度远远大于0.001 mol·L-1,而pH=11的氢氧化钠溶液中氢氧根离子的浓度为0.001 mol·L-1,等体积混合后醋酸过量,溶液显酸性,pH<7,D项错误。
5.已知在100 ℃时水的离子积Kw=1×10-12,下列溶液的温度均为100 ℃。其中说法正确的是( A )
A.0.005 mol·L-1的H2SO4溶液,pH=2
B.0.001 mol·L-1的NaOH溶液,pH=11
C.0.005 mol·L-1的H2SO4溶液与0.01 mol·L-1的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性
D.完全中和pH=3的H2SO4溶液50 mL,需要pH=9的NaOH溶液100 mL
解析:A项,0.005 mol·L-1的H2SO4溶液中,c(H+)=0.005 mol·L-1×2=0.01 mol·L-1,pH=-lgc(H+)=-lg0.01=2。此计算与Kw值无关,不要受Kw=1×10-12的干扰。B项,0.001 mol·L-1的NaOH溶液中,c(OH-)=0.001 mol·L-1,c(H+)== mol·L-1=1×10-9 mol·L-1,pH=-lg(1×10-9)=9。C项,0.005 mol·L-1的H2SO4溶液与0.01 mol·L-1的NaOH溶液等体积混合,溶液呈中性,pH=6。D项,pH=3的H2SO4溶液c(H+)=10-3 mol·L-1,pH=9的NaOH溶液,c(OH-)=10-3 mol·L-1,二者完全中和,需要溶液的体积相等。
6.常温下,关于溶液的稀释下列说法正确的是( C )
A.pH=3的醋酸溶液稀释100倍,pH=5
B.pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1×10-6 mol·L-1
C.将1 L 0.1 mol·L-1的Ba(OH)2溶液稀释为2 L,pH=13
D.pH=8的NaOH溶液稀释100倍,其pH=6
解析:将1 L 0.1 mol·L-1的Ba(OH)2溶液加水稀释为2 L,溶液中c(OH-)=
7
=0.1 mol·L-1,则c(H+)=10-13 mol·L-1,所以pH=13,故C正确。
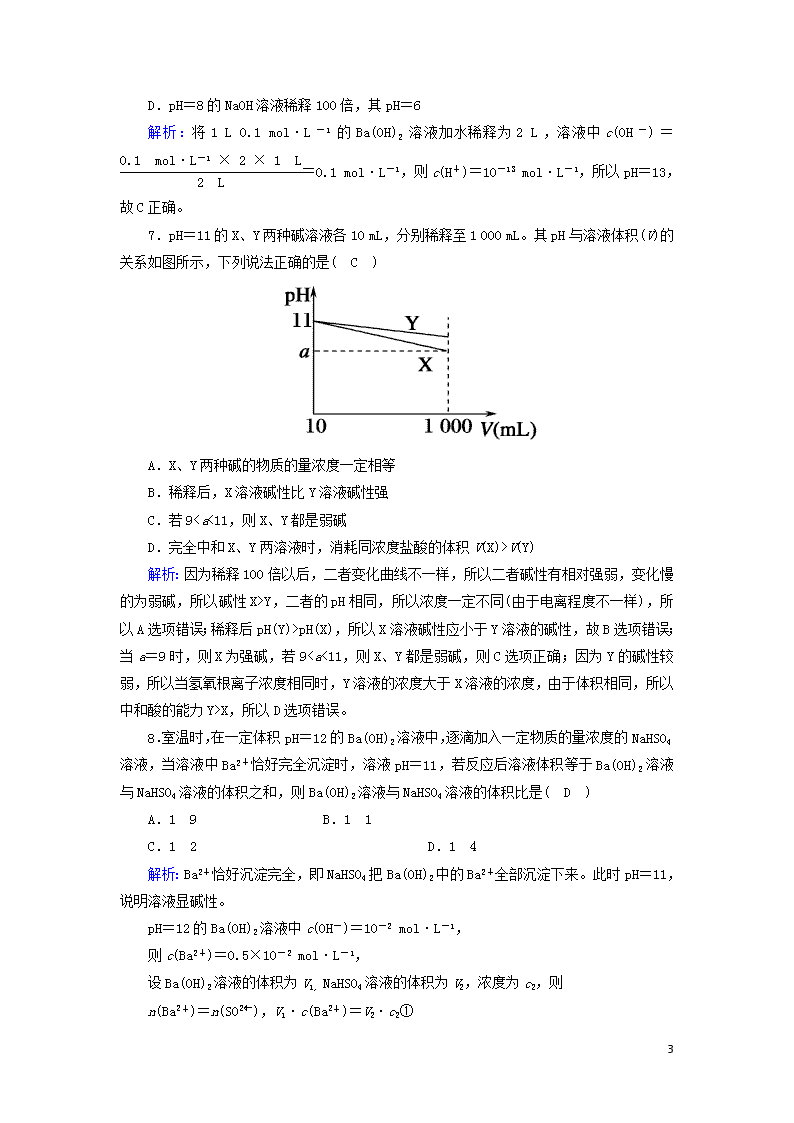
7.pH=11的X、Y两种碱溶液各10 mL,分别稀释至1 000 mL。其pH与溶液体积(V)的关系如图所示,下列说法正确的是( C )
A.X、Y两种碱的物质的量浓度一定相等
B.稀释后,X溶液碱性比Y溶液碱性强
C.若9
V(Y)
解析:因为稀释100倍以后,二者变化曲线不一样,所以二者碱性有相对强弱,变化慢的为弱碱,所以碱性X>Y,二者的pH相同,所以浓度一定不同(由于电离程度不一样),所以A选项错误;稀释后pH(Y)>pH(X),所以X溶液碱性应小于Y溶液的碱性,故B选项错误;当a=9时,则X为强碱,若9X,所以D选项错误。
8.室温时,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中Ba2+恰好完全沉淀时,溶液pH=11,若反应后溶液体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是( D )
A.19 B.11
C.12 D.14
解析:Ba2+恰好沉淀完全,即NaHSO4把Ba(OH)2中的Ba2+全部沉淀下来。此时pH=11,说明溶液显碱性。
pH=12的Ba(OH)2溶液中c(OH-)=10-2 mol·L-1,
则c(Ba2+)=0.5×10-2 mol·L-1,
设Ba(OH)2溶液的体积为V1, NaHSO4溶液的体积为V2,浓度为c2,则
n(Ba2+)=n(SO),V1·c(Ba2+)=V2·c2①
=10-3②
7
①②联立得:V1V2=14。
9.在常温下,下列各组溶液的c(H+)一定等于1×10-7 mol/L的是( B )
A.pH=2和pH=12的两种溶液以等体积混合
B.0.05 mol/L H2SO4与0.10 mol/L NaOH溶液以等体积混合
C.将pH=5的CH3COOH溶液稀释100倍
D.pH=1的H2SO4与0.10 mol/L Ba(OH)2溶液以等体积混合
解析:A中pH=2的强酸与pH=12的强碱以等体积混合时,酸提供的H+的物质的量(10-2V mol)等于碱提供的OH-的物质的量[(10-14/10-12)V mol]。pH=2的弱酸与pH=12的强碱以等体积混合,酸的浓度必很大,反应中酸过量,最后溶液呈酸性。B项是强碱和强酸,如两溶液体积各V L,则n(H+)=0.05 mol/L×2×V L,n(OH-)=0.10 mol/L×V L。C中pH=5的弱酸,稀释100倍,由于在稀释过程中,电离程度增大,c(H+)下降不到1/100。
10.对于常温下,pH为1的硝酸溶液,下列叙述正确的是( B )
A.该溶液1 mL稀释至100 mL后,pH小于3
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)的比值为10-12
D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍
解析:强酸溶液稀释100倍后pH增大2个单位,A项错误。B项,pH(强酸)+pH(强碱)=14,等体积混合时完全中和,正确。pH为1的硝酸中水电离出的c(H+)为10-13 mol·L-1,C项中两者之比为=1012,不正确。pH为3的硝酸中水电离出的c(H+)为10-11 mol·L-1,=10-2,D项错误。
11.在常温下,某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合后pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系为( B )
A.V(酸)=102V(碱) B.V(碱)=102V(酸)
C.V(酸)=2V(碱) D.V(碱)=2V(酸)
解析:强酸中:c(H+)=10-amol/L;强碱中:c(OH-)==10-14+b(mol/L)=10-14+12-a(mol/L)=10-2-a(mol/L)。混合后pH=7,即n(H+)=n(OH-),故V(碱)=102V(酸)。
12.室温时,下列溶液混合后,pH大于7的是( C )
A.0.1 mol·L-1的盐酸和pH=13的氢氧化钡溶液等体积混合
B.0.1 mol·L-1的NaHCO3溶液和pH=1的盐酸等体积混合
C.pH=3的硫酸和pH=11的氨水等体积混合
D.pH=1的醋酸和0.1 mol·L-1的氢氧化钠溶液等体积混合
解析:A项,0.1 mol·L-1的盐酸pH=1与pH=13的Ba(OH)2
7
等体积混合时,二者恰好完全反应,溶液呈中性,pH=7,错误;B项,NaHCO3与盐酸等物质的量混合生成NaCl、H2O和CO2,能得到碳酸,溶液pH<7,错误;C项,pH=3的H2SO4与pH=11的氨水的pH之和为14,二者等体积混合后溶液呈碱性,pH>7,正确;0.1 mol·L-1 NaOH溶液pH=13,pH=1的醋酸和pH=13的NaOH溶液的pH之和为14,二者等体积混合后溶液呈酸性,pH<7,错误。
二、非选择题(52分)
13.(13分)(1)在温度t ℃时,某溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则t大于25 ℃(填“大于”“小于”或“等于”)。
(2)常温下,向某Ba(OH)2溶液中逐滴加入pH=x的盐酸,测得混合溶液的部分pH如下表所示:
序号
氢氧化钡
溶液的体积/mL
盐酸的
体积/mL
溶液的pH
①
22.00
0.00
12
②
22.00
18.00
11
③
22.00
22.00
7
x=2。Ba(OH)2溶液的物质的量浓度为5×10-3_mol·L-1。
(3)常温下,向100 mL pH=2的硫酸与硫酸钠的混合溶液中,加入300 mL上述Ba(OH)2溶液,沉淀正好达最大量,此时溶液的pH大于7(填“大于”“小于”或“等于”);原混合溶液中硫酸钠的物质的量浓度为0.01_mol·L-1。
解析:(1)由于a+b=12<14,所以该温度大于25 ℃。
(2)根据①得Ba(OH)2溶液中c(OH-)=10-2mol·L-1,所以根据③得c(HCl)=10-2 mol·L-1,所以x=2,c[Ba(OH)2]==5×10-3 mol·L-1。(3)n(OH-)=0.3 L×10-2 mol·L-1=3×10-3 mol,而n(H+)=10-3 mol,所以OH-剩余,pH大于7,
n(H2SO4)==5×10-4 mol。
n(Na2SO4)=0.3 L×5×10-3 mol·L-1-5×10-4 mol=10-3 mol,c(Na2SO4)==0.01 mol·L-1。
14.(13分)下表是不同温度下水的离子积数据:
温度/℃
25
t1
t2
水的离子积Kw
1×10-14
a
1×10-12
试回答以下问题:
(1)若251×10-14(填“>”“<”或“=”),作此判断的理由是水的电离为吸热过程,温度升高,水的电离程度变大,离子积增大。
7
(2)25 ℃下,某Na2SO4溶液中c(SO)=5×10-4 mol·L-1,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)c(OH-)=1 0001。
(3)在t2 ℃下pH=10的NaOH溶液中,水电离产生的OH-浓度为1×10-10_mol·L-1。
(4)t2 ℃下,将pH=11的NaOH溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1V2=911。
解析:(1)升温,Kw变大。
(2)c(SO)=5×10-4 mol·L-1,则c(Na+)=2c(SO)=1×10-3 mol·L-1,稀释10倍,则c(Na+)=1×10-4 mol·L-1。25 ℃时Na2SO4溶液中c(OH-)=1×10-7mol·L-1,稀释10倍后仍然为1×10-7 mol·L-1,则c(Na+)c(OH-)=1031。
(3)pH=10的NaOH溶液中c(H+)=10-10 mol·L-1,NaOH溶液中c(H+)来自水的电离,水电离出H+的同时也电离出等量的OH-。
(4)t2 ℃时,pH=2,说明溶液为酸性,酸过量。
t2 ℃时,pH=11的NaOH溶液,c(OH-)=0.1 mol·L-1,
=0.01 mol·L-1, 9V2=11V1,=。
15.(14分)温度t ℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,请回答下列问题:
(1)该温度下水的离子积常数Kw=10-12。
(2)该NaOH溶液中NaOH的物质的量浓度为10-b_mol·L-1,该NaOH溶液中由水电离出的c(OH-)为10-a_mol·L-1。
(3)给该NaOH溶液加热,pH变小(填“变大”“变小”或“不变”)。
(4)该温度下若a=8,要中和该NaOH溶液500 mL,需pH=2的盐酸溶液的体积为5_mL。
解析:(1)Kw=c(H+)·c(OH-)=10-a·10-b=10-(a+b)=10-12。
(2)c(NaOH)=c(OH-)=10-b mol·L-1;该溶液中c(H+)=10-a mol·L-1,NaOH溶液中H+全是水电离的,c(OH-)水电离=c(H+)水电离=c(H+)=10-a mol·L-1。
(3)温度升高时,Kw变大,而c(H+)=,所以c(H+)变大,pH变小。
(4)a=8时,NaOH溶液中c(H+)=10-8 mol·L-1,c(OH-)= mol·L-1=10-4 mol·L-1,设需pH=2即c(H+)=10-2 mol·L-1的盐酸体积为V,则10-4mol·L-1×0.5 L=10-2 mol·L-1·V,得V=5×10-3 L=5 mL。
16.(12分)已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示:
7
(1)则95 ℃时水的电离平衡曲线应为B(填“A”或“B”),请说明理由水的电离是吸热过程,温度升高时,电离程度增大,c(H+)、c(OH-)都增大。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为101。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是a+b=14或pH1+pH2=14。
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析原因:曲线B对应95_℃,此时水的离子积为10-12,HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5。
解析:本题的解题关键是搞清楚温度对水的电离平衡、水的离子积和溶液pH的影响。
(1)当温度升高时,促进水的电离,水的离子积也增大,水中氢离子浓度、氢氧根离子浓度都增大,水的pH减小,但溶液仍然呈中性。因此结合图像中A、B曲线变化情况及氢离子浓度、氢氧根离子浓度可以判断95 ℃时水的电离平衡曲线应为B,理由为水的电离是吸热过程,升高温度,水的电离程度增大,c(H+)、c(OH-)增大。
(2)25 ℃时所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)×10-5mol·L-1=V(H2SO4)×10-4mol·L-1,得V(NaOH)V(H2SO4)=101。
(3)要注意95 ℃时,水的离子积为10-12,即c(H+)·c(OH-)=10-12,则等体积强酸强碱反应至中性时pH酸+pH碱=12。根据95 ℃时混合后溶液呈中性,由100×10-a=1×10b-12,即:10-a+2=10b-12,得以下关系:a+b=14或pH1+pH2=14。
(4)在曲线B对应温度下,因pH酸+pH碱=2+10=12,可得酸碱两溶液中c(H+)=c(OH-),如是强酸、强碱,两溶液等体积混合后溶液应呈中性;现混合溶液的pH=5,即等体积混合后溶液显酸性,说明H+与OH-完全反应后又有新的H+产生,即酸过量,所以说酸HA是弱酸。
7