- 2021-07-08 发布 |
- 37.5 KB |
- 25页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
浙江版2021高考化学一轮复习专题十从海水中获得的化学物质课件
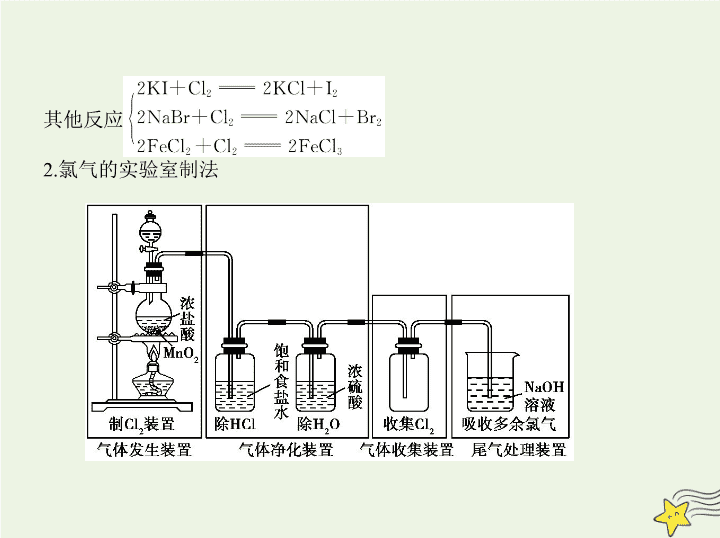
考点清单 考点一 氯、溴、碘及其化合物 考点基础 一、氯及其重要化合物 1.氯元素的位、构、性 (1)氯元素位于元素周期表中① 第3 周期② 第ⅦA 族,氯原子的结 构示意图为 ,氯原子容易得到一个电子而形成Cl - (结构示意图 为 ),因此,氯元素具有较强的③ 非金属 性。 a.物理性质:在通常情况下呈④ 黄绿 色,是有 刺激性 气味的气体,密度比 空气大,能溶于水。在25 ℃时,1体积的水可溶解约2体积的氯气,氯气的水 溶液称为氯水。 b.毒性:有毒,对人体有强烈的刺激性,吸入较多的氯气会使人死亡。 c.化学性质: 跟金属反应 跟非金属反应 跟水反应:Cl 2 +H 2 O HCl+HClO 跟碱反应 其他反应 2.氯气的实验室制法 3.Cl - 的检验 检验溶液中是否含有Cl - 时,应先加少量⑦ 稀硝酸 酸化,再加入⑧ 硝 酸银 溶液,若有⑨ 白色沉淀 产生,证明有Cl - 存在。 二、卤素单质的相似性和特殊性 1.相似性 a.都能与大多数金属反应:2Fe+3X 2 2FeX 3 (I 2 除外); b.都能与H 2 反应生成HX; c.都能与H 2 O反应:X 2 +H 2 O HX+HXO(F 2 、I 2 除外); d.都能与碱溶液反应:X 2 +2NaOH NaX+NaXO+H 2 O(F 2 、I 2 除外)。 2.特殊性 (1)Br 2 、I 2 的物理性质 Br 2 : 深红棕色液体 ,是常温下唯一呈液态的非金属单质;液溴易挥发且有毒, 通常用水液封保存。 I 2 : 紫黑色固体 ,易升华,淀粉遇I 2 显蓝色。 Br 2 和I 2 都可被某些有机溶剂(如四氯化碳)萃取。 (2)Cl 2 、Br 2 、I 2 之间的置换反应 氧化性:Cl 2 >Br 2 >I 2 Cl 2 +2KBr 2KCl+Br 2 Cl 2 +2KI 2KCl+I 2 Br 2 +2KI 2KBr+I 2 3.溴、碘的提取 (1)溴的提取 从海水中提取溴,通常是将 氯气 通入提取粗食盐后的母液中,将溶 液中的 溴离子 氧化成 溴单质 。生成的 溴单质 仍然溶 解在水中,鼓入 热空气或水蒸气 使溴从溶液中挥发出来,冷凝后得到粗溴,精制粗溴可得到高纯度的溴单质。 (2)碘的提取 虽然海水中碘的总蕴藏量很大,但由于其浓度很低,故目前工业生产中碘的 获得并不是直接从海水中提取。因为海洋中的某些植物具有富集碘的能 力,如海带等,所以从海带等海产品中提取碘是工业上获取碘的重要途径。 从海带中提取碘的流程图如下: 4.Br - 、I - 的检验方法 (1)AgNO 3 溶液——沉淀法 未知液 (2)置换——萃取法 未知液 有机层呈 (3)氧化——淀粉法检验I - 未知液 蓝色溶液,表明有I - 常用的氧化剂有Cl 2 、H 2 O 2 、MnO 2 ,反应的离子方程式如下: Cl 2 +2I - 2Cl - +I 2 H 2 O 2 +2I - +2H + I 2 +2H 2 O MnO 2 +2I - +4H + I 2 +Mn 2+ +2H 2 O 重点突破 Cl 2 +H 2 O H + +Cl - +HClO平衡移动的应用 浓度变化 平衡移动的方向 应用 加入可溶 性氯化物 c (Cl - )增大 左移 ①用饱和食盐水除Cl 2 中的HCl;②用排饱和食 盐水法收集Cl 2 加入盐酸 c (H + )和 c (Cl - )增大 左移 次氯酸盐与浓盐酸反 应制Cl 2 加入NaOH c (H + )减小 右移 用NaOH溶液吸收多余 Cl 2 加入Ca(OH) 2 c (H + )减小 右移 制漂白粉 加入CaCO 3 c (H + )减小 右移 制高浓度的HClO溶液 光照 c (HClO)减小 右移 氯水避光保存或现用 现配 续表 浓度变化 平衡移动的方向 应用 考点二 钠、镁及其化合物 考点基础 一、钠及其重要化合物 1.钠的性质、制备、保存及应用 物理 性质 钠是一种质软、① 银白 色、有金属光泽的 金属,具有良好的② 导电 性、③ 导热 性, 密度比水④ 小 ,比煤油⑤ 大 ,熔点较低 化学 性质 (1)与非金属反应:2Na+Cl 2 2NaCl,2Na+S Na 2 S,4Na+O 2 2Na 2 O,2Na+O 2 Na 2 O 2 (2)与水反应:⑥ 2Na+2H 2 O 2NaOH+H 2 ↑ (3)与酸反应:2Na+2H + ⑦ 2Na + +H 2 ↑ (4)与盐溶液反应: a.钠投入到NaCl稀溶液中,只有H 2 产生,离子方程 式为 ⑧ 2Na+2H 2 O 2Na + +2OH - +H 2 ↑ b.钠投入到饱和NaCl溶液中,有H 2 产生,同时有 NaCl晶体析出(温度不变) c.钠投入到NH 4 Cl溶液中,有H 2 和NH 3 逸出 d.钠投入到CuSO 4 溶液中,有气体和蓝色沉淀生 成:2Na+2H 2 O+CuSO 4 ⑨ Cu(OH) 2 ↓+Na 2 SO 4 +H 2 ↑ 续表 制备 2NaCl(熔融) 2Na+Cl 2 ↑ 保存 由于金属钠的化学性质非常活泼,易与空气中的 O 2 和H 2 O等反应,所以金属钠要保存在 煤油 中 用途 工业上用钠作强还原剂,用于冶炼金属,如:4Na+ TiCl 4 (熔融) ⑩ Ti+4NaCl ;Na-K 合金(液态)用于快中子反应堆作 导热剂 ; 在电光源上,用钠制 高压钠灯 续表 2.钠的重要化合物的性质及应用 (1)氧化钠和过氧化钠的比较 氧化钠(Na 2 O) 过氧化钠(Na 2 O 2 ) 颜色状态 白色 固体 淡黄色 固体 类别 碱性氧化物 过氧化物 氧元素化合价 -2 -1 化学键类型 离子键 离子键和共价键 电子式 与水反应 Na 2 O+H 2 O 2NaOH 2Na 2 O 2 +2H 2 O 4NaOH+O 2 ↑ 与CO 2 反应 Na 2 O+CO 2 Na 2 CO 3 2Na 2 O 2 +2CO 2 2Na 2 CO 3 +O 2 与盐酸反应 Na 2 O+2HCl 2NaCl+H 2 O 2Na 2 O 2 +4HCl 4NaCl+2H 2 O +O 2 ↑ 主要用途 可制烧碱 漂白剂、消毒剂、供氧剂 保存 密封 密封、远离易燃物 续表 氧化钠(Na 2 O) 过氧化钠(Na 2 O 2 ) (2)碳酸钠和碳酸氢钠的比较 碳酸钠(Na 2 CO 3 ) 碳酸氢钠 (NaHCO 3 ) 俗名 纯碱或苏打 小苏打 颜色及状态 白色晶体 细小白色晶体 水溶性 易溶于水,溶液呈 碱性 溶于水,相同温度 下比Na 2 CO 3 溶解 度 小 ,溶液 呈碱性 稳定性 稳定,但结晶碳酸 钠(Na 2 CO 3 ·10H 2 O) 易风化 不稳定,受热易分 解:2NaHCO 3 Na 2 CO 3 +CO 2 ↑+H 2 O 与H + 反应 C +2H + H 2 O+CO 2 ↑ HC +H + H 2 O+CO 2 ↑ 与碱反应 [Ca(OH) 2 ] Ca 2+ +C CaCO 3 ↓ Ca 2+ +OH - +HC CaCO 3 ↓+ H 2 O (碱过量) Ca 2+ +2OH - +2HC CaCO 3 ↓+C +2H 2 O (碱不足) CaCl 2 Ca 2+ +C CaCO 3 ↓ 不反应 硫酸铝 2Al 3+ +3C +3H 2 O 2Al(OH) 3 ↓+ 3CO 2 ↑ 3HC +Al 3+ Al(OH) 3 ↓+3CO 2 ↑ 续表 碳酸钠(Na 2 CO 3 ) 碳酸氢钠(NaHCO 3 ) 主要用途 玻璃、造纸、制 皂、洗涤 发酵、医药、灭 火器 相互转化 Na 2 CO 3 NaHCO 3 续表 碳酸钠(Na 2 CO 3 ) 碳酸氢钠 (NaHCO 3 ) 3.焰色反应 (1)概念 许多金属或它们的化合物在火焰上灼烧时使火焰呈现特殊的颜色,这叫作 焰色反应。 (2)实验步骤 a.点燃酒精灯(一点)。 b.铂丝(或细铁丝)放入稀盐酸中清洗,再放到火焰上灼烧,直至火焰呈现原 来的颜色(二洗烧)。 c.用铂丝(或细铁丝)蘸取固体或液体待测物,灼烧、观察[若是钾元素,应透 过蓝色的钴玻璃(可滤去遮盖紫色的黄光)观察](三蘸烧)。 d.铂丝(或细铁丝)用稀盐酸洗净,放在火焰上烧至原色,放回原处(四洗 烧)。 (3)注意事项 a.焰色反应不是 化学 变化,而是一种 物理 变化,主要用于钠、 钾等碱金属和碱土金属及其离子的检验。焰色反应是元素的性质,不因元 素存在形式的改变而改变。 b.用稀盐酸的原因:生成金属氯化物,而金属氯化物在高温时可挥发。 c.焰色反应中所用的火焰部分应是无色或浅色的。 d.灼烧铂丝(或细铁丝)时应一直烧至火焰恢复到原来火焰的无色或浅色。 二、镁及其重要化合物 1.镁的提取 2.镁的性质:镁的化学性质活泼,具有较强的 还原性 。 (1)与非金属单质化合 a.与O 2 反应:常温下表面形成 氧化膜 ,具有抗腐蚀性;点燃时与O 2 剧烈反应, 化学方程式为 2Mg+O 2 2MgO 。 b.与N 2 反应:化学方程式为 3Mg+N 2 Mg 3 N 2 。 (2)在CO 2 气体中剧烈燃烧,反应的化学方程式为 2Mg+CO 2 2MgO+C 。 (3)与稀盐酸、稀硫酸反应,离子方程式为 Mg+2H + Mg 2+ +H 2 ↑ 。 3.镁的重要化合物 MgO是一种白色粉末,属 碱性 氧化物,它能与水 缓慢 反应生 成Mg(OH) 2 。MgO具有很高的熔点,可作 耐火 材料。MgCl 2 是一种 无色、苦味、易溶于水的固体, 易 潮解,可作 干燥 剂。工业 上用电解 熔融的MgCl 2 的方法制取金属镁。 重点突破 1.钠与滴有酚酞溶液的水反应的现象及解释 2.Na 2 CO 3 、NaHCO 3 的鉴别方法 方法 对氯水性质多样性的分析 1.反应原理及成分 Cl 2 +H 2 O H + +Cl - +HClO HClO H + +ClO - 2HClO 2HCl+O 2 ↑ 新制氯水中存在的分子有Cl 2 、H 2 O、HClO,离子有H + 、Cl - 、ClO - 、OH - 。 2.氯水的性质 氯水在与不同物质发生反应时,表现出成分的复杂性和性质的多样性。 方法技巧查看更多