2020高考化学冲刺核心素养微专题5化学反应速率和平衡图象的分析练习含解析
高考化学总复习
化学反应速率和平衡图象的分析
1.化学反应速率平衡图象的基本类型
(1)速率-时间图象
此类图象定性揭示了v(正)、v(逆)随时间(含条件改变对化学反应速率的影响)变化规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动方向等。反应N2(g)+3H2(g)2NH3(g) ΔH<0的速率如图所示。
(2)浓度-时间图象(c-t图象)
此类图象能说明各平衡体系组分(或某一成分)的物质的量浓度在反应过程中的变化情况。此类图象中各物质曲线的折点(达平衡)时刻相同,各物质浓度变化的内在联系及比例符合化学方程式中的化学计量数关系。如图所示:
(3)速率—条件图象(v -T或v -p图象)
正、逆反应速率随温度或压强的变化曲线,增大、减小方向一致,但倍数不同。用于判断反应的ΔH或气体体积关系。如图所示:
12
高考化学总复习
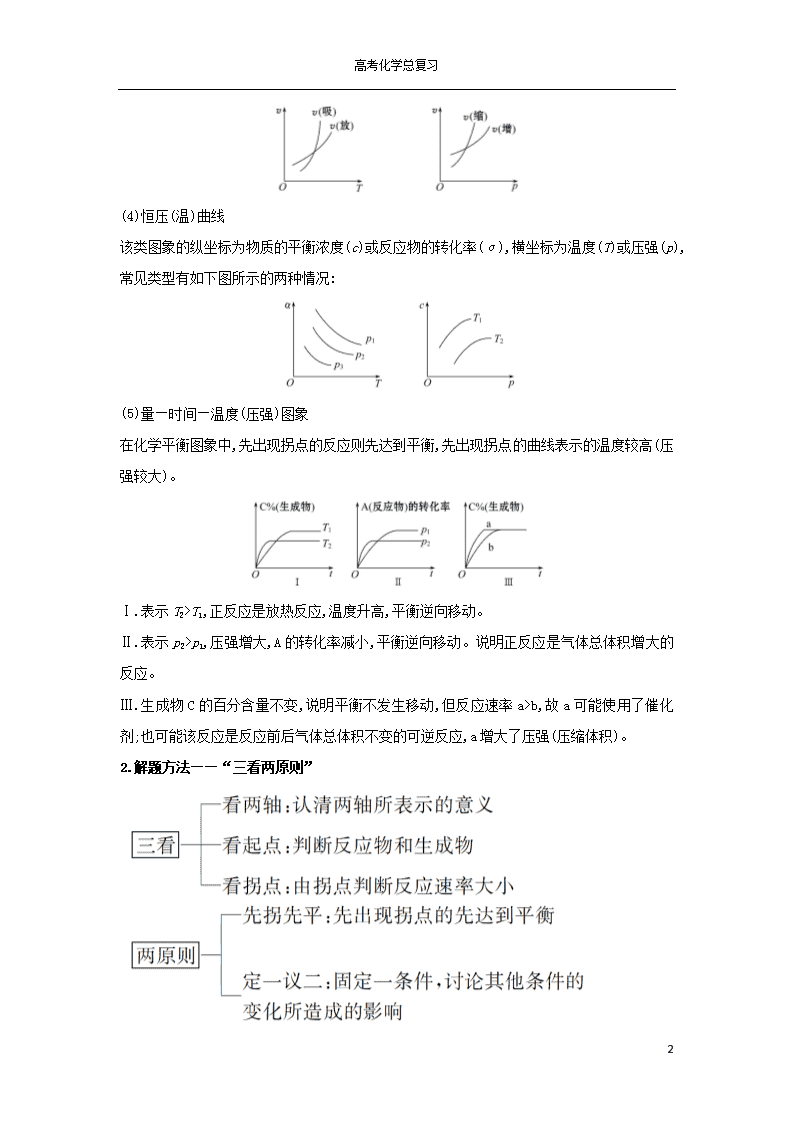
(4)恒压(温)曲线
该类图象的纵坐标为物质的平衡浓度(c)或反应物的转化率(α),横坐标为温度(T)或压强(p),常见类型有如下图所示的两种情况:
(5)量—时间—温度(压强)图象
在化学平衡图象中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(压强较大)。
Ⅰ.表示T2>T1,正反应是放热反应,温度升高,平衡逆向移动。
Ⅱ.表示p2>p1,压强增大,A的转化率减小,平衡逆向移动。说明正反应是气体总体积增大的反应。
Ⅲ.生成物C的百分含量不变,说明平衡不发生移动,但反应速率a>b,故a可能使用了催化剂;也可能该反应是反应前后气体总体积不变的可逆反应,a增大了压强(压缩体积)。
2.解题方法——“三看两原则”
12
高考化学总复习
3.思维建模——解题四步骤
【典例】(2019·全国卷Ⅱ改编)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是 ( )
12
高考化学总复习
①T1>T2
②a点的反应速率小于c点的反应速率
③a点的正反应速率大于b点的逆反应速率
④b点时二聚体的浓度为0.45 mol·L-1
A.①② B.②④ C.①③ D.③④
【思维建模】解答速率平衡图象的思维流程一般为
【解析】选D。由图知虚线对应的速率快,对应温度高,则T2>T1,①错误;由T2(c点)>T1(a点),但环戊二烯的浓度a点大于c点,则a点、c点的速率大小无法确定,②错误;a点、b点的温度相同,环戊二烯的浓度a点大于b点,则a点的正反应速率大于b点的正反应速率,b点没有达到平衡状态,则b点的正反应速率大于b点的逆反应速率,③正确;b点时环戊二烯的浓度减少0.9 mol·L-1,则b点时二聚体的浓度为0.45 mol·L-1,④正确。
1.以CO2和NH3为原料可合成尿素,反应为2NH3(g)+CO2(g)
CO(NH2)2(s)+H2O(g)。达到平衡时,NH3的转化率α
12
高考化学总复习
随温度变化的情况如下图。下列说法不正确的是 ( )
A.该反应的ΔH<0
B.若y为压强,则y1>y2
C.若y表示反应起始时的水碳比,则y1>y2
D.在恒温恒容(2L)的容器和绝热恒容(2L)容器中,分别加入2mol NH3(g)和1mol CO2(g),达到平衡时,恒温恒容体系中氨气的转化率大于绝热恒容体系中氨气的转化率
【解析】选C。由图象可知,氨气的转化率随温度的升高而降低,因此,该反应是放热反应,A项正确;正反应方向为压强减小的变化,因此压强越大,平衡越正向移动,氨气的转化率越高,所以y1>y2,B项正确;起始时的水碳比越小,代表起始时CO2越多,则氨气的转化率越高,因此y1
7,+2价铁更难被氧化
C.由①、③推测,FeCl2被O2氧化的反应为放热反应
D.60 ℃、pH=2.5时, 4 h内Fe2+的平均消耗速率大于 0.15a mol·L-1·h-1
【解析】选D。由②、③可知, pH越小,+2价铁氧化速率越快,故A错误;若pH>7,FeCl2变成Fe(OH)2,Fe(OH)2非常容易被氧化成Fe(OH)3,故B错误;由①、③推测,升高温度,相同时间内
12
高考化学总复习
+2价铁的氧化率增大,升高温度+2价铁的氧化速率加快,由图中数据不能判断反应的热效应,故C错误;50 ℃、pH=2.5时,4 h内Fe2+的氧化率是60%,即消耗0.6a mol·L-1,4 h内平均消耗速率等于0.15a mol·L-1·h-1,温度升高到60 ℃、pH=2.5时,+2价铁的氧化率速率加快,4 h内Fe2+的平均消耗速率大于 0.15a mol·L-1·h-1。
3.已知可逆反应X(g)+2Y(g)Z(g) ΔH<0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列表述正确的是 ( )
A.达到平衡时,X、Y、Z物质的量之比为1∶2∶1
B.a点正反应速率大于逆反应速率
C.反应达平衡时,降低温度可以实现c到d的转化
D.该条件下,反应达平衡时,X平衡转化率为25%
【解析】选B。分析图象和题给信息可知,起始加入X的物质的量为1 mol·L-1×
2 L=2 mol,起始加入2 mol X、4 mol Y,达到平衡时X的浓度为0.25 mol·L-1,物质的量为0.25 mol·L-1×2 L=0.5 mol,消耗X物质的量2-0.5 mol=1.5 mol,结合化学方程式计算得到消耗Y物质的量为3 mol,生成Z物质的量为1.5 mol,则达到平衡时,X、Y、Z物质的量之比=0.5 mol∶(4 mol-3 mol)∶1.5 mol=1∶2∶3,故A错误;由图象可知,a点尚未达到平衡状态,此时正反应速率大于逆反应速率,故B正确;该反应的ΔH<0,为放热反应,降低温度,平衡正向移动,X的浓度减小,不能实现c到d的转化,故C错误;
利用三段式计算: X(g)+2Y(g)Z(g)
起始浓度(mol·L-1) 1 2 0
转化浓度(mol·L-1) 0.75 1.5 0.75
平衡浓度(mol·L-1) 0.25 0.5 0.75
X平衡转化率为75%,故D错误。
4.有Ⅰ~Ⅳ四个体积均为0.5 L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应4HCl(g)+O2(g)2Cl2(g)
+2H2O(g) ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是
12
高考化学总复习
( )
容器
起始时
t/℃
n(HCl)/mol
Z
Ⅰ
300
0.25
a
Ⅱ
300
0.25
b
Ⅲ
300
0.25
4
A.ΔH>0,a<4v(逆),压强:p(R)>p(Q)
D.若起始时,在容器Ⅳ中充入0.25 mol Cl2和0.25 mol H2O(g),300 ℃达平衡时容器中c(HCl)=0.1 mol·L-1
【解析】选C。图象中HCl转化率随温度升高而减小,说明升温平衡逆向移动,正反应为放热反应,ΔH<0,增大氧气的物质的量,可促进HCl的转化,即投料比越小,HCl转化率越大,可知a<4v(逆),此时压强大于平衡状态下的压强:
12
高考化学总复习
p(R)>p(Q),故C正确;若起始时,在0.5 L容器Ⅳ中只充入0.25 mol Cl2和
0.25 mol H2O(g),等效于在0.5 L容器中充入0.5 mol HCl和0.125 mol O2,充入的HCl和O2物质的量为容器Ⅲ的两倍,相当于在容器Ⅲ的基础上增大压强,将体积缩小为原来的,增大压强平衡正向移动,300 ℃达到平衡时0.1 mol·L-1
p2,则在较低温度下有利于该反应自发进行
B.图乙中,若T2>T1,则ΔH<0且a+b=c+d
C.图丙中,t1时刻改变的条件一定是使用了催化剂
D.图丁中,若ΔH<0,则纵坐标不可能表示的是反应物的转化率
【解析】选C。图甲中压强一定时,温度越高,平衡体系中A%越大,说明升高温度,平衡逆向移动,则有ΔH<0;若p1>p2,温度一定时,压强越大,平衡体系中A%越小,则有a+b>c+d,ΔS<0;若使ΔH-TΔS<0,则在较低温度下有利于该反应自发进行,A正确。图乙中温度一定时,增大压强,A的平衡转化率不变,则有a+b=c+d;压强一定时,若T2>T1,温度越高,A的平衡转化率越小,说明升高温度,平衡逆向移动,则有ΔH<0,B正确。图丙中t1时刻,改变条件后v(正)、v(逆)同等程度地改变,平衡不移动,则改变的条件可能是使用了催化剂,若a+b=c+d改变的条件也可能是增大了压强,C错误。图丁中温度为T1时先达到平衡状态,则温度:T1>T2,若
12
高考化学总复习
ΔH<0,升高温度,平衡逆向移动,反应物的转化率降低,故纵坐标不可能表示的是反应物的转化率,D正确。
2.合成乙烯的主要反应:6H2(g)+2CO2(g)CH2CH2(g)+4H2O(g) ΔH<0。图中L(L1、L2)、x可分别代表压强或温度。下列说法正确的是 ( )
A.L1L2,选项A错误;x代表温度,选项B错误;M、N对应温度不同,所以两点对应的平衡常数不相同,选项C错误;温度越高反应速率越快,所以M点的正反应速率v(正)小于N点的逆反应速率v(逆),选项D正确。
3.工业上常用如下反应消除氮氧化物的污染:
CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) ΔH
在温度为T1和T2时,分别将0.40 mol CH4和1.0 mol NO2充入体积为1 L的密闭容器中,n(CH4)随反应时间的变化如图所示。
①根据图判断该反应的ΔH________(填“>”“<”或“=”)0,理由是 。
②温度为T1时,0~10 min内NO2的平均反应速率v(NO2)=__________ _ 。
③该反应达到平衡后,为在提高反应速率的同时提高NO2的转化率,可采取的措施有________(填标号)。
A.改用高效催化剂
12
高考化学总复习
B.升高温度
C.缩小容器的体积
D.增加CH4的浓度
【解析】①先达到平衡说明反应速率快,即T2>T1,随着温度的升高,甲烷的物质的量增加,说明升高温度,平衡向逆反应方向移动,即正反应方向ΔH<0;②前
10 min,消耗甲烷的物质的量为(0.4-0.3)mol=0.1 mol,即消耗NO2的物质的量为2×0.1 mol=0.2 mol,根据化学反应速率的表达式,v(NO2)=;③使用催化剂,只加快反应速率,对化学平衡无影响,A错误;正反应方向是放热反应,升高温度平衡向逆反应方向移动,NO2的转化率降低,但化学反应速率加快,B错误;缩小容器的体积,相当于增大压强,平衡向逆反应方向进行,NO2的转化率降低,但反应速率加快,C错误;增加CH4的浓度,平衡向正反应方向移动,NO2的转化率增大,化学反应速率加快,D正确。
答案:①< T1”“<”或“=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 mol CO和20 mol H2,则在平衡状态B时容器的体积V(B)=________L。
【解析】(1)已知①2CH4(g)+O2(g)2CO(g)+4H2(g) ΔH=a kJ·mol-1,
②CO(g)+2H2(g)CH3OH(g) ΔH=b kJ·mol-1,则根据盖斯定律可知①+②×2可得到2CH4(g)+O2(g)2CH3OH(g) ΔH=(a+2b) kJ·mol-1。
(2)用甲醇表示的反应速率v=0.75 mol·L-1÷10 min=0.075 mol·L-1·min-1,CO表示的反应速率等于用甲醇表示的反应速率,即0.075 mol·L-1·min-1;化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知平衡常数表达式为K=。
(3)①氢气的消耗速率等于CH3OH的生成速率的2倍,不能说明正、逆反应速率相等,不一定平衡,A错误;氢气的体积分数不再改变是化学平衡的特征,达到了平衡,B正确;体系中氢气的转化率和CO的转化率相等,不能说明正、逆反应速率相等,不一定平衡,C错误;体系中气体的平均摩尔质量等于气体质量和物质的量的比值,物质的量变化,质量不变,所以当体系中气体的平均摩尔质量不再改变,证明达到了平衡,D正确。
②正反应方向为气体体积减小的方向,T1 ℃时比较CO的转化率,转化率越大,则压强越大,图象中pB转化率大于pA,可知pA
查看更多