2019届二轮复习化学能与热能学案(全国通用)(2)
化学能与热能
一、考纲要求
1. 了解化学反应中能量转化的原因。能说出常见的能量转化形式。
2. 了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。
3. 了解热化学方程式的含义,能用盖斯定律进行有关反应热的简单计算。
4. 了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。
二、考题规律
随着社会的发展和人们生活水平的提高,能源的需求量越来越大,对周围环境产生的影响也越来越大。从能源问题切入,可引出许多学科知识,能培养和考查学生的综合能力。高考考查的主要内容有:(1)热化学方程式的书写及正误判断;(2)反应热的计算;(3)反应热与能源的综合考查及能量转化的综合考查。
三、考向预测
这部分知识与生产生活密切相关。预计考查反应热的内容将不断拓宽,难度会有所提高,题型也会有新的变化。以能量变化图象为载体,考查燃烧热、反应热的计算是近几年命题的常见形式;书写热化学方程式以及盖斯定律的应用更是高考的热点。
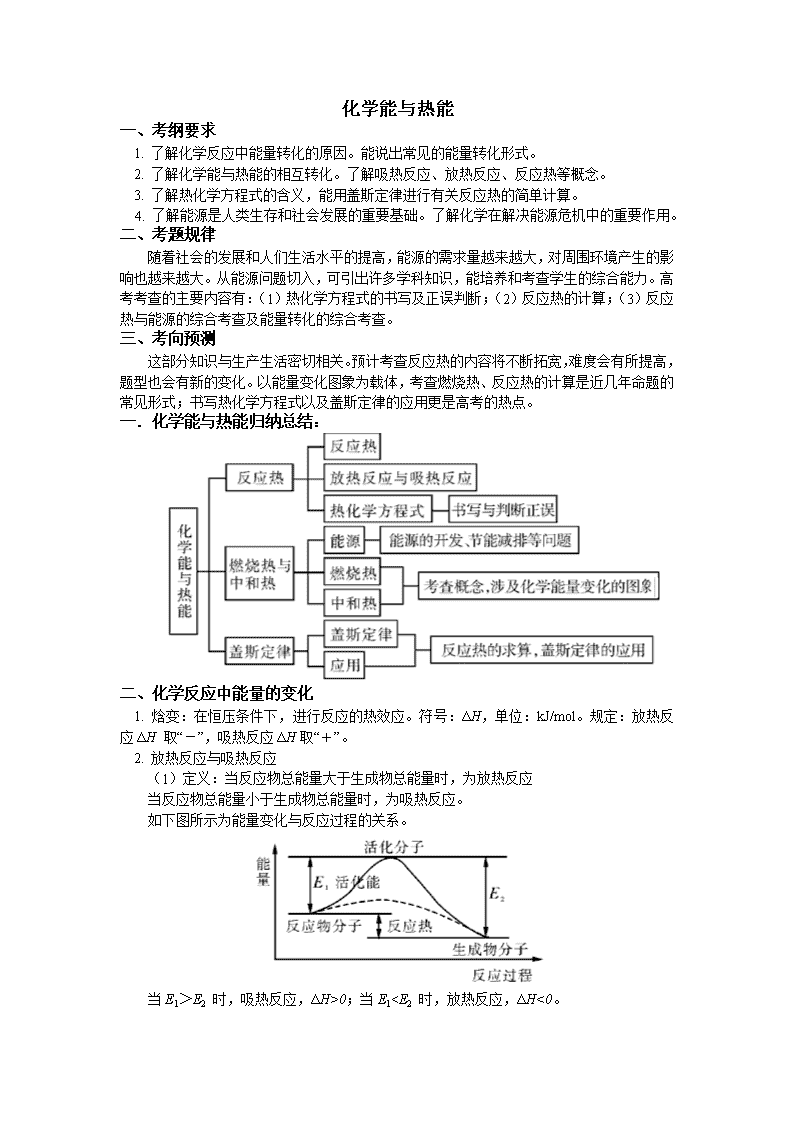
一.化学能与热能归纳总结:
二、化学反应中能量的变化
1. 焓变:在恒压条件下,进行反应的热效应。符号:ΔH,单位:kJ/mol。规定:放热反应ΔH 取“-”,吸热反应ΔH取“+”。
2. 放热反应与吸热反应
(1)定义:当反应物总能量大于生成物总能量时,为放热反应
当反应物总能量小于生成物总能量时,为吸热反应。
如下图所示为能量变化与反应过程的关系。
当E1>E2 时,吸热反应,ΔH>0;当E1
0,则金刚石比石墨稳定
C. 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则表示该反应中和热的化学方程式为:NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=-57.4kJ/mol
D. 已知2C(s)+2O2(g)===2CO2(g);ΔH1,2C(s)+O2(g)===2CO(g);ΔH2,则ΔH1>ΔH2
5. 已知:2H2(g)+O2(g)===2H2O(l);ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况下),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3 695 kJ,则原混合气体中H2与CH4的物质的量之比是( )
A. 1∶1 B. 1∶3 C. 1∶4 D. 2∶3
6. 已知25℃、101 kPa时,乙烯和乙炔(C2H2)燃烧的热化学方程式分别为C2H4(g)+3O2(g)===2CO2(g)+2H2O(l) ΔH=-1 411 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-2 600 kJ·mol-1
又知燃烧时火焰的温度乙炔高于乙烯。据此,下列说法不正确的是( )
A. 物质的燃烧热越大,火焰温度越高
B. 相同条件下等体积乙烯和乙炔完全燃烧时,乙炔放热较少
C. 25℃、101 kPa时,1 mol乙烯完全燃烧生成气态产物时,放出的热量少于1 411 kJ
D. 乙炔的燃烧热为1 300 kJ·mol-1
7. 下列关于热化学反应的描述中正确的是( )
A. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)===2CO(g)+O2(g)反应的
ΔH=+2×283.0 kJ·mol-1
C. 需要加热才能发生的反应一定是吸热反应
D. 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
8. 下列有关离子反应H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol的说法正确的是( )
A. 代表所有的酸碱中和反应
B. 反应物一定是强酸与强碱
C. 强酸与强碱的中和反应都可以这样表示
D. 代表稀的强酸与稀的强碱反应生成1 mol液态水时,放出热量57.3 kJ
9. 已知下列热化学方程式:Zn(s)+O2(g)===ZnO(s)ΔH1 Hg(l)+O2(g)===HgO(s)ΔH2,则Zn(s)+HgO(s)===Hg(l)+ZnO(s) ΔH3,ΔH3的值为( )
A. 2ΔH2-ΔH1 B. 2ΔH1-ΔH2 C. ΔH1-ΔH2 D. ΔH2-ΔH1
10. 化学反应N2+3H22NH3的能量变化如下图所示,该反应的热化学方程式是( )
A. N2(g)+3H2(g)2NH3(l) ΔH=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)2NH3(g) ΔH=2(b-a)kJ·mol-1
C. N2(g)+H2(g)NH3(l) ΔH=(b+c-a)kJ·mol-1
D. N2(g)+H2(g)NH3(g) ΔH=(a+b)kJ·mol-1
﹡11. 已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)===Na2CO3(s)+O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A. CO的燃烧热为283 kJ
B. 上图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
12. (兰州)下列有关热化学方程式的叙述正确的是( )
A. 已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol,则氢气的燃烧热为285.8 kJ/mol
B. 已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C. 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸稀
NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3
COONa(aq)+H2O(l) ΔH=-57.4 kJ/mol
D. 已知2C(s)+2O2(g)===2CO2(g) ΔH1,2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1>ΔH2
二、非选择题
﹡13. 如果1个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的,这个规律称为盖斯定律。据此回答下列问题:
(1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。 丙烷脱氢可得丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g) ΔH1=+156.6 kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g) ΔH2=+32.4 kJ·mol-1
则相同条件下,丙烷脱氢得丙烯的热化学方程式为 ____________________。
(2)已知:Na2CO3·10H2O(s)===Na2CO3(s)+10H2O(g)
ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)===Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O(s)脱水反应的热化学方程式
___ 。
14. 已知下列热化学方程式:
(1)Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-25 kJ/mol
(2)3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH=-47 kJ/mol
(3)Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH=+19 kJ/mol
写出FeO(s)被CO还原成Fe和CO2的热化学方程式
_______________________________________________________________________。
﹡15. 近年来,由CO2催化加氢合成甲醇的相关研究受到越来越多的关注. 该方法既可解决CO2废气的利用问题,又可开发生产甲醇的新途径,具有良好的应用前景. 已知4.4 g CO2气体与H2经催化加氢生成CH3OH气体和水蒸气时放出4.95 kJ的能量。
(1)该反应的热化学方程式为:__________________________________________.
(2)在270℃、8 MPa和适当催化剂的条件下,CO2的转化率达到22%,则4.48 m3(已折合为标准状况下)的CO2能合成CH3OH气体的物质的量是________,此过程中能放出热量________ kJ。
(3)又已知H2O(g)===H2O(l) ΔH=-44 kJ/mol,则22 g CO2气体与H2反应生成CH3OH气体和液态水时放出热量为________。
(4)根据该反应特点,有利于甲醇合成的条件是________。
A. 高压高温 B. 低压高温 C. 高压低温 D. 低压低温
练习题答案
1. C 解析:铝片与稀盐酸之间的置换反应、甲烷(CH4)在O2中的燃烧反应既是氧化还原反应,又是放热反应;灼热的炭与水蒸气发生的氧化还原反应是吸热反应;Ba(OH)2·8H2O与NH4Cl之间发生的复分解反应是吸热反应。
2. C 解析:化学变化的本质是旧化学键的断裂、新化学键的形成,化学变化中会产生新的物质并伴随能量变化,但物质状态不一定发生变化,如:N2(g)+3H2(g) 2NH3(g)。
﹡3. B 解析:本题考查热化学方程式的书写及有关的计算。因1 mol甲醇燃烧生成CO2和液态水,放出22.68 kJ·g-1×32 g=725.8 kJ热量,所以2 mol甲醇燃烧生成CO2和液态水的ΔH=-1451.6 kJ·mol-1。
4. C解析:A中表示燃烧热时H2O应为液体;B中由热化学方程式知金刚石具有的能量高,金刚石不如石墨稳定;D中忽视了放热反应的ΔH为负值。
5. B 解析:设H2和CH4的物质的量分别是x和y,则x+y=112/22.4,+890y=3 695,解得x=1.25 mol,y=3.75 mol,故原混合气体中H2与CH4物质的量之比是1∶3。
6. A 解析:C2H4的燃烧热为1 411 kJ·mol-1,C2H2的燃烧热为1 300 kJ·mol-1,而乙炔燃烧的火焰温度高于乙烯,A项错误。
7. B 解析:中和热是指强酸与强碱的稀溶液完全反应生成1 mol H2O所放出的热量,所以A错误;;B中CO燃烧是放热反应,则2CO2(g)+O2(g)为吸热反应,且生成2 mol CO,△H=+2×283.0 kJ·mol-1,B正确;需要加热才能发生的反应不一定是吸热反应,如铝热反应、碳的燃烧等,C不正确;燃烧热是指1 mol可燃物完全燃烧生成稳定的氧化物所放出的热量,D中甲烷燃烧生成气态水不属于稳定的氧化物,D错误。
8. D 解析:有弱酸或弱碱参加的反应其离子方程式不能这样表示;强酸的酸式盐与强碱反应也可用这个离子方程式表示,但硫酸与Ba(OH)2的反应不能用该离子方程式表示,故A、B、C项错误,ΔH=-57.3 kJ/mol是中和热。
9. C 解析:用第一式减去第二式即得第三式。
10. A 解析:mol N2(g)与mol H2(g)完全反应生成1 mol NH3(g)时放热:(b-a)kJ。生成1 mol NH3(l)时放热:(b+c-a)kJ。
﹡11. C 解析:A错,燃烧热的单位应是kJ/mol。B项,图中没有标注物质的物质的量。C项, 由CO2(s)===CO2(g) ΔH>0及盖斯定律可知C项正确。D项,当反应放出509 kJ热 量时,参加反应的CO为1 mol,电子转移数为2×6.02×1023。
12. A 解析:石墨转化为金刚石是吸热反应,金刚石能量高,石墨比金刚石稳定,B不正确;醋酸反应过程中继续电离,电离吸收热量,C不正确;碳完全燃烧生成CO2比不完全燃烧生成CO放出的热量多,但是其反应热ΔH是负值,故ΔH1<ΔH2,D不正确。
﹡13. 解析:(1)由C3H8(g)―→CH4(g)+HC≡CH(g)+H2(g) ΔH1=+156.6 kJ·mol-1①
CH3CH===CH2(g)―→CH4(g)+HC≡CH(g) ΔH=+32.4 kJ·mol-1②[
①-②可以得到
②C3H8(g)―→CH3CH===CH2(g)+H2(g);
ΔH=ΔH1-ΔH2=+156.6 kJ·mol-1-32.4 kJ·mol-1=+124.2 kJ·mol-1
(2)根据盖斯定律,将题中反应①-②得:
Na2CO3·H2O(s)===Na2CO3(s)+H2O(g) ΔH=+58.73 kJ·mol-1
答案:(1)C3H8(g)→CH3CH=CH2(g)+H2(g) ΔH=+124.2 kJ/mol
(2)Na2CO3·H2O(s)=Na2CO3(s)+H2O(g) ΔH=+58.73 kJ/mol
14. 解析:依据盖斯定律:化学反应不管是一步完成还是分几步完成,其反应热是相同的我们可从题目中所给的有关方程式分析:从方程式(3)与方程式(1)可以看出有我们需要的有关物质。但方程式(3)必须通过方程式(2)有关物质才能和方程式(1)结合在一起。将方程式(3)×2+方程式(2)得:2Fe3O4(s)+2CO(g)+3Fe2O3(s)+CO(g)===6FeO(s)+2CO2(g)+2Fe3O4(s)+CO2(s)ΔH=+19 kJ/mol×2+(-47 kJ/mol)。
整理得(4):
Fe2O3(s)+CO(g)===2FeO(s)+CO2(g) ΔH=-3 kJ/mol
将(1)-(4)得:
2CO(g)===2Fe(s)+3CO2(g)-2FeO(s)-CO2(g) ΔH=-25 kJ/mol-(-3 kJ/mol)
整理得:FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH=-11 kJ/mol
答案:FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH=-11 kJ/mol
﹡15. 解析:(1)4.4 g CO2气体完全合成CH3OH和水蒸气放热4.95 kJ,则1 mol CO2完全合成CH3OH和水蒸气放热49.5 kJ,热化学方程式为CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-49.5 kJ/mol。
(2)n(CH3OH)=n(CO2)=×22%=44 mol,每生成1 mol CH3OH(g)放热49.5 kJ,则此过程中放热为:(44×49.5)kJ=2178 KJ。
(3)由H2O(g)===H2O(l) ΔH=-44 kJ/mol以及(1)中的热化学方程式可知,1 mol CO2完全合成CH3OH并生成液态水时放热为44 kJ+49.5 kJ=93.5 kJ.则22 g CO2即0.5 mol CO2与H2反应时,放热为93.5 kJ÷2=46.75 kJ。
(4)该反应正反应放热,低温有利于CO2合成CH3OH,又因正反应为体积减小的反应,高压有利于CO2合成CH3OH。
答案:(1)CO2(g)+3H2(g)===CH3OH(g)+H2O(g)
ΔH=-49.5 kJ/mol
(2)44 mol 2178
(3)46.75 kJ
(4)C