- 2021-07-07 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020高中化学(人教版 选修4)练习:第4章 第2节
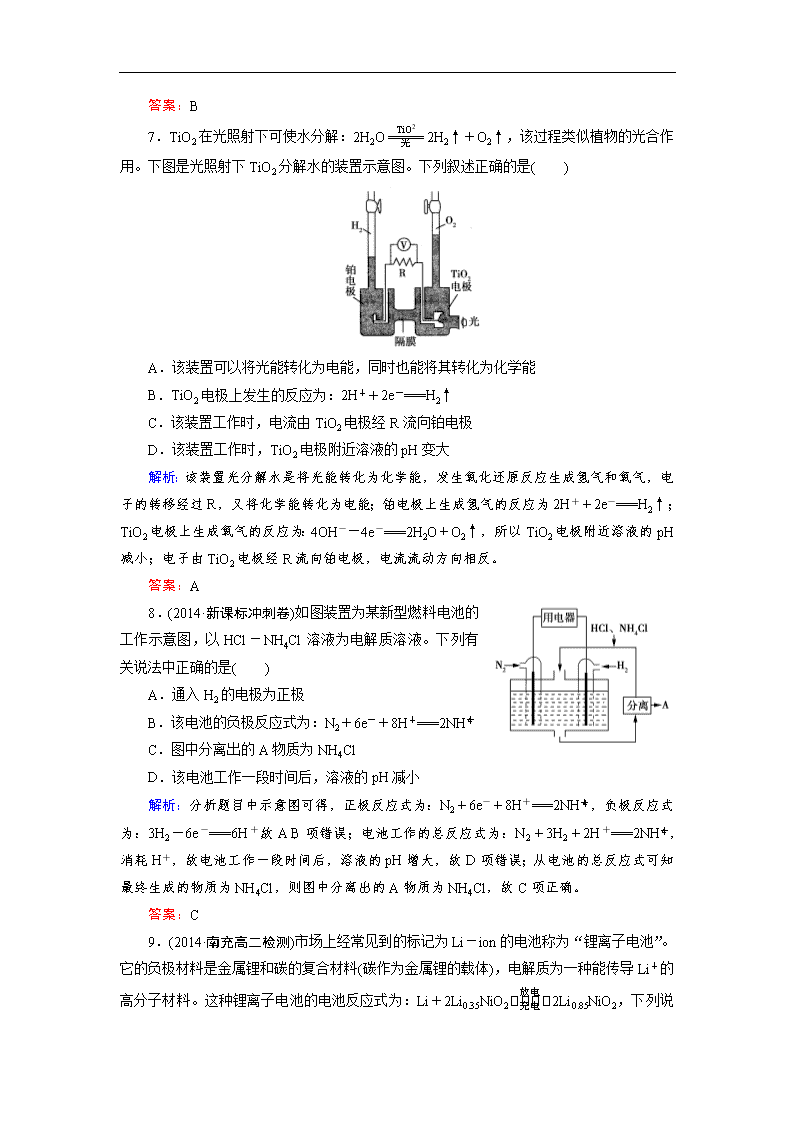
第四章 第二节 一、选择题 1.废电池必须进行集中处理的问题被提到议事日程。其首要原因是( ) A.为了利用电池外壳的金属材料 B.防止汞、镉和铅等重金属离子对土壤和水源的污染 C.不使电池中渗泄的电解液腐蚀其他物品 D.回收其中的石墨电极 解析:废电池中汞、镉和铅等重金属离子能对土壤和水源造成污染,必须进行集中处理。 答案:B 2.下列有关电池的叙述正确的是( ) A.锌锰干电池工作一段时间后碳棒变细 B.氢氧燃料电池工作时氢气在负极被氧化 C.太阳能电池的主要材料是高纯度的二氧化硅 D.氢氧燃料电池可将热能直接转变为电能 解析: 选项 原因分析 结论 A 锌锰干电池工作后碳棒不变 × B 氢氧燃料电池工作时都是负极发生氧化反应,H2-2e-===2H+ √ C 太阳能电池的主要材料是高纯度的硅 × D 氢氧燃料电地是将化学能转变为电能 × 答案:B 3.燃料电池是燃料(例如CO、H2、CH4等)跟氧气或空气起反应,将此反应的化学能转化为电能的装置,电解质溶液通常是KOH溶液。下列关于甲烷燃烧电池的说法不正确的是( ) A.负极反应式为CH4+10OH-+8e-===CO+7H2O B.正极反应式为2O2+4H2O+8e-===8OH- C.随着不断放电,电解质溶液碱性不变 D.甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大 解析:A、B两项是正确的;综合A、B两项知C项不正确;根据能量转化的规律,燃烧时产生的热能是不可能全部转化为功的,能量利用率不高,而电能转化为功的效率要大得多,D项正确。 答案:C 4.(2014·北京东城期末)如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2 是溶剂,反应原理是4Li+FeS2===Fe+2Li2S。下列说法不正确的是( ) A.该装置将化学能转化为电能 B.电子移动方向是由a极流向b极 C.可以用水代替SO(CH3)2作溶剂 D.b极反应式是FeS2+4Li++4e-===Fe+2Li2S 解析:Li作负极发生Li-e-===Li+,正极FeS2中铁的化合价由+2价降低到0价、硫由-1价降低到-2价,电极反应式为FeS2+4e-+4Li+===Fe+2Li2S;水与Li发生反应,C选项错误。 答案:C 5.高效能电池的研发制约电动汽车的推广。有一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6+7O2+8KOH===4K2CO3+10H2O,有关此电池的推断中正确的是( ) A.负极反应为:14H2O+7O2+28e-===28OH- B.放电过程中KOH的物质的量浓度不变 C.每消耗1 mol C2H6,则电路上转移的电子为14 mol D.放电一段时间后,负极周围的pH升高 解析:燃料作负极,氧气作正极,A选项错误;由总反应可知放电过程中消耗KOH,B选项错误;分析总反应,7个O2参加反应转移28个电子,C选项正确;负极电极反应式为C2H6+18OH--14e-===2CO+12H2O,D选项错误。 答案:C 6.将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即可构成CH4燃料电池。已知通入CH4一极的电极反应式是:CH4+10OH-===CO+7H2O+8e-;通入O2一极的电极反应式是:O2+2H2O+4e-===4OH-。下列有关叙述中,不正确的是( ) A.通入CH4的电极为负极 B.正极发生氧化反应 C.溶液中的OH-向负极移动 D.工作一段时间后应补充KOH 解析:该燃料电池正极发生还原反应,B不正确。根据题中电极反应式知CH4发生氧化反应,通入CH4的电极为负极,A正确;原电池工作时,电解质溶液中阴离子移向负极,C正确;该电池总反应为CH4+2O2+2OH-===CO+3H2O,工作时消耗KOH,D正确。 答案:B 7.TiO2在光照射下可使水分解:2H2O2H2↑+O2↑,该过程类似植物的光合作用。下图是光照射下TiO2分解水的装置示意图。下列叙述正确的是( ) A.该装置可以将光能转化为电能,同时也能将其转化为化学能 B.TiO2电极上发生的反应为:2H++2e-===H2↑ C.该装置工作时,电流由TiO2电极经R流向铂电极 D.该装置工作时,TiO2电极附近溶液的pH变大 解析:该装置光分解水是将光能转化为化学能,发生氧化还原反应生成氢气和氧气,电子的转移经过R,又将化学能转化为电能;铂电极上生成氢气的反应为2H++2e-===H2↑;TiO2电极上生成氧气的反应为:4OH--4e-===2H2O+O2↑,所以TiO2电极附近溶液的pH减小;电子由TiO2电极经R流向铂电极,电流流动方向相反。 答案:A 8.(2014·新课标冲刺卷)如图装置为某新型燃料电池的工作示意图,以HCl-NH4Cl溶液为电解质溶液。下列有关说法中正确的是( ) A.通入H2的电极为正极 B.该电池的负极反应式为:N2+6e-+8H+===2NH C.图中分离出的A物质为NH4Cl D.该电池工作一段时间后,溶液的pH减小 解析:分析题目中示意图可得,正极反应式为:N2+6e-+8H+===2NH,负极反应式为:3H2-6e-===6H+,故A、B项错误;电池工作的总反应式为:N2+3H2+2H+===2NH,消耗H+,故电池工作一段时间后,溶液的pH增大,故D项错误;从电池的总反应式可知最终生成的物质为NH4Cl,则图中分离出的A物质为NH4Cl,故C项正确。 答案:C 9.(2014·南充高二检测)市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为:Li+2Li0.35NiO22Li0.85NiO2 ,下列说法不正确的是( ) A.放电时,负极的电极反应式:Li-e-===Li+ B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应 C.该电池不能用水溶液作为电解质溶液 D.放电过程中Li+向负极移动 解析:A项,Li从零价升至正价,失去电子,作负极,正确;B项,反应逆向进行时,反应物只有一种,化合价既有升,又有降,所以既发生氧化反应又发生还原反应,正确;C项,由于Li可以与水反应,故不能用水溶液作为电解质溶液,正确;D项,原电池中阳离子应迁移至正极得电子,故错。 答案:D 10.(2014·华中师大附中)科学家成功开发出便携式固体氧化物燃料电池,它以丙烷气体为燃料。电池中的一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-。下列对该燃料电池的说法不正确的是( ) A.在熔融电解质中,O2-由负极移向正极 B.该电池的总反应是:C3H8+5O2===3CO2+4H2O C.电路中每通过5 mol电子,约有5.6 L标准状况下的丙烷被完全氧化 D.通入丙烷的电极为电池负极,发生的电极反应为:C3H8-20e-+10O2-===3CO2+4H2O 解析:该燃料电池的化学反应原理是:C3H8+5O2===3CO2+4H2O,B正确;放电过程中通入丙烷的电极为负极:C3H8-20e-+10O2-===3CO2+4H2O,C正确;通入O2的电极为正极:O2+4e-===2O2-,产生的O2-将向负极移动,A项错。 答案:A 二、非选择题 11.氯铝电池是一种新型的燃料电池,电解质溶液是KOH溶液,试回答下列问题: (1)通入氯气的电极是________极(填“正”或“负”),电极反应式为: ________________________________________________________________________。 (2)加入铝的电极是________极(填“正”或“负”),电极反应式为: ________________________________________________________________________。 (3)电子从________极流向________极(填“Al”或“Cl2”)。 解析:根据Cl2和Al的反应方程式:3Cl2+2Al===2AlCl3可知,铝易失电子被氧化,为负极,但电解液为KOH溶液,故负极反应为:2Al-6e-+8OH-===2AlO+4H2O,Cl2易得电子被还原,为正极,电极反应为3Cl2+6e-===6Cl-。在外电路中电子从负极(铝极)流出沿导线流向正极(Cl2极)。 答案:(1)正 3Cl2+6e-===6Cl- (2)负 2Al-6e-+8OH-===2AlO+4H2O (3)Al Cl2 12.(2014·经典习题选萃)铅蓄电池是化学电源,它工作时的电池总反应为:PbO2+Pb+2H2SO42PbSO4+2H2O。试回答: (1)蓄电池负极的电极材料是_________________________________________________。 (2)工作时该蓄电池正极的电极反应式是_______________________________________。 (3)铅蓄电池工作时,电解质溶液的密度________,pH________(填“增大”“减小”或“不变”)。 (4)如果用铅蓄电池作电源电解饱和食盐水制取Cl2,当制得0.05 mol Cl2时,在理论上电池内部消耗的H2SO4的物质的量是________。 解析:(1)由电池总反应可知,Pb发生氧化反应,所以Pb是负极。 (2)正极上的反应是PbO2→PbSO4,则必然有H2SO4参加:PbO2+4H++SO+2e-PbSO4+2H2O(负极反应为Pb-2e-+SOPbSO4,将正、负极反应合并,与题给总反应相符)。 (3)在蓄电池的工作过程中,Pb被氧化,H2SO4被消耗,所以溶液的密度减小,pH增大。 (4)用铅蓄电池作电源,电解饱和食盐水制0.05 mol Cl2,需提供0.10 mol e-(2Cl--2e-Cl2↑),每消耗2 mol H2SO4时转移2 mol e-,故至少消耗0.10 mol H2SO4。 答案:(1)Pb (2)PbO2+4H++SO+2e-PbSO4+2H2O (3)减小 增大 (4)0.10 mol 点评:将蓄电池与电解槽相连接时,前者将化学反应的能量转化为电能提供给后者,使其发生氧化还原反应,在电路中流过的电子的物质的量相等。 13.锌银电池比能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器。电解质溶液是KOH溶液,电池总反应为Zn+Ag2OZnO+2Ag。请回答下列问题: (1)该电池的正极材料是________;电池工作时,阳离子向________(填“正极”或“负极”)移动;负极的反应式为________。 (2)①电极材料锌可由闪锌矿在空气中煅烧成氧化锌,然后用碳还原来制取,化学反应方程式为ZnO+C高温,Zn+CO,此法为________。 A.电解法 B.热还原法 C.热分解法 ②电极材料氧化银可回收利用得到银,其化学方程式为________________。 答案:(1)Ag2O 正极 Zn-2e-+2OH-ZnO+H2O (2)①B ②2Ag2O△,4Ag+O2↑ 14.(2015·高考冲刺卷) 设计出燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一极通入空气,另一极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。回答如下问题: (1)以丁烷代表汽油,这个电池放电时发生的化学反应方程式是____________________。 (2)这个电池负极发生的反应是C4H10+13O2--26e-4CO2+5H2O,正极发生的反应是________,固体电解质里O2-的移动方向是________,向外电路释放电子的电极是________。 (3)人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油产生动力的主要原因是________。 (4)在ZrO2晶体里掺杂Y2O3,用Y3+代替晶体里的部分Zr4+对提高固体电解质的导电能力有帮助,你认为原因是_________________________________________________________。 (5)汽油燃料电池最大的障碍是氧化反应不完全,产生________堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年,这正是新一代化学家的历史使命。 答案:(1)2C4H10+13O28CO2+10H2O (2)O2+4e-2O2- 向负极移动 负极 (3)燃料电池具有较高的能量利用率 (4)为维持电荷平衡,晶体中的O2-将减少,从而使O2-得以在电场作用下向负极移动 (5)碳粒 15.氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。 请回答: (1)氢氧燃料电池的能量转化主要形式是________________,在导线中电子流动方向为________________(用a、b表示)。 (2)负极反应式为___________________________________________________________。 (3)电极表面镀铂粉的原因为: ________________________________________________________________________。 (4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下: Ⅰ.2Li+H22LiH Ⅱ.LiH+H2O===LiOH+H2↑ ①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是________。 ②已知LiH固体密度为0.82 g·cm-3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________________________。 ③由②生成的LiH与H2O作用,放出的H2 用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为____________mol。 解析:(1)氢氧燃料电池中,负极通H2,正极通O2,所以导线中电子由a到b。 (2)负极H2被氧化,写电极反应式时要注意电解质溶液的组成。 (3)本题考查读题能力,铂粉作用在题设中有说明。 (4)②2Li+H22LiH 22.4 L 16 g 吸收224 L H2时,生成的LiH的质量为160 g,LiH体积与被吸收的H2体积比为: ∶224 L=1∶1 148 ③LiH+H2O===LiOH+H2↑ 8 g 1 mol 160 g LiH与H2O作用生成20 mol H2,H2完全被氧化失40 mol电子,若能量转化率为80%,则导线中通过的电子的物质的量为40 mol×80%=32 mol。 答案:(1)由化学能转变为电能 由a到b (2)2H2+4OH--4e-===4H2O (或H2+2OH--2e-===2H2O) (3)增大电极单位面积吸附H2、O2分子数,加快电极反应速率 (4)①Li H2O ②(或8.71×10-4) ③32查看更多