- 2021-07-07 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版化学反应速率作业
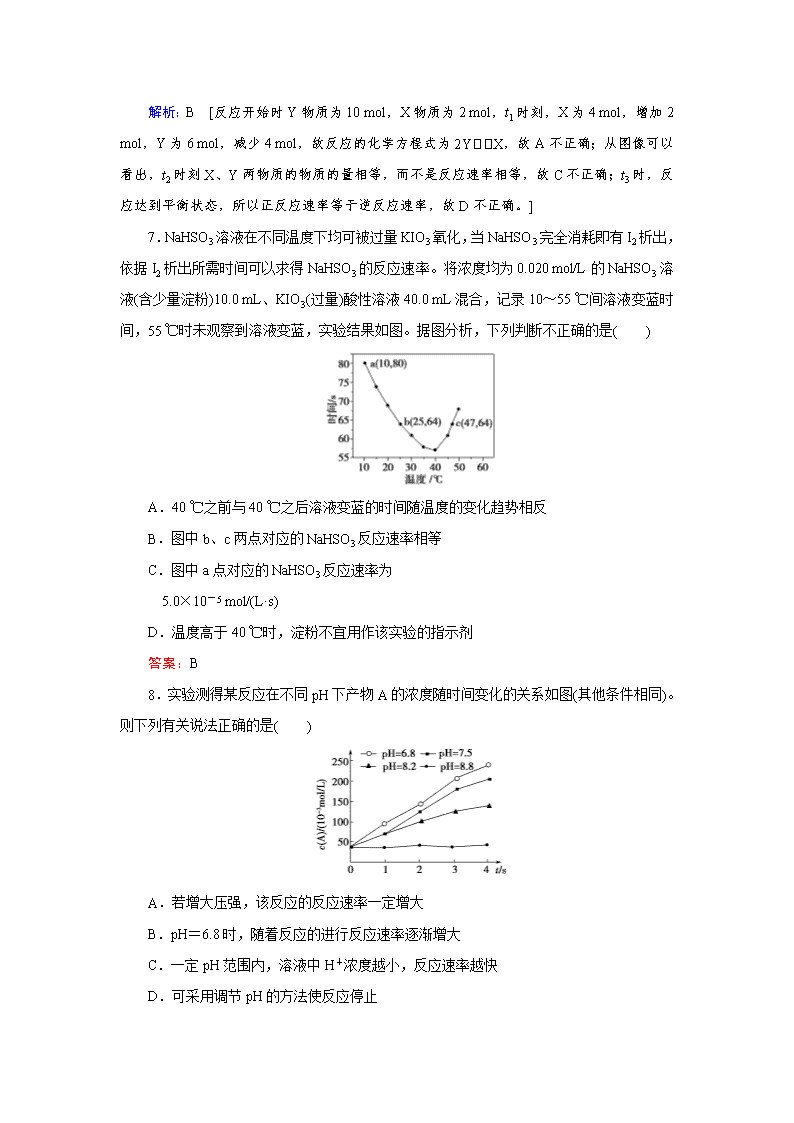
化学反应速率 1.下列说法正确的是( ) A.催化剂不影响反应活化能,但能增大单位体积内活化分子百分数,从而增大反应速率 B.化学反应速率为0.8 mol/(L·s)是指1 s时某物质的浓度为0.8 mol/L C.根据化学反应速率的大小可以判断化学反应进行的快慢 D.对于化学反应来说,反应速率越大,反应现象越明显 解析:C [A项,催化剂可以降低反应所需的活化能,增大活化分子的百分数,错误;B项,0.8 mol/(L·s)是指1 s内该物质的浓度变化量为0.8 mol/L,错误;D项,反应速率与反应现象之间无必然联系,如酸碱中和反应的速率很快,但却观察不到什么现象,错误。] 2.某温度下,浓度都是1 mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经t min后,测得各物质的浓度分别为c(X2)=0.4 mol/L,c(Y2)=0.6 mol/L,c(Z)=0.4 mol/L,则该反应的化学方程式可表示为( ) A.2X2+3Y22X2Y3 B.3X2+2Y22X3Y2 C.X2+2Y22XY2 D.2X2+Y22X2Y 解析:B [由题意知X2、Y2、Z的浓度变化分别为0.6 mol/L、0.4 mol/L、0.4 mol/L,故反应方程式中化学计量数之比为3∶2∶2,结合原子守恒知B正确。] 3.反应2SO2(g)+O2(g)2SO3(g)经一段时间后,SO2的浓度减少了0.4 mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s),则这段时间为( ) A.0.1 sB 2.5 sC.5 sD.10 s 解析:C [根据化学方程式,当SO2的浓度减少了0.4 mol/L时,消耗O2的浓度是0.2 mol/L,由化学反应速率的计算式v=得Δt===5 s。] 4.为探究锌与稀硫酸的反应速率[以v(H2)表示],向反应混合液中加入某些物质,下列判断正确的是( ) ①加入NH4HSO4固体,v(H2)不变 ②加入少量水,v(H2)减小 ③加入CH3COONa固体,v(H2)减小 ④滴加少量CuSO4溶液,v(H2)减小 A.①② B.②③ C.③④ D.①④ 解析:B [反应实质为:Zn+2H+===Zn2++H2↑,①导致溶液中c(H+)增大,v(H2)加快,①错误;②导致溶液中c(H+)减小,v(H2)减小,②正确;③因发生CH3COO-+H+CH3COOH,导致溶液中c(H+)减小,v(H2)减小,③正确;④形成铜锌原电池,v(H2)加快,④错误,所以正确的是②③,选B。] 5.A与B在容积为1 L的密闭容器中发生反应:aA(s)+bB(g)cC(g)+dD(g),t1、t2时刻分别测得部分数据如下表: n(B)/mol n(C)/mol n(D)/mol 反应时间/min 0.12 0.06 0.10 t1 0.06 0.12 0.20 t2 下列说法正确的是( ) A.0~t1时间段内,平均反应速率v(B)=mol/(L·min) B.若起始时n(D)=0,则t2时v(D)= mol/(L·min) C.升高温度,v(B)、v(C)、v(D)均增大 D.b∶d=6∶1 解析:C [不能确定B的起始物质的量,因此0~t1时间段内,不能确定B的变化量,则不能计算其反应速率,A错误;反应速率是平均反应速率,而不是瞬时反应速率,B错误;升高温度,反应速率v(B)、v(C)、v(D)均增大,C正确;t1~t2时间段内,B和D的物质的量变化量分别是0.06 mol、0.1 mol,所以b∶d=3∶5,D错误。] 6.一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图。下列叙述中正确的是( ) A.反应的化学方程式为5YX B.t1时,Y的浓度是X浓度的1.5倍 C.t2时,正、逆反应速率相等 D.t3时,逆反应速率大于正反应速率 解析:B [反应开始时Y物质为10 mol,X物质为2 mol,t1时刻,X为4 mol,增加2 mol,Y为6 mol,减少4 mol,故反应的化学方程式为2YX,故A不正确;从图像可以看出,t2时刻X、Y两物质的物质的量相等,而不是反应速率相等,故C不正确;t3时,反应达到平衡状态,所以正反应速率等于逆反应速率,故D不正确。] 7.NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol/L的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是( ) A.40 ℃之前与40 ℃之后溶液变蓝的时间随温度的变化趋势相反 B.图中b、c两点对应的NaHSO3反应速率相等 C.图中a点对应的NaHSO3反应速率为 5.0×10-5 mol/(L·s) D.温度高于40 ℃时,淀粉不宜用作该实验的指示剂 答案:B 8.实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件相同)。则下列有关说法正确的是( ) A.若增大压强,该反应的反应速率一定增大 B.pH=6.8时,随着反应的进行反应速率逐渐增大 C.一定pH范围内,溶液中H+浓度越小,反应速率越快 D.可采用调节pH的方法使反应停止 解析:D [无法确定反应有没有气体参加,A错误;图像中表示反应速率的是曲线的斜率,B错误;pH越小,H+浓度越大,反应速率越快,C错误;pH=8.8时,反应速率接近于0,D正确。] 9.一定条件下,在容积固定的某密闭容器中发生反应N2+3H22NH3。在10 s内N2的浓度由5 mol/L降至4 mol/L,下列说法正确的是( ) A.用NH3表示的化学反应速率为0.1 mol/(L·s) B.使用合适的催化剂,可以加快该反应的速度 C.增加H2的浓度或降低温度都会加快该反应速率 D.反应足够长时间,N2、H2中至少有一种物质浓度降为零 答案:B 10.一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.1 mol H2O(g),发生反应:2H2O(g)2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表: 时间/min 20 40 60 80 n(O2)/mol 0.001 0 0.001 6 0.002 0 0.002 0 下列说法不正确的是( ) A.前20 min内的反应速率v(H2O)=5.0×10-5 mol/(L·min) B.达到平衡时,至少需要从外界吸收能量0.968 kJ C.增大c(H2O),可以提高水的分解率 D.催化效果与Cu2O颗粒的大小有关 解析:C [由题意知,v(H2O)=2v(O2)=2×=5.0×10-5 mol/(L·min),A正确;热化学方程式表示的含义是2 mol H2O(g)完全分解生成2 mol H2(g)和1 mol O2(g),吸收484 kJ的能量,所以生成O2 0.002 0 mol时,吸收的能量为0.002 0 mol×484 kJ·mol-1=0.968 kJ,B正确;C项,由于反应物只有1种,增大c(H2O),相当于压强增大,平衡向气体体积减小的方向移动,所以水的分解率降低,C错误;D项,若Cu2O颗粒小,则接触面积大,反应速率快,催化效果好,正确。] 11.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O。 一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化): 实验序号 A溶液 B溶液 ① 20 mL 0.1 mol/L H2C2O4溶液 30 mL 0.01 mol/L KMnO4溶液 ② 20 mL 0.2 mol/L H2C2O4溶液 30 mL 0.01 mol/L KMnO4溶液 (1)该实验探究的是 ________ 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 ________ > ________ (填实验序号)。 (2)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO)= ________ mol/L。(假设混合溶液体积为50 mL) (3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 ________ 来比较化学反应速率。 (4)小组同学发现反应速率变化如下图,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂、② ________ 。 解析:(1)根据表中所列数据分析,实验探究的是浓度因素对化学反应速率的影响。浓度越大反应速率越快,生成的CO2的体积越大,即②>①。 (2)4.48 mL CO2,即0.000 2 mol,根据化学方程式计算,反应的MnO是0.000 04 mol,剩余的MnO是0.000 3 mol-0.000 04 mol=0.00026 mol,故c(MnO)=0.005 2 mol/L。 (3)KMnO4是有颜色的,故还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率。 (4)升高温度会加快反应的速率。 答案:(1)浓度 ② ① (2)0.005 2 (3)KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间 (4)该反应放热 12.在一密闭容器中发生反应N2+3H22NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。 回答下列问题: (1)处于平衡状态的时间段是 ________ (填选项)。 A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6 (2)判断t1、t3、t4时刻分别改变的一个条件。 A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.充入氮气 t1时刻 ________ ;t3时刻 ________ ;t4时刻 ________ 。 (3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 ________ 。 A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6 (4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。 (5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 ________ 。 解析:(1)根据图示可知,t0~t1、t2~t3、t3~t4、t5~t6时间段内,v正、v逆相等,反应处于平衡状态。 (2)t1时,v正、v逆同时增大,且v逆增大得更快,平衡向逆反应方向移动,所以t1时改变的条件是升温。t3时,v正、v逆同时增大且增大量相同,平衡不移动,所以t3时改变的条件是加催化剂。t4时,v正、v逆同时减小,但平衡向逆反应方向移动,所以t4时改变的条件是减小压强。 (3)根据图示知,t1~t2、t4~t5时间段内平衡均向逆反应方向移动,NH3的含量均比t0~t1时间段的低,所以t0~t1时间段内NH3的百分含量最高。 (4)t6时刻分离出部分NH3,v逆立刻减小,而v正逐渐减小,在t7 时刻二者相等,反应重新达到平衡,据此可画出反应速率的变化曲线。 (5)设反应前加入a mol N2,b mol H2,达平衡时生成2x mol NH3,则反应后气体总的物质的量=(a+b-2x) mol,=0.2,解得:a+b=12x,故反应后与反应前的混合气体体积之比===。 答案:(1)ACDF (2)C E B (3)A (4) (5)5∶6 13.碘在科研与生活中有重要应用,某兴趣小组用0.50 mol/L KI、0.2%淀粉溶液、0.20 mol/LK2S2O8、0.10 mol/L Na2S2O3等试剂,探究反应条件对化学反应速率的影响。 已知:S2O+2I-===2SO+I2(慢) I2+2S2O===2I-+S4O(快) (1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 ________ 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O与S2O初始的物质的量需满足的关系为n(S2O):n(S2O) ________ 。 (2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表: 实验 序号 体积V/mL K2S2O8溶液 水 KI溶液 Na2S2O3溶液 溶液淀粉 ① 10.0 0.0 4.0 4.0 2.0 ② 9.0 1.0 4.0 4.0 2.0 ③ 8.0 Vx 4.0 4.0 2.0 表中Vx= ________ ,理由是__________________________________________ ________________________________________________________________________。 (3)已知某条件下,浓度c(S2O)反应时间t的变化曲线如图所示,若保持其他条件不 变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O)t的变化曲线示意图(进行相应的标注)。 解析:(1)中要想得到蓝色溶液,根据已知两个反应分析可得出结论。 (2)中由表格数据观察分析得知其他条件不变,只要改变K2S2O8的浓度就可以达到探究反应物浓度对化学反应速率的影响。 (3)中催化剂可以加快反应的反应速率,而降低温度会减慢反应的反应速率,所以可以根据图中标准线画出另外两条曲线,但要注意的有两点:第一是曲线的拐点,第二是曲线的终点。 答案:(1)Na2S2O3 <2 (2)2.0 保证反应物K2S2O8浓度改变,而其他的不变,才能达到实验目的 (3)查看更多