- 2021-07-07 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年广东省汕头市金山中学高二上学期期末考试 化学 word版
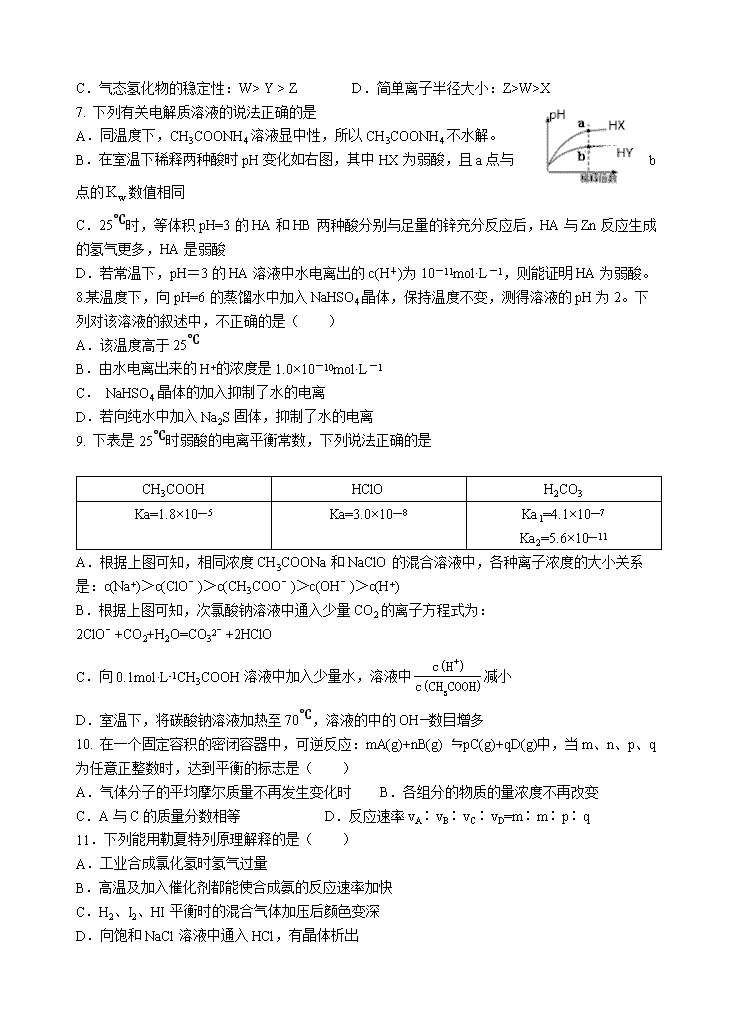
2019~2020年度(上)高二年级期末考化学试题 命题人: 可能用到的相对原子质量:H 1 C 12 O 16 S 32 一、 单选题(每小题3分,共54分) 1. 下列说法中错误的是( ) A.港珠澳大桥钢筋表面的环氧树脂涂层属于合成高分子材料 B.氨基酸残基在蛋白质肽链中的排列顺序为蛋白质的一级结构 C.“碳海绵”吸收泄露的原油时发生了化学变化 D.纤维素与浓硝酸在一定条件下反应可以得到硝化纤维 2.类比推理是化学中常用的思维方法,下列推理正确的是( ) A.乙醇、苯酚中都有羟基,推测两种有机物都可以与氢氧化钠反应。 B.苯不能使酸性高锰酸钾褪色,推测甲苯也不能使酸性高锰酸钾褪色 C.Cl2与NaOH常温下反应得到NaClO,推测F2与NaOH常温下反应得到NaFO D.溴乙烷与氢氧化钠的醇溶液在加热时反应可以生成乙烯,推测溴丙烷可以与氢氧化钠的醇溶液在加热时能生成丙烯。 3.有机化合物萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是 A.a和b均属于苯的同系物 B.a和b分子中所有碳原子均处于同一平面上 C.a和b均能使酸性KMnO4溶液褪色 D.1mol a物质与足量氢气加成,消耗的氢气为5mol 4.设NA为阿伏加德罗常数的值,下列说法不正确的是 A.将3.4g H2S全部溶于水,所得溶液中HS-和S2-离子数之和为0.1NA B.常温下1LpH=2的H3PO4溶液中含有的H+数目为0.01NA C.将含有0.1molFeCl3的饱和溶液制成Fe(OH)3胶体,胶粒的数目小于0.1NA D.400℃,1.01×105Pa,密闭容器中64gSO2与16g O2充分反应后,分子总数大于NA 5.下列离子方程式正确的是( ) A.硫酸铝溶液中加入过量氨水:Al3++4OH-===AlO2-+2H2O B.二氧化硫与酸性高锰酸钾溶液反应: C.溶液与稀反应的离子方程式: D.硫酸铜溶液中加少量的铁粉: 6. 短周期元素W、X、Y、Z的原子序数依次增加,W—与Ne具有相同的电子层结构,X的族序数等于周期数,Y与Z最外层电子数之和为10。下列说法不正确的是 A.原子半径:X>Y>Z>W B.W的单质可以与水反应产生氧气 C.气态氢化物的稳定性:W> Y > Z D.简单离子半径大小:Z>W>X 7. 下列有关电解质溶液的说法正确的是 A.同温度下,CH3COONH4溶液显中性,所以CH3COONH4不水解。 B.在室温下稀释两种酸时pH变化如右图,其中HX为弱酸,且a点与b点的数值相同 C.25℃时,等体积pH=3的HA和HB两种酸分别与足量的锌充分反应后,HA与Zn反应生成的氢气更多,HA是弱酸 D.若常温下,pH=3的HA溶液中水电离出的c(H+)为10-11mol·L-1,则能证明HA为弱酸。 8.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( ) A.该温度高于25℃ B.由水电离出来的H+的浓度是1.0×10-10mol·L-1 C. NaHSO4晶体的加入抑制了水的电离 D.若向纯水中加入Na2S固体,抑制了水的电离 9. 下表是25℃时弱酸的电离平衡常数,下列说法正确的是 CH3COOH HClO H2CO3 Ka=1.8×10—5 Ka=3.0×10—8 Ka1=4.1×10—7 Ka2=5.6×10—11 A.根据上图可知,相同浓度CH3COONa和NaClO的混合溶液中,各种离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+) B.根据上图可知,次氯酸钠溶液中通入少量CO2的离子方程式为:2ClO﹣+CO2+H2O=CO32﹣+2HClO C.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中减小 D.室温下,将碳酸钠溶液加热至70℃,溶液的中的OH—数目增多 10. 在一个固定容积的密闭容器中,可逆反应:mA(g)+nB(g) ⇋pC(g)+qD(g)中,当m、n、p、q为任意正整数时,达到平衡的标志是( ) A.气体分子的平均摩尔质量不再发生变化时 B.各组分的物质的量浓度不再改变 C.A与C的质量分数相等 D.反应速率vA∶vB∶vC∶vD=m∶m∶p∶q 11.下列能用勒夏特列原理解释的是( ) A.工业合成氯化氢时氢气过量 B.高温及加入催化剂都能使合成氨的反应速率加快 C.H2、I2、HI平衡时的混合气体加压后颜色变深 D.向饱和NaCl溶液中通入HCl,有晶体析出 12.三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g) SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。下列叙述正确的是 A.正反应方向为放热反应 B.反应速率大小:va < vb C.70 ℃时,平衡常数K =0.112/0.782 D.增大压强,可以提高SiHCl3的平衡转化率,缩短达平衡的时间 13. 羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡: CO(g)+H2S(g) COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是 A.CO的平衡转化率为20% B.升高温度,H2S浓度增加,表明该反应是吸热反应 C.反应前H2S物质的量为8mol D.通入CO后,正反应速率逐渐增大 14.下列实验中可能失败的是 ①为检验RX是碘代烷,将RX与NaOH水溶液混合加热后加AgNO3溶液 ②为检验Fe(NO3)2样品是否变质取少量样品溶于稀硫酸,滴入KSCN溶液,溶液变红色,证明样品已变质 ③用锌和稀硝酸反应制取氢气用排水法收集氢气 ④实验室制备硝基苯,加人试剂的顺序为:先加入浓硝酸,再滴加苯,最后滴加浓硫酸 ⑤用苯和溴水在FeBr3催化下可制得溴苯 A.①④ B.①②③④⑤ C.②③④ D.③⑤ 15.下列有关同分异构体的说法正确的是( ) A.分子式为C5H10O2的有机物中含有结构的同分异构体有12种 B.2-氯丁烷(CH3CHClCH2CH3)与NaOH乙醇溶液共热,得到三种烯烃。 C.有机物的同分异构体中,其中属于酯且苯环上有2个取代基的同分异构体有2种。 D.甲醇在铜催化和加热条件下生成的产物不存在同分异构体。 16. 下列有关实验方法和结论都正确的是( )。 A.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液 B.检验蔗糖水解产物具有还原性:在蔗糖水解后的溶液中先加入适量稀NaOH溶液中和,再加入新制的银氨溶液并水浴加热 C.图中酸式滴定管读数为12.20 mL D.若用已知浓度的KMnO4溶液去测定某溶液中Fe2+浓度,KMnO4溶液放在碱式滴定管中 17. 常温下,用浓度为的盐酸分别逐滴加入到的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示.下列说法正确的是( ) A.时,溶液中微粒浓度的关系是: B.将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,溶液中离子浓度的关系是: C.时,溶液中微粒浓度的关系是: D.时,不可能存在: 18. 25℃,将浓度均为0.1mol/L的HA溶液Va mL和BOH溶液Vb mL混合,保持Va+Vb=100mL,生成物BA易溶于水。Va、Vb与混合液pH的关系如下图。下列叙述错误的是 A.HA一定是弱酸 B.BOH可能是强碱 C.z点时,水的电离被促进 D.x、y、z点时,溶液中都存在c(A-)+c(OH-)=c(B+)+c(H+) 二、填空题(共4小题,46分) 19. (10分)以软锰矿粉末(主要成分MnO2,还含有Al2O3、Fe2O3等杂质)为原料制MnSO4·H2O的工艺流程如下: 已知:pH>3.3后溶液不存在Fe3+,pH>5.0后溶液不存在Al3+,pH>8后Mn2+开始沉淀。 (1)保持其他条件不变,在不同温度下对含软锰矿粉进行酸浸,锰浸出率随时间变化如图。酸浸的最佳温度与时间分别为________℃、______min。 (2)“酸浸”时,会将Fe2+氧化至Fe3+,所发生的反应离子方程式为 (3)酸浸时要加入硫酸,硫酸浓度不能过大或者过小。当硫酸浓度过小时,酸浸会有红褐色残渣出现,原因是 。 (4)MnSO4在水中的溶解度与温度关系如图。由MnCO3获得较纯净的MnSO4•H2O 晶体的方法是:将MnCO3溶于_________,控制温度为_________以上结晶,得到MnSO4•H2O晶体,洗涤、烘干。 20. (10分)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验: (实验原理)2KMnO4 + 5H2C2O4 + 3H2SO4 = K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O (实验内容及记录) 实验编号 室温下,试管中所加试剂及其用量 / mL 室温下溶液颜色褪至无色所需时间 / min 0.6 mol/L H2C2O4溶液 H2O 3 mol/L 稀硫酸 0.05mol/L KMnO4溶液 1 3.0 2.0 2.0 3.0 1.5 2 2.0 3.0 2.0 3.0 2.7 3 1.0 4.0 2.0 3.0 3.9 请回答: (1)根据上表中的实验数据,可以得到的结论是___________________________________。 (2)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。 该小组同学提出的假设是___________________________________________________。 (3)测血钙的含量时,进行如下实验: ①可将4mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。 ②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。 ③终点时用去20mL l.0×l0-4mol/L的KMnO4溶液。 Ⅰ、滴定终点的现象是_________________________________。 II下列操作会导致测定结果偏低的是______。 A.锥形瓶用待测草酸溶液润洗 B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出 C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡 D.达到滴定终点时,仰视读数 Ⅱ、计算:血液中含钙离子的浓度为______mol/L。 21.(14分)碳是构成物质世界最重要的元素之一,能形成众多的化合物。 已知碳完全燃烧可放出3148kJ热量,液态水汽化时要吸收44kJ热量。 请写出制备水煤气的热化学方程式_______________________。 (2)为研究 CO2 与 CO 之间的转化。让一定量的 CO2 与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g) ⇋2CO(g) ∆H。 测得压强、温度对 CO 的体积分数(φ(CO)%)的影响如图所示: 回答下列问题: ① p1、p2、p3 的大小关系是__________,图中 a、b、c 三点对应的平衡常数大小关系是__________(用 Ka、Kb、Kc 表示)。 ②一定条件下,CO2(g)+3H2(g) ⇋CH3OH(g)+H2O(g) ΔH3,向固定容积为1 L的密闭容器中充入2 mol CO2和6 mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数K =_________(用分数表示);若开始时充入2 mol CH3OH(g) 和2 mol H2O(g)达到相同平衡状态时,CH3OH的转化率为_______;若平衡后再充入4 mol的N2,则c(CO2)和原平衡比较是_________。(填“增大”、“减小”、“不变”) 22.(12分)化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下: 回答下列问题: (1)A的结构简式为_______。 (2)D分子中最多有_____个碳原子共平面,与D化学式相同且符合下列条件的同分异构体有_______种。(①与D具有相同的官能团,②苯环上的三元取代物) (3)⑤的化学方程式为________。 (4)参照上述合成路线,若要合成最终产物为有机物,需要 和 两种有机物通过一步反应制得。(在横线上写出有机物的结构简式) 高二化学答案 CDCAB CCDDB DCABD BBC 19. 70℃(1分) 120min (1分) 生成的Fe3+水解得到Fe(OH)3沉淀(2分) 2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O (2分)适量的稀硫酸(2分) 90℃(2分) 20.(1)其他条件相同时,增大H2C2O4浓度(或反应物浓度),反应速率增大(2分) (2).生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用)(2分) (3). 当滴入最后一滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不褪色(2分)BC(2分) 1. 25×10-3 (2分) 21. (1)C(S)+H2O(g)==CO(g)+H2(g) ΔH=+131.3 kJ·mol-1 (3分) (2)p1查看更多
相关文章
- 当前文档收益归属上传用户