- 2021-07-07 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
陕西省渭南市大荔县2019-2020学年高二下学期转段(期末)考试化学试题
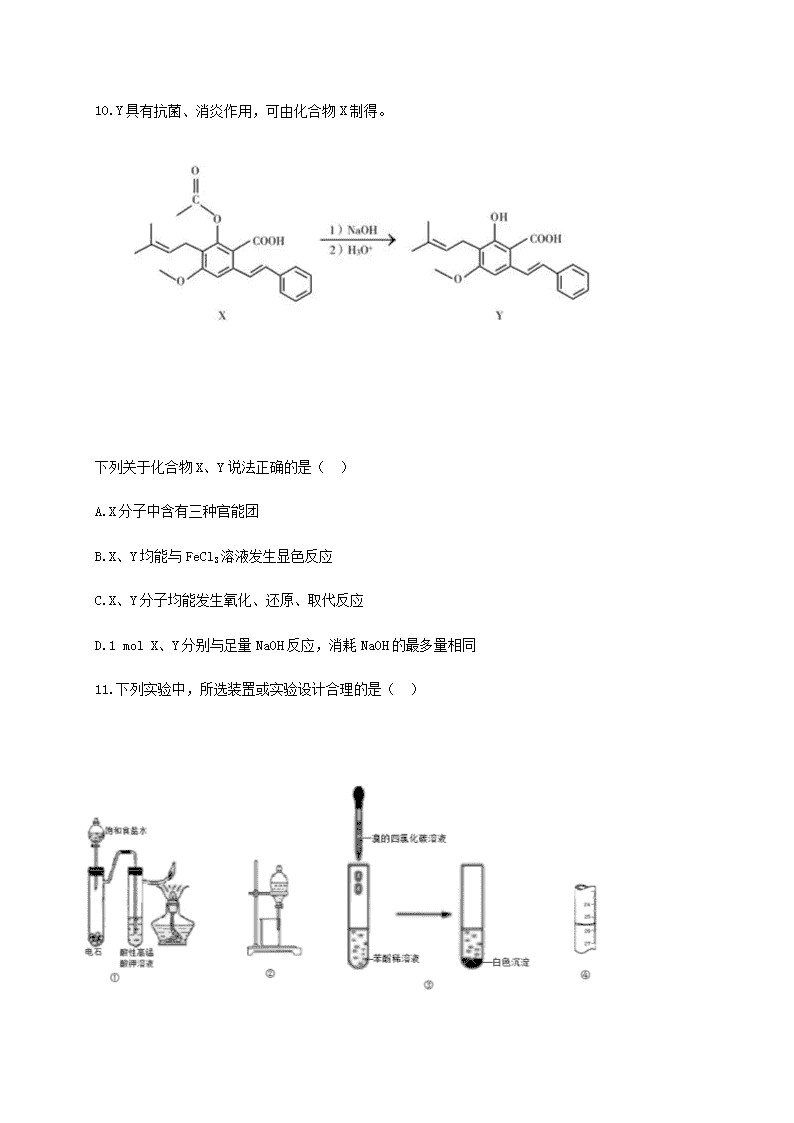
2020年高二转段考试化学试题 可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 I 127 第I卷(共42分) 一、 选择题(本题共14小题,每小题3分,共42分。每小题只有一个选项符合题意。) 1.我国毛笔的制作技艺属于国家非物质文化遗产,相传古人制作该毛笔的过程为“以枯木为管,鹿毛为柱,羊毛为被(外衣)”,则下列说法正确的是( ) A. 枯木的主要成分蛋白质 B. 鹿毛、羊毛均只含有C、H、O三种元素 C. 枯木、鹿毛的主要成分互为同分异构体 D. 采用灼烧法可以区分枯木、毛笔的“外衣” 2.下列有关说法不正确的是( ) A.太阳能以光和热的形式传送到地面,人们可以直接利用这些光和热 B.反应热就是化学反应中放出的能量 C.煤中含有硫元素,大量直接燃烧煤会引起酸雨等环境问题 D.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 3.汽油的主要成分为辛烷,25℃、101KPa时,5.7g辛烷完全燃烧时,放出热量275.9KJ,则辛烷燃烧热的热化学方程式为( ) A.C8H18(l)+12.5O2(g)===8CO2(g)+9H2O(l)△H=-5518KJ•mol﹣1 B.2C8H18(l)+25O2(g)===16CO2(g)+18H2O(l)△H=-5518KJ•mol﹣1 C.C8H18(l)+12.5O2(g)===8CO2(g)+9H2O(l)△H=+5518KJ•mol﹣1 D.C8H18(l)+12.5O2(g)===8CO2(g)+9H2O(g)△H=-5518KJ•mol﹣1 4.已知反应A2(s)+2B2(g) ⇌2AB2(g) ΔH<0,下列说法正确的是( ) A.降低温度,正反应速率增加,逆反应速率减小 B.达到平衡后,升高温度或增大压强,重新达平衡时,平衡常数不发生变化 C.升高温度有利于反应速率增加,从而缩短达到平衡的时间 D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 5.一定量盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( ) ①NaOH固体 ②KNO3溶液 ③水 ④CH3COONa固体 A. ①③ B. ②④ C. ②③ D. ③④ 6.常温下,关于pH相同的氨水和氢氧化钠溶液,下列说法正确的是( ) A.c(NaOH)>c(NH3·H2O) B.c(NH4+)= c(Na+)= c(OH-) C.两种溶液中水的电离程度相同 D.等体积的氨水和氢氧化钠溶液分别与相同浓度的盐酸完全中和时,消耗的盐酸体积相同 7.下列有关的叙述合理的是( ) A.铜的精炼工业和电镀铜工业,均可采用CuSO4溶液做电解质溶液 B.明矾可用于自来水的净化和杀菌消毒 C.水库的钢闸门与电源负极相连以防止其生锈,该法即牺牲阳极的阴极保护法 D.测定醋酸钠溶液pH的方法是用玻璃棒蘸取溶液,点在湿润的pH试纸上 8. 下列表示方法正确的是( ) A. 乙烷分子的最简式:CH3 B. 醋酸的结构式:CH3COOH C. CCl4的球棍模型: D.羟基的电子式: 9.下列各种物质中,能用酸性高锰酸钾溶液鉴别的是( ) A. 乙烯、乙炔 B. 1-己烯、苯乙烯 C. 苯、环己烷 D. 乙苯、苯甲酸 10.Y具有抗菌、消炎作用,可由化合物X制得。 下列关于化合物X、Y说法正确的是( ) A.X分子中含有三种官能团 B.X、Y均能与FeCl3溶液发生显色反应 C.X、Y分子均能发生氧化、还原、取代反应 D.1 mol X、Y分别与足量NaOH反应,消耗NaOH的最多量相同 11.下列实验中,所选装置或实验设计合理的是( ) A.用图①所示装置可以检验乙炔的生成 B.用图②所示装置可以分离乙酸乙酯和饱和碳酸钠的混合溶液 C.用图③所示装置检验苯酚存在 D.图④滴定管中读数为26.50mL 12.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是( ) A.向圆底烧瓶中滴加苯和溴的混合液前需先打开K B.实验中装置b中的液体逐渐变为浅红色 C.装置c中的碳酸钠溶液的作用是吸收溴化氢 D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯 13.下列叙述中,正确的一组是( ) ①糖类、油脂、蛋白质在一定条件下都能发生水解 ②制造婴儿用的一次性纸尿片采用的吸水保水的材料可以是 ③石油的分馏、裂化和煤的干馏都是化学变化 ④葡萄糖与果糖、淀粉与纤维素均互为同分异构体 ⑤淀粉遇碘酒变蓝色,葡萄糖能与新制Cu(OH)2发生反应 ⑥塑料、橡胶和纤维都是合成高分子材料 ⑦向蛋白质溶液中加入饱和CuSO4溶液,出现沉淀,加水沉淀溶解 ⑧将溴丙烷与NaOH溶液混合共热, 再滴加硝酸银溶液有沉淀生成,可证明溴丙烷与NaOH溶液发生了反应 A. ①⑤⑦ B. ②⑤ C. ③④⑥ D. ②⑥⑧ 14. 下列叙述中,正确的一组是( ) A.获得诺贝尔生理学奖屠呦呦女士用乙醚从黄花蒿中提取青蒿素,该技术应用了萃取原理 B.研究发现DHA是生成大脑细胞的物质基础,鱼油中含有DHA(二十二碳六烯酸),DHA与乙酸互为同系物 C.医用酒精可以消毒,是由于酒精能够与细菌、病毒中的蛋白体发生氧化反应 D.提纯粗苯甲酸的实验中,加热溶解后,除去不溶性杂质时采用充分冷却后过滤 第II卷(共58分) 15.(9分)聚乙烯醇为常见的滴眼液的主要成分,其生产过程中会产生大量副产物 乙酸甲酯。用副产物乙酸甲酯催化醇解反应可制备甲醇和乙酸己酯,该反应的化学方程式为: CH3COOCH3(l)+C6H13OH(l)CH3COOC6H13(l)+CH3OH(l) ; ΔH 已知:v正= k正χ(CH3COOCH3)•χ(C6H13OH),v逆= k逆χ(CH3COO C6H13)•χ(CH3OH),其中v正、v逆 为正、逆反应速率,k正、k逆为速率常数,χ为各组分的物质的量分数。 (1) 反应开始时,已醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如下图所示。 348K指的是曲线_______(填“①”“②”或“③”),判断的理由是_________;该醇解反应的ΔH_________0(填“>”或“<”)。 (2)338K时,以物质的量分数表示的化学平衡常数Kx=________;A、B、C、D四点中,v正最大的是_______,v逆最大的是_______。 (3)343K时,将己醇和乙酸甲酯按物质的量之比1:1、1:2和2:1做为 初始投料。则达到平衡后,初始投料比_______时,乙酸甲酯转化率最大。 (4)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是______。 a. 参与了醇解反应,但并不改变反应历程 b. 使k正和k逆增大相同倍数 c. 降低了醇解反应的活化能 d. 提高乙酸甲酯的平衡转化率 16.(12分)Na2SO3、NaHSO3、Na2S2O5可用于食品工业的漂白剂、防腐剂、抗氧化剂。已知:1mol•L﹣1Na2SO3溶液的pH≈9;1mol•L﹣1NaHSO3溶液的pH≈5。 (1) NaHSO3溶液的pH≈5的原因是 (用化学用语并结合文字说明回答)。 (2)甲同学结合微粒观,应用所学知识,设计了如图所示实验,发现闭合开关后灵敏电流计指针发生偏转。 则:①a电极为 (填“正极”或“负极”); 电极反应式为: 。 ②取少量Na2SO3溶液电极附近的混合液,加入 ,产生白色沉淀,证明产生了SO42-。 (3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3,则阳极的电极反应式为_____________。电解后,_____________室的NaHSO3浓度增加。 (4)乙同学测定市面上某干红葡萄酒中Na2S2O5残留量,取50.00 mL葡萄酒样品于锥形瓶中,用装有0.010 mol·L−1碘标准液的_________(填“酸式”或“碱式”)滴定管滴定至终点,消耗标准液10.00 mL。该样品中Na2S2O5的残留量为____________g·L−1(以SO2计)。(已知:S2O52-+2I2+3H2O 2SO42-+4I-+6H+) 17.(7分)按要求完成下列各题。 (1) 是辣椒素中影响辣椒辣味的活性成分的其中一种分子的结构,其含有的官能团有_______种;含氧官能团的名称是________。 (2)有机物CH3CH(C2H5)CH(CH3)2的名称是________。 (3)为了测定芳香烃A的结构,做如下实验: ①将9.2g该芳香烃A完全燃烧,生成标况下15.68L CO2和7.2gH2O; ②用质谱仪测定其相对分子质量,得如图所示的质谱图,由图可知该分子的相对分子质量是________,则有机物A的分子式为________。 ③用核磁共振氢谱测得该有机物有四个峰,且四个峰的面积之比是1∶2∶2∶3,则该有机物A的结构简式为________。 18.(9分)丙炔酸甲酯( CH≡C-COOCH3 )是一种重要的有机化工原料,沸点为103℃。实验室制备少量丙炔酸甲酯的反应为: 实验步骤如下: 步骤1:在反应瓶中加入14 g丙炔酸、50 mL甲醇和2 mL浓硫酸,搅拌加热回流一段时间; 步骤2:蒸出过量的甲醇(装置见下图); 步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤,分离出有机相; 步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得7.56g丙炔酸甲酯。 (1)步骤1中,加入过量甲醇的目的是________。 (2)步骤2中,上图所示的装置中仪器A的名称是________,自来水从________(填“e”或“f”)进入该仪器;加入碎瓷片的目的是________。 (3)步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是________;分离出有机相的操作名称为________。 (4)步骤4中,蒸馏时不能用水浴加热的原因是________。 (5)丙炔酸甲酯的产率为________。 19.(9分)有机物M可由A(C2H4)按如图路线合成: 已知:①RCHO+CH3CHO →△NaOH/H2O RCH=CHCHO+H2O; ②同一个碳原子上连有两个羟基的有机物不稳定,易脱水形成羰基。 ③C、F均能发生银镜反应。 回答下列问题: (1)B中含有官能团的名称是________。 (2)③的反应类型是________。 (3)反应②的化学方程式是________。 (4)G的结构简式是________。 (5)分子式为C9H12且是D的同系物的同分异构体共有________种。 (6)参照上述合成路线,设计以C为原料制备高吸水性树脂 的合成路线(无机试剂任选)。________ 20.(12分)瑞德西韦在临床上用于对于新冠肺炎的治疗有一定的疗效。下图是合成该药的中间体M的合成路线。 回答下列问题: (1)A 的名称为 ;乳酸生成物质E的反应类型是 。 (2)E中含有的官能团的名称 。 (3)反应物质A生成物质B中加入CH3COCl的目的是 。 (4)反应物C生成D的化学方程式为 。 (5)符合下列条件的B的同分异构体有 种。 ①能与FeCl3溶液显色 ②能发生银镜反应 其中苯环上的一氯代物有两种的物质的结构简式为 。 DBACDCAADCBDBA 15.(9分)(1)①(1分) ,因为①反应达平衡的时间短,说明反应速度快,温度高(1分) 。> (1分) (2) 1(1分) ; A(1分) 、 C(1分) (3)2:1 (1分) (4)bc(2分) 16. (12分)(1)NaHSO3溶液存在HSO3-H++SO32-的电离平衡和HSO3-+H2OH2SO3+OH-的水解平衡,电离平衡大于水解平衡而显酸性。(2分) (2)正极;(1分)Fe3++e-=Fe2+;(2分)足量盐酸和BaCl2溶液(1分) (3)2H2O-4e-4H++O2↑ (2分) m (1分) (4)酸式(1分),0.128(2分) 17.(7分)(1)4(1分);醚键、羟基、肽键;(2分) (2)2,3-二甲基戊烷(1分)(3) 92(1分);C7H8;(1分)甲苯(1分) 18.(9分) (1)作为溶剂、提高丙炔酸的转化率(1分) (2)(直形)冷凝管;(1分)f;(1分)防止暴沸(1分) (3)丙炔酸;(1分) 分液(1分) (4)丙炔酸甲酯的沸点比水的高 (1分) (5)45%(2分) 19(9分)(1)羟基或(2)取代 (3)2CH3CH2OH+O2 →△Cu 2CH3CHO+2H2O (4)(5)8(6) 20.(12分)(1)苯酚;(1分)取代(1分) (2)溴原子、羧基;(2分) (3)保护羟基不在苯环上引入硝基时被混酸氧化(2分) (4)(2分) (5)13(2分);(2分)查看更多