- 2021-07-07 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】河北省肃宁县第一中学2019-2020学年高二上学期第三次月考试题
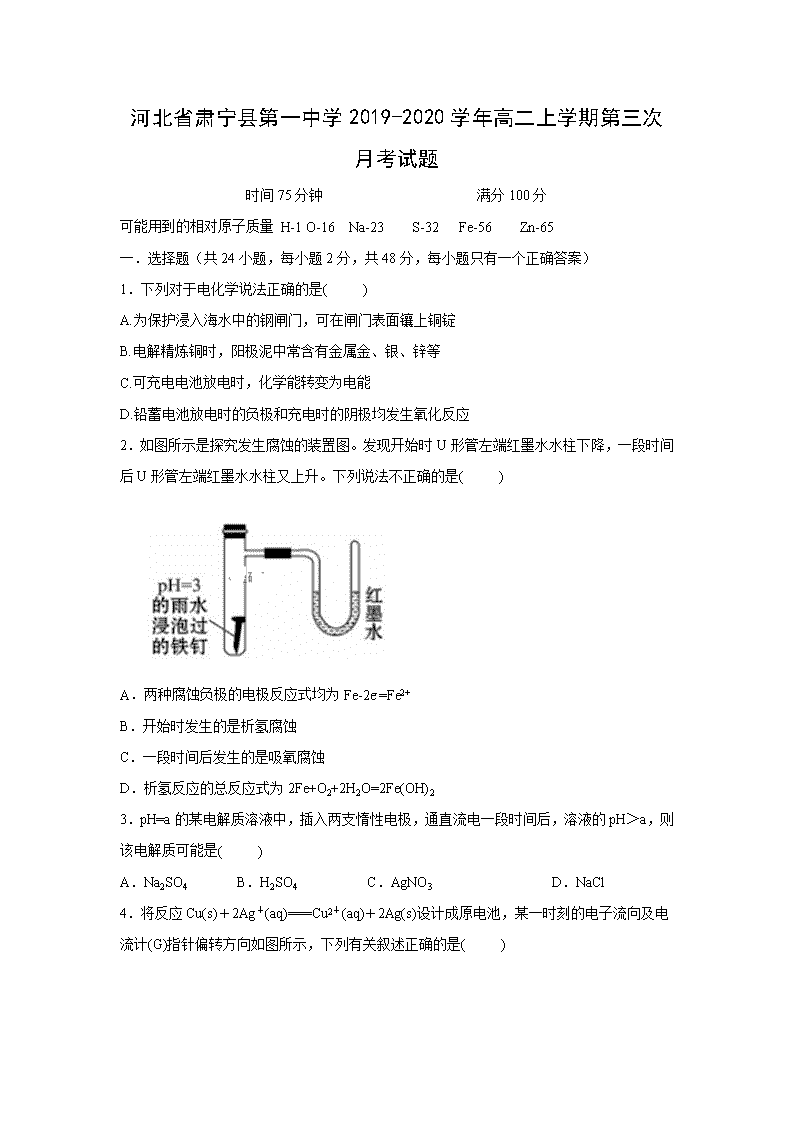
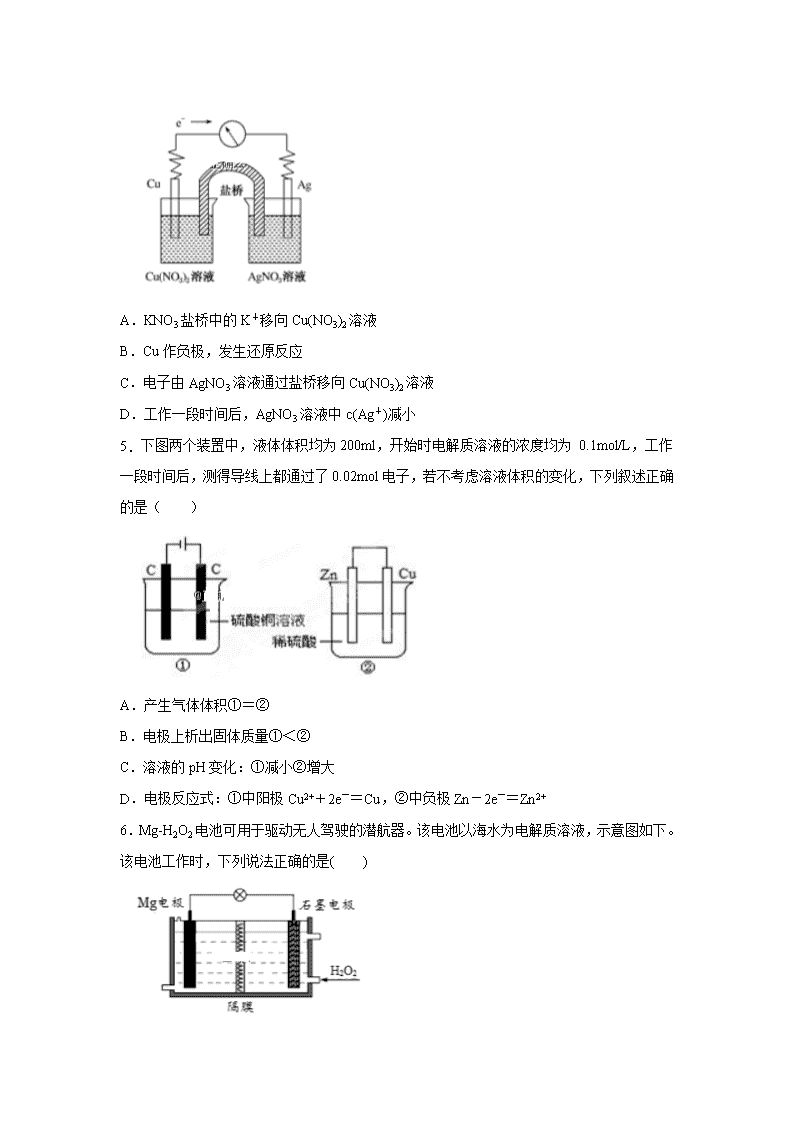
河北省肃宁县第一中学2019-2020学年高二上学期第三次月考试题 时间75分钟 满分100分 可能用到的相对原子质量 H-1 O-16 Na-23 S-32 Fe-56 Zn-65 一.选择题(共24小题,每小题2分,共48分,每小题只有一个正确答案) 1.下列对于电化学说法正确的是( ) A.为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭 B.电解精炼铜时,阳极泥中常含有金属金、银、锌等 C.可充电电池放电时,化学能转变为电能 D.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 2.如图所示是探究发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法不正确的是( ) A.两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+ B.开始时发生的是析氢腐蚀 C.一段时间后发生的是吸氧腐蚀 D.析氢反应的总反应式为2Fe+O2+2H2O=2Fe(OH)2 3.pH=a的某电解质溶液中,插入两支惰性电极,通直流电一段时间后,溶液的pH>a,则该电解质可能是( ) A.Na2SO4 B.H2SO4 C.AgNO3 D.NaCl 4.将反应Cu(s)+2Ag+(aq)===Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( ) A.KNO3盐桥中的K+移向Cu(NO3)2溶液 B.Cu作负极,发生还原反应 C.电子由AgNO3溶液通过盐桥移向Cu(NO3)2溶液 D.工作一段时间后,AgNO3溶液中c(Ag+)减小 5. 下图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为 0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol电子,若不考虑溶液体积的变化,下列叙述正确的是( ) A.产生气体体积①=② B.电极上析出固体质量①<② C.溶液的pH变化:①减小②增大 D.电极反应式:①中阳极Cu2++2e-=Cu,②中负极Zn-2e-=Zn2+ 6.Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( ) A.Mg电极是该电池的正极 B.溶液中的Cl-向正极移动 C.H2O2在石墨电极上发生氧化反应 D.石墨电极附近溶液的pH增大 7.下列有关热化学方程式的叙述正确的是( ) A.已知2C(s)+O2(g)═2CO(g)△H=-221kJ/mol,则C的燃烧热为110.5kJ/mol B.已知3O2(g)= 2O3(g) △H=+242.4kJ•mol-1,则臭氧比氧气稳定 C.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ/mol D.甲烷的标准燃烧热△H=-890.3 kJ•mol-1,则CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H<-890.3 kJ•mol-1 8.下列有关化学反应速率的说法正确的是( ) A.100 mL 1 mol·L-1 的硫酸跟锌片反应,加入适量的硫酸钠溶液,反应速率不变 B.SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢 C.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 D.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 9.下列不能用勒夏特列原理解释的事实是( ) A.氯水中有下列平衡:Cl2+H2OHCl+HClO,光照后氯水颜色变浅 B.合成氨工业使用高压以提高氨的产量 C.对于H2(g)+I2(g)2HI(g),达平衡后,缩小容器体积可使体系颜色变深 D.汽水型饮料打开瓶盖后产生大量气体 10.已知“凡气体分子总数增加的反应都是熵增大的反应”。下列反应中,在任何温度下都不自发进行的是( ) A.2O3(g)=3O2(g) △H<0 B.2CO(g)=2C(s)+O2(g) △H>0 C.N2(g)+3H2(g)=2NH3(g ) △H<0 D.CaCO3(s)=CaO(s)+CO2(g) △H>0 11.某温度下,体积一定的密闭容器中进行如下反应:X(g)+Y(g)Z(g)+W(s) ΔH>0,下列叙述不正确的是( ) A.在容器中加入氩气,反应速率不变 B.加入少量W,逆反应速率不变 C.升高温度,正反应速率增大,逆反应速率减小 D.将容器的体积压缩,可增大单位体积内活化分子数,有效碰撞次数增大 12.低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是( ) A.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡 B.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 C.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 13.下列关于化学反应速率的说法正确的是( ) ①有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子数目,从而使反应速率增大。 ②其他条件不变,温度越高,化学反应速率越快。 ③6mol·L﹣1·s﹣1的反应速率一定比3.5mol·L﹣1·s﹣1的反应速率大。 ④升高温度能增大反应物分子中活化分子的百分数。 ⑤恒温时,增大压强,化学反应速率一定加快。 ⑥增大反应物浓度,可增大活化分子的百分数,从而使单位时间有效碰撞次数增多。 A.①②⑤ B.②④ C.②⑤ D.③ ⑥ 14.NH4HS(s)NH3(g)+H2S(g)在一定温度下达到平衡,下列情况不能使平衡发生移动的是( ) A.温度、容积不变,充入NH3 B.温度、容积不变时,充入SO2气体 C.充入N2,保持压强不变 D.移走一部分NH4HS固体 15.在一定温度下,容积一定的密闭容器中发生反应A(s)+2B(g)C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是( ) ①混合气体的密度 ②混合气体的压强 ③B的物质的量浓度 ④混合气体的总物质的量 A.①② B.②③ C.①③ D.①④ 16.只改变一个影响因素,平衡常数K与平衡移动的关系叙述不正确的是( ) A.K值不变,平衡可能移动 B.平衡向右移动时,K值不一定移动 C.K值有变化,平衡一定移动 D.相同条件下,同一个反应的方程式的化学计量数增大2倍,K值也增大两倍 17.对于可逆反应2AB3(g)2A(g) + 3B2(g) ΔH>0。下列图象不正确的是( ) A. B. C. D. 18.以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备 Fe(OH)2,装置如图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。则下列说法正确的是( ) A.石墨电极Ⅱ处的电极反应式为O2+4e-===2O2- B.X是铁电极 C.电解池中有1mol Fe溶解,石墨Ⅰ耗H2 22.4 L D.若将电池两极所通气体互换,X、Y两极材料也互换,实验方案更合理。 19.联氨(N2H4)常温下为无色液体,可用作火箭燃料。下列说法不正确的是( ) ①2O2(g)+N2(g)=N2O4(l) ΔH1 ②N2(g)+2H2(g)=N2H4(l) ΔH2 ③O2(g)+2H2(g)=2H2O(g) ΔH3 ④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=﹣1048.9 kJ·mol−1 A.O2(g)+2H2(g)=2H2O(l) ΔH5,ΔH5>ΔH3 B.ΔH4=2ΔH3﹣2ΔH2﹣ΔH1 C.1 mol O2(g)和2 mol H2(g)具有的总能量高于2 mol H2O(g) D.联氨和N2O4作火箭推进剂的原因之一是反应放出大量的热 20.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn +2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+ 4KOH,下列叙述不正确的是( ) A.放电时负极反应为:Zn – 2e-+ 2OH- = Zn(OH)2 B.充电时阴极反应为:Fe(OH)3- 3e-+ 5OH- = FeO42-+ 4H2O C.放电时每转移3mol电子,正极有1mol K2FeO4被还原 D.放电时正极附近溶液的碱性增强 21.在t ℃下,某反应达到平衡,平衡常数 。恒容时,温度升高,NO浓度减小。下列说法正确的是( ) A.该反应正反应的焓变为正值 B.恒温下扩大容器体积,反应体系的颜色加深 C.升高温度,逆反应速率减小 D.该反应化学方程式为NO2+SO2 NO+SO3 22.下列有关图示实验的说法正确的是( ) A.①装置中阴极处产生的气体能够使湿润的KI—淀粉试纸变蓝 B.②装置中待镀铁制品应与直流电源正极相连 C.③装置中电子由b极流向a极 D.④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 23.图Ⅰ是NO2(g)+CO(g) CO2 (g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。 下列有关说法正确的是( ) A.一定条件下,向密闭容器中加入1 mol NO2(g)与1 mol CO(g)反应放出234 kJ热量 B.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 C.若X表示温度,则Y表示的可能是CO2的物质的量浓度 D.若X表示反应时间,则Y表示的可能是混合气体的密度 24.下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示( ) 下列说法正确的是( ) A.△H1<0,△H2>0 B.反应①②③的反应热满足关系:△H2-△H1=△H3 C.反应①②③的平衡常数满足关系;K1·K2=K3 D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施 二.非选择题(共5小题,52分) 25.(11分)利用下图装置测定中和热的实验步骤如下: ①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度; ②量取50mL 0.55mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。 请回答: (1)如图所示,仪器A的名称是_______________; (2)NaOH溶液稍过量的原因 ______________。 (3)加入NaOH溶液的正确操作是_______(填字母)。 A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入 (4)使硫酸与NaOH溶液混合均匀的正确操作是 _________________________。 (5)实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)______ a.实验装置保温、隔热效果差 b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中 c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 26.(15分)按要求填空 (1)对于Fe+2HCl===FeCl2+H2↑,改变下列条件对生成氢气的速率有何影响?(填“增大”、“减小”或“不变”) ①升高温度:________; ②增加盐酸体积:____________; ③加入等体积的NaCl溶液:__________; ④滴入几滴CuSO4溶液:____________; (2)一定温度下,反应N2(g)+O2(g) ===2NO(g)在密闭容器中进行,回答下列措施对化学反应速率的影响。(填“增大”、“减小”或“不变”) ①缩小体积使压强增大:__________;②恒容充入N2:__________; ③恒压充入He:__________。 (3)在恒温恒容条件下,可逆反应A(g)+B(g) C(g)+D(g)。判断该反应是否达到平衡的依据为__________(填正确选项前的字母) a.压强不随时间改变 b.气体的密度不随时间改变 c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等 (4)一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示: ①从反应开始到10 s时,用Z表示的反应速率为________,X的物质的量浓度减少了________,Y的转化率为________。 ②该反应的化学方程式为_________________________________________。 27. (14分) (一).一密封体系中发生下列反应:N2+3H22NH3 ΔH<0,下图是某一时间段中反应速率与反应进程的曲线关系图: 回答下列问题: (1)处于平衡状态的时间段是___________、___________、___________。 (2)t1、t3、t4时刻体系中分别是什么条件发生了变化:____________、___________、___________。 (3)下列各时间段时,氨的百分含量最高的是___________(填序号)。 A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6 (二).830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)CO2(g)+H2(g)△H<0。试回答下列问题: (4)若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____________。 (5)在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1 ,则此时该反应是否达到平衡状态______(填“是”与“否”),此时v(正)____v(逆)(填“大于”“小于”或“等于”)。 28.(12分) 环境监测显示,某地市的主要气体污染物为SO2、NOx、CO等,其主要来源为燃煤、机动车尾气。进行如下研究: (1)为减少燃煤对SO2的排放,可将煤转化为清洁燃料水煤气(CO和H2)。 已知: ΔH=-241.8kJ·mol-1 ΔH=-110.5kJmol-1 写出焦炭与1mol水蒸气反应生成水煤气的热化学方程式:________。 (2)①在101 kPa时,H2(g)在 1.00 mol O2(g)中完全燃烧生成2.00 mol H2O(l)放出571.6 kJ的热量,表示H2燃烧热的热化学方程式为________________________________。 ②1.00 L 1.00 mol·L−1 H2SO4溶液与2.00 L 1.00 mol·L−1 NaOH溶液完全反应,放出114.6 kJ热量,表示其中和热的热化学方程式为____________________________。 (3)利用如图所示装置(电极均为惰性电极)可吸收SO2,并利用阴极排出的溶液吸收NO2。 电极A的电极反应式为________; 【参考答案】 1.C 2.D 3.D 4.D 5.C 6.D 7.C 8.C 9.C 10.B 11.C 12.A 13.B 14.D 15.C 16.D 17.D 18.D 19.A 20.B 21.D 22.D 23.B 24.B 25.(11分)(1)环形玻璃搅拌棒 (2)确保硫酸被完全中和 (3)B (4)用环形玻璃搅拌棒轻轻上下搅动 (5)abc 26.(15分) (1)① 增大 ②不变 ③减小 ④ 增大 (2)①增大 ② 增大 ③减小 (3)c (4)①0.079 mol·L-1·s-1 0.395 mol·L-1 79% ②x(g)+y(g) 2z(g) 27.(14分) (1)t0~t1 t2~t4 t5~t6; (2)升高温度 ,加催化剂 ,降低压强; (3)A (4)1 (5)否 > 28.(12分) (1)C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.3kJ·mol-1 (2)H2(g)+1/2O2(g)=H2O(l)△H=-285.8 kJ/mol 1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l) ΔH=−57.3 kJ·mol−1 (3)SO2+2H2O-2e-=SO42-+4H+ 查看更多