- 2021-07-07 发布 |
- 37.5 KB |
- 33页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017届二轮复习共价键专题练习课件(共33张)(全国通用)(1)
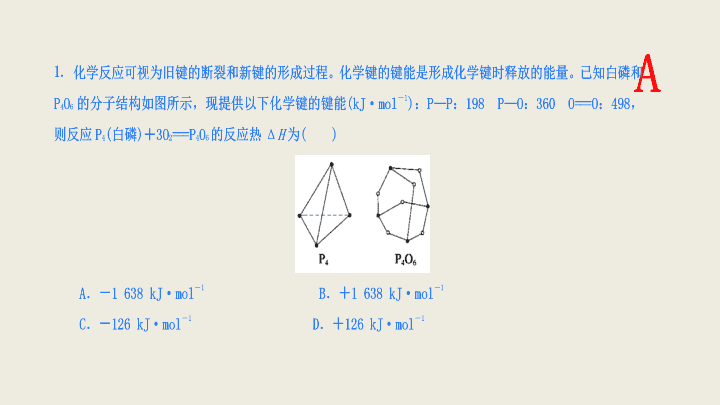
2017 届高考化学二轮总复习 共价键 专题练习 A 【 解析 】 反应中的键能包括:断裂 1 mol P 4 和 3 mol O 2 分子中共价键吸收的能量和形成 1 mol P 4 O 6 中共价键放出的能量。由各物质的分子结构知 1 mol P 4 含 6 mol P—P 键, 3 mol O 2 含 3 mol O===O 键,化学反应的反应热 Δ H =反应物的总键能 — 生成物的总键能。故 Δ H = (198 kJ·mol - 1 ×6 + 498 kJ·mol - 1 ×3) - 360 kJ·mol - 1 ×12 =- 1 638 kJ·mol - 1 。 【 答案 】A 2. 关于键长、键能和键角,下列说法不正确的是 ( ) A .键角是描述分子立体结构的重要参数 B .键长的大小与成键原子的半径和成键数目有关 C .键能越大,键长越长,共价化合物越稳定 D .键角的大小与键长、键能的大小无关 【 解析 】 键长越短,键能越大,共价化合物越稳定, C 项不正确。 【 答案 】C C 3. 能够用键能的大小作为主要依据来解释的是 ( ) A .常温常压下氯气呈气态,而溴单质呈液态 B .硝酸是挥发性酸,而硫酸、磷酸是不挥发性酸 C .稀有气体一般难发生化学反应 D .空气中氮气的化学性质比氧气稳定 【 解析 】 共价分子构成物质的状态取决于分子间作用力的大小,与分子内共价键的键能无关;物质的挥发性与分子内键能的大小无关;稀有气体是单原子分子,无化学键,难发生化学反应的原因是它们的价电子已形成稳定结构;氮气比氧气稳定,是由于 N 2 分子中共价键的键能 (946 kJ·mol - 1 ) 比 O 2 分子中共价键的键能 (497.3 kJ·mol - 1 ) 大,在化学反应中更难断裂。 【 答案 】D D 4. 能够用键能的大小作为主要依据来解释的是 ( ) A. 常温常压下氯气呈气态而溴单质呈液态 B. 硝酸是挥发性酸 , 而硫酸、磷酸是不挥发性酸 C. 稀有气体一般难于发生化学反应 D. 空气中氮气的化学性质比氧气稳定 【 解析 】 共价分子构成物质的状态取决于分子间作用力的大小 , 与分子内共价键的键能无关 ; 物质的挥发性与分子内键能的大小无关 ; 稀有气体是单原子分子 , 无化学键 , 难于发生化学反应的原因是它们的价电子已形成稳定结构 ; 氮气比氧气稳定是由于 N 2 分子中共价键的键能 (946 kJ·mol -1 ) 比 O 2 分子中共价键的键能 (497.3 kJ·mol -1 ) 大 , 在化学反应中更难于断裂。 【 答案 】D D 【 解析 】 根据碳碳双键中含有 1 个 π 键 , 由于 π 键电子云重叠程度小 , 不如 σ 稳定 , 所以双键的键能小于单键键能的 2 倍 , 选项 C 正确。 【 答案 】C C 6. 根据等电子原理,下列各对粒子中,空间结构相似的是 ( ) A . SO 2 与 O 3 B . CO 2 与 NO 2 C . CS 2 与 NO 2 D . PCl 3 与 BF 3 【 解析 】 由题中信息可知,只要算出分子中各原子的最外层电子数之和即可判断。 B 的最外层电子数为 3 ; C 的最外层电子数为 4 ; N 、 P 的最外层电子数为 5 ; O 、 S 的最外层电子数为 6 。 【 答案 】A A 7. 能说明 BF 3 分子中的 4 个原子在同一平面的理由是 ( ) A. 两个键之间夹角为 120° B.B—F 键为非极性共价键 C.3 个 B—F 键的键能相同 D.3 个 B—F 键的键长相等 【 解析 】 当 F—B—F 键角为 120° 时 ,BF 3 分子中的 4 个原子共面且分子构型为平面三角形。分子的空间构型由分子化学键的键长和键角决定。 【 答案 】A A B 9. 已知 N 2 + O 2 ===2NO 为吸热反应, Δ H =+ 180 kJ·mol - 1 ,其中 N ≡ N 、 O===O 键的键能分别为 946 kJ·mol - 1 、 498 kJ·mol - 1 ,则 N—O 键的键能为 ( ) A . 1 264 kJ·mol - 1 B . 632 kJ·mol - 1 C . 316 kJ·mol - 1 D . 1 624 kJ·mol - 1 【 解析 】 180 kJ·mol - 1 = 946 kJ·mol - 1 + 498 kJ·mol - 1 - 2 E N - O ,所以 E N - O = 632 kJ·mol - 1 。 【 答案 】B B 10. 以下说法正确的是 ( ) A .共价化合物内部可能有极性键和非极性键 B .原子或离子间相互的吸引力叫化学键 C .非金属元素间只能形成共价键 D .金属元素与非金属元素的原子间只形成离子键 【 解析 】 全部由共价键形成的化合物是共价化合物,则共价化合物内部可能有极性键和非极性键,例如乙酸、乙醇中, A 正确;相邻原子之间强烈的相互作用是化学键,包括引力和斥力, B 不正确;非金属元素间既能形成共价键,也能形成离子键,例如氯化铵中含有离子键, C 不正确;金属元素与非金属元素的原子间大部分形成离子键,但也可以形成共价键,例如氯化铝中含有共价键, D 不正确。 【 答案 】A A 11. 下列说法正确的是 ( ) A .含有共价键的化合物一定是共价化合物 B .分子中只有共价键的化合物一定是共价化合物 C .由共价键形成的分子一定是共价化合物 D .只有非金属原子间才能形成共价键 【 解析 】 A 项,某些单质如 (H 2 ) 与某些离子化合物如 (Na 2 O 2 ) 也含有共价键, A 错; B 项,分子中只有共价键的化合物一定是共价化合物, B 对; C 项,由共价键形成的分子也可能是非金属单质, C 错; D 项,除非金属原子之间可以形成共价键外,电负性之差小于 1.7 的金属与非金属元素的原子之间也可以形成共价键,故 D 错。 【 答案 】B B 12. 从实验测得不同物质中氧氧之间的键长和键能的数据: 其中 x 、 y 的键能数据尚未测定,但可根据规律性推导键能的大小顺序为 w>z>y>x ;该规律性是 ( ) A .成键的电子数越多,键能越大 B .键长越长,键能越小 C .成键所用的电子数越少,键能越大 D .成键时电子对越偏移,键能越大 B 13. 下列说法中正确的是 ( ) A .分子的结构是由键角决定的 B .共价键的键能越大,共价键越牢固,由该键形成的分子越稳定 C . CF 4 、 CCl 4 、 CBr 4 、 CI 4 中 C—X 键的键长、键角均相等 D . H 2 O 分子中两个 O—H 键的键角为 180° 【 解析 】 分子的结构是由键参数 —— 键角、键长决定的,故 A 项错误;由于 F 、 Cl 、 Br 、 I 的原子半径不同,故 C—X 键的键长不相等, C 项错误; H 2 O 分子中的键角为 105° ,故 D 项也错。 【 答案 】B B 14. 下列事实不能用键能的大小来解释的是 ( ) A . N 元素的电负性较大,但 N 2 的化学性质很稳定 B .稀有气体一般难发生反应 C . HF 、 HCl 、 HBr 、 HI 的稳定性逐渐减弱 D . F 2 比 O 2 更容易与 H 2 反应 【 解析 】 本题主要考查键参数的应用。由于 N 2 分子中存在三键,键能很大,破坏共价键需要很大的能量,所以 N 2 的化学性质很稳定,稀有气体都为单原子分子,分子内部没有化学键,卤族元素从 F 到 I 原子半径逐渐增大,其氢化物中的键长逐渐变长,键能逐渐变小,所以稳定性逐渐减弱。由于 H—F 键的键能大于 H—O 键的键能,所以二者更容易生成 HF 。 【 答案 】B B D 【 解析 】 H 只有一个未成对电子 , 可以形成 1 个共价键 ,C 和 Si 最外层有 4 个电子 , 可以形成 4 个共价键 ,N 最外层有 5 个电子 , 可以形成 3 个共价键 ,O 、 S 、 Se 最外层有 6 个电子 , 可以形成 2 个共价键。逐一分析 ,D 中的 C 、 Si 成键不合理。 [ 来源 【 答案 】D 16. 下列事实不能用键能的大小来解释的是 ( ) A. 氮元素的电负性较大 , 但 N 2 的化学性质很稳定 B. 惰性气体一般难发生反应 C.HF 、 HCl 、 HBr 、 HI 的稳定性逐渐减弱 D.F 2 比 O 2 更容易与 H 2 反应 【 解析 】 本题主要考查键参数的应用。由于 N 2 分子中存在 N ≡ N 三键 , 键能很大 , 破坏共价键需要很大的能量 , 所以 N 2 的化学性质很稳定 , 惰性气体都为单原子分子 , 分子内部没有化学键 , 卤族元素从 F 到 I 的原子半径逐渐增大 , 其氢化物中的键长逐渐变长 , 键能逐渐变小 , 所以稳定性逐渐减弱。由于 H—F 的键能大于 H—O, 所以二者比较更容易生成 HF 。 【 答案 】B B 【 答案 】 (1)184.9 (2)A 多 18. 1919 年, Langmuir 提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。 (1) 根据上述原理,仅由第二周期元素组成的共价分子中,互为等电子体的是: ________ 和 ________ , ________ 和 __________ ; (2) 此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与 NO 互为等电子体的分子有: ________ 、 ________ 。 【 解析 】 (1) 仅由第二周期元素组成的共价分子中,即 C 、 N 、 O 、 F 组成的共价分子,如: N 2 与 CO 电子总数均为 14 , CO 2 与 N 2 O 电子总数均为 22 。 (2) 依题意,只要原子数相同,价电子总数也相同,即可互称为等电子体, NO 为三原子,其价电子总数为: (5 + 6×2 + 1) , SO 2 、 O 3 也为三原子,各分子价电子总数均为 6×3 = 18 。 【 答案 】 (1)N 2 CO CO 2 N 2 O (2)SO 2 O 3 【 解析 】 同种原子之间形成的共价键是非极性键,特殊共价键是中间 O 原子提供的 2 个电子,和旁边两个 O 原子各提供的一个电子,形成一个三原子四电子大 π 键。 O 2 与 O 3 是同素异形体。等电子体的分子结构相似, O 3 与 SO 2 是等电子体。 O 3 分子的两端的原子各有 2 对孤对电子,中间的原子有一对孤对电子,共有 5 对孤对电子。 【 答案 】 (1)σ 大 π (2) 同素异形体 (3)C (4)5 (5)1 4 1 4 2 【 解析 】 本题主要考查键能的定义以及键能与化学键稳定性的关系。 (1) 键能是指气态基态原子形成 1 mol 化学键释放的最低能量 , 新键形成释放能量 , 则旧键断裂必然吸收能量 , 根据能量守恒定律断开 1 mol Cl—Cl 键吸收的能量等于形成 1 mol Cl—Cl 键释放的能量。 (2) 键能越大 , 化学键越稳定 , 越不容易断裂 , 化学性质越稳定 , 因此最稳定的单质为 N 2 , 最不稳定的单质是 I 2 , 最稳定的化合物是 H 2 O, 最不稳定的化合物是 HI 。 (3)Δ H=E( 反应物键能之和 )-E( 生成物键能之和 )=(436+243-2×432) kJ·mol -1 =-185 kJ·mol -1 。 【 答案 】 (1) 吸收 243 (2)N 2 I 2 H 2 O HI (3)Δ H=-185 kJ·mol -1查看更多